离域π键的形成及π电子的计算方法
2022-03-14孔德坤刘紧娥
孔德坤 刘紧娥
(1.昆明市第一中学 2.安宁中学)
离域π键是现今高考考查的内容之一,π电子数的计算是难点,那么应如何确定π电子数呢? 本文整理离域π键的形成和计算方法,以供同学们参考学习使用.
1 离域π键的形成和表示方法
1.1 离域π键的定义
形成化学键的π电子不局限于两个原子的区域,而是在参加成键的多个原子的分子骨架中运动,这种由多原子的p轨道“肩并肩”重叠形成的π型化学键称为离域π键.
1.2 离域π键的形成条件
1)参与形成离域π键的原子共平面,即连接这些原子的中心原子只能采取sp或sp2杂化;
2)每个原子都有未参与杂化的p轨道,p轨道相互平行且垂直于该分子所处的平面;
3)π电子总数小于参与成键p轨道数的2倍.
1.3 离域π键的表示方法
2 离域π键中π电子数的计算方法
方法1第一步:确定分子中总价电子数;
第二步:画出分子中的σ键及不参与形成离域π键的p轨道(即平行的孤对电子轨道);
第三步:总价电子数减去这些σ键电子数和孤对电子数,剩余的就是填入离域π键的电子数.
方法2画出分子结构式中的基本骨架,只画出单键,需要成键但是未形成单键的电子就是π电子,如果该原子形成的共价键数已饱和,则该元素提供1对电子数计入π键电子数,如为阳离子减去所带电荷数,如为阴离子则加上所带电荷数(或把离域π键看成路易斯结构式中的π键与邻近原子的平行轨道中的孤对电子“共轭”,参与“共轭的”电子就是大π键中的电子).
2.1 价电子数为偶数的分子或离子中所含离域π键中π电子数的计算
BF3价电子总数为3+3×7=24,σ电子总数为3×2=6,孤对电子数为2×6=12,离域π键电子数为24-6-12=6,所含离域π键为.
CO2价电子总数为4+2×6=16,σ电子总数为2×2=4,孤对电子数为2×4=8,离域π键电子数为16-4-8=4,所含离域π键为.
O3价电子总数为3×6=18,σ电子总数为2×2=4,孤对电子数为2×5=10,离域π 键电子数为18-4-10=4,所含离域π键为.
上述物质中CO2和O3含有的离域π键都是,但二者的空间构型不一样,那么二者所含有的离域π键的数目一致吗? 下面详细分析CO2和O3的分子结构.
1)CO2(直线形)中的离域π键
根据VSEPR 模型,CO2属于AX2E 分子,中心原子没有孤对电子,电子完全成键,是直线形.根据杂化轨道理论,C 采取sp 杂化.当某原子采取sp 杂化时,它的2个未参与杂化的p轨道在空间的取向是与sp杂化轨道的轴呈正交关系,即相互垂直,杂化类型均为sp杂化,因而CO2分子有2套相互平行的p轨道,每套都是3轨道4电子,即1个CO2分子中含有2个.可以理解为电子来源于两端氧原子的孤对电子,中心C原子只提供空轨道.若用上述所给方法2,也可以理解为C 在每个中提供1个电子,而2个O 中一个提供1 个电子,另一个提供2 个电子.此外,根据等电子体原理(具有相同通式AXm,且价电子数相等的离子和分子具有相同的结构特征,称等电子体原理),CNS-、、N2O中心原子为sp 杂化,空间构型为直线形,均含有2个.
2)O3中的离域π键
根据VSEPR 模型O3属于AX2E 型分子,分子中的中心原子有1对孤对电子,理想模型为平面三角形(包括O 上的孤对电子).实际上根据杂化轨道理论,中心O 原子为sp2杂化,中心O 还有1个垂直于分子平面的p轨道,端位的每个O 只可能有1个垂直于分子平面的p轨道,另外2对孤对电子占据的轨道在分子平面上,空间构型为V 形,因此O3分子中,只存在1个.同理,SO2、NO2,分子空间构型为V 形,只存在1个.
2.2 价电子总数为奇数的分子中所含离域π键π电子数的计算
1)NO2分子中离域π键π电子数的计算
根据方法1,NO2价电子总数为5+2×6=17,σ电子总数为2×2=4,孤对电子数为5×2=10,离域π键电子数为17-4-10=3,所含离域π键为.但实际上对NO2的π电子结构有两种观点:
a)认为单电子处于N 的1个sp2杂化轨道上,剩余p轨道形成,NO2分子的键角大于120°,以及单电子占据杂化轨道容易二聚形成O2N—N2O;
b)1对孤对电子占据N 的1个sp2杂化轨道,剩余的p轨道“肩并肩”形成,因为单电子占据杂化轨道能量比孤对电子能量高.
分子的电子自旋共振及分子轨道的量子化学计算结果更支持第一种观点.
2)ClO2分子中离域π键π电子数的计算
根据方法1,ClO2价电子总数为7+2×6=19,σ电子总数为2×2=4,孤对电子数为5×2=10,离域π键电子数为19-4-10=5,所含离域π键为.
根据对实际分子或离子的分析,可归纳总结如下:一般参与形成离域π键的原子提供的电子是“有单电子用单电子(即该原子提供1个电子),无单电子用孤对电子(即该原子提供2个电子),单电子和孤对电子均无不提供电子,只提供空轨道”.
2.3 利用方法2计算有机物中离域π键电子数
1)苯环中每个碳均采取sp2杂化,每个碳形成4条共价键,根据图示知,每个碳提供1个电子参与形成离域π键,故所含离域π键为.
根据上述分析可知对于无机物分子或离子利用方法1直接得出分子或离子的离域π键电子数,比较容易计算,如果参与成键的原子均为sp杂化,可能会含有2个离域π键,对于参与成键的原子均为sp2杂化,价电子总数为奇数时,一定要根据形成离域π 键的分子或离子的具体性质作出合理判断,同时注意参与成键原子提供的总电子数一定小于p轨道的2倍(ClO2中为而不是的原因);对于有机物分子,一般参与形成离域π键的原子均为sp2杂化,利用方法2计算比较简单.
例(2017年全国Ⅱ卷,节选)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,用R 表示,经X 射线衍射测得化合物R 的晶体结构,其局部如图1所示.
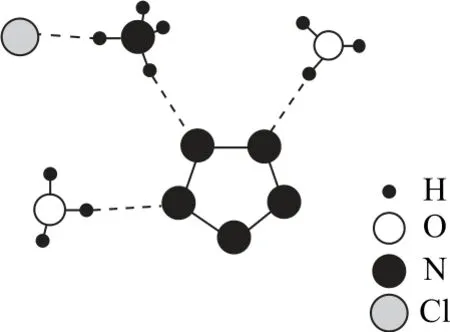
图1

(完)
