结节性硬化伴难治性癫痫19 例mTORC1 信号通路活性检测及治疗
2022-03-14贺影忠姚如恩王纪文
贺影忠 李 松 姚如恩 王纪文
1.上海交通大学医学院附属上海儿童医学中心(上海 200127);2.上海交通大学医学院上海免疫学研究所(上海 200025)
结节性硬化(tuberous sclerosis,TSC)是累及多器官系统的常染色体显性遗传性疾病。TSC 在人群中的发病率为1/6000,近90%的TSC 患者伴有癫痫发作。致病基因TSC 1、TSC 2分别位于常染色体9 q 34、16 p 13.3[1],其基因产物负反馈调节mTOR信号转导通路。TSC 1或/和TSC 2基因变异可引起mTOR信号异常激活,细胞增殖及生长不受控制,从而形成多部位错构瘤等病理改变,同时可导致异常的神经网络形成,并诱发癫痫[2-4]。
目前,TSC 合并癫痫的临床诊断和药物选择日趋成熟,雷帕霉素等mTOR 通路活性抑制剂应用于临床也逐渐得到认同,有国际和国内专家指南共识[5-6]。雷帕霉素是基于TSC发病机制的治疗用药,通过抑制mTOR复合体蛋白磷酸化从而抑制mTOR信号转导通路的转导[3]。但是雷帕霉素在临床应用存在一些问题,因此迫切需要能反应mTOR 信号通路的活性并及时反馈用药有效性的检测指标。本研究在检测TSC 伴难治性癫痫患者的mTOR 通路中mTORC1活性的基础上,通过监测血细胞mTORC1活性,结合血药浓度,着重评估患者体内对不同浓度雷帕霉素的有效性,为临床使用雷帕霉素及选择合适的药物剂量提供理论依据。
1 对象与方法
1.1 研究对象
收集2019 年5 月至2020 年10 月在上海交通大学医学院附属上海儿童医学中心就诊的TSC伴难治性癫痫患儿的临床资料。TSC诊断参照2012年国际结节性硬化协作组新定义的TSC诊断标准[7]。遗传基因诊断标准:正常组织DNA检查确定有TSC1或TSC2基因致病性变异即可确诊TSC。药物难治性癫痫诊断标准:患儿经过两种或以上正规抗癫痫药物(AEDs)治疗后(血药浓度在有效范围内),癫痫发作频率仍未完全控制或未减少一半,严重影响患儿的日常生活。排除标准:①服药前化验或体格检查不合格者,具有严重的心肝肾疾病患者;②不愿或不能继续参加本试验者。出现严重不良反应或因故中断治疗而无法评价疗效者;③未到医院进行定期复查者(每1~3个月到院随访1次)或因资料不完整且失去联系或不愿意配合随访者;④入选前3 个月内已经接受其他临床试验者,入组患儿监护人签署书面知情同意书。
雷帕霉素初始剂量均为每天1mg/m2体表面积,使用2~4周后根据雷帕霉素谷浓度和活性调整剂量,并维持治疗随访观察至少6个月,在随访期间AEDs种类未发生调整。
1.2 雷帕霉素浓度检测方法
使用均相酶免疫测试技术分析全血中雷帕霉素含量。样品中雷帕霉素与酶试剂中标记重组6-磷酸葡萄糖脱氢酶(G6PDH)的雷帕霉素竞争性结合抗体,导致动态吸收光谱的改变,通过光密度计进行测定,操作步骤见相关文献[8]。
1.3 mTOR信号通路活性检测方法
mTOR 信号通路主要由2 个包含mTOR 分子的复合物即mTORC 1 和mTORC 2 及其主要下游底物组成。底物S6第235位和第236位丝氨酸磷酸化(磷酸化抗体S6-S235/236)可以间接反映mTORC1活性,丝氨酸/苏氨酸蛋白激酶AKT第473位丝氨酸的磷酸化(磷酸化AKT-S473)可反映mTORC2活性。mTORC1活性检测操作参照文献[9]。
通过流式细胞仪检测荧光抗体并绘制图表,纵坐标显示CD4或CD8细胞数,横坐标显示mTORC活性。mTORC1和mTORC2活性分别由其对应下游信号分子S 6 和AKT 的磷酸化含量来反应,磷酸化越显著曲线越右移,表明mTORC活性越高。
2 结果
2.1 一般资料和基因检测结果
共收治26例TSC患儿,难治性癫痫并发症25例,其中3 例患儿家属拒绝使用雷帕霉素,22 例TSC 伴难治性癫痫患者治疗过程中2例失访,1例用药半年后发生胃肠炎家属自行停药。入组19例TSC伴难治性癫痫患儿年龄8个月~13岁(中位年龄6岁),男性11例、女性8例。19例患儿均出现脑部结节,17例有皮疹,10例伴肾囊肿/平滑肌瘤,10例伴心脏横纹肌瘤(其中1例退化),1例出现肝结节。19例患儿发生癫痫后均规范使用2 种以上抗癫痫药物,抗癫痫药物血药浓度在有效范围内,癫痫未控制。见表1。
19 例患儿均检测TSC基因,3 例未见异常,4 例为TSC1变异,12例为TSC2变异。16例发现变异的患儿中,无义变异6例,移码变异4例,错义变异4例,剪切位点变异2例。见表1。
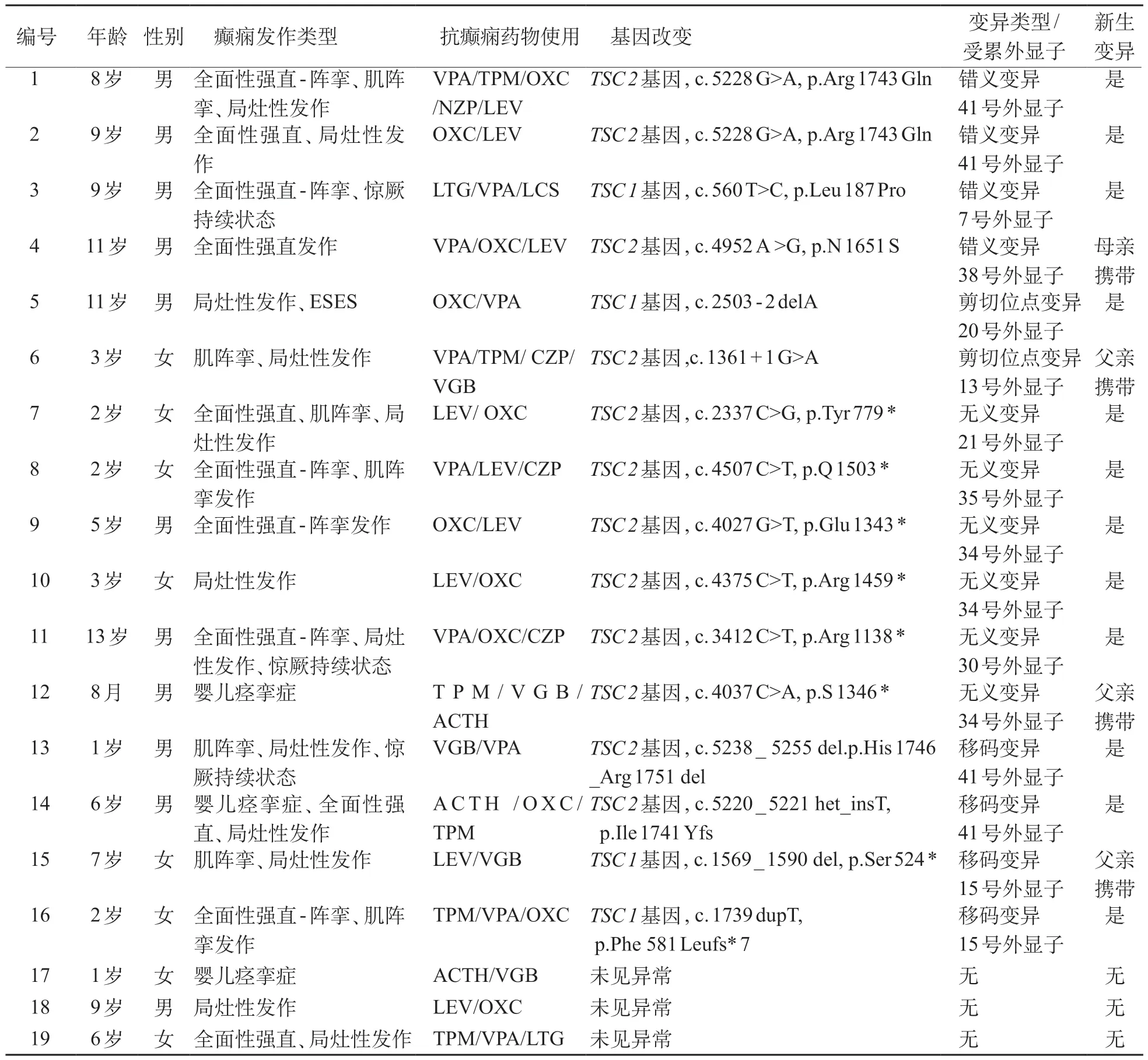
表1 19例TSC伴难治性癫痫患者临床、基因变异及抗癫痫药物使用情况
2.2 雷帕霉素血浓度和mTOR信号通路活性
TSC 伴难治性癫痫患儿mTORC 1 活性均高于对照组(图1)。雷帕霉素用药剂量增大,患者血细胞mTORC1活性也会逐渐下降(图2)。

图1 外周血细胞mTORC1 和mTORC2 活性测定结果

图2 使用雷帕霉素前后外周血CD8 细胞mTORC1活性检测结果
患儿雷帕霉素治疗初始剂量为1mg/(m2·d),随访监测患儿mTORC1活性和血雷帕霉素浓度,根据mTORC1活性和血雷帕霉素浓度调整剂量。如果患儿mTORC 1 活性高于正常对照或血雷帕霉素浓度<3.0ng/mL,增加雷帕霉素剂量。达到稳态血药浓度时药物剂量1~2mg/(m2·d),血浓度波动于3.0~10.7 ng/mL,平均浓度(6.87±2.01)ng/mL。
2.3 治疗及预后
患儿使用雷帕霉素治疗,维持期雷帕霉素平均浓度为(6.87±2.01)ng/mL,用药后随访至少半年以上,全部患儿惊厥得到不同程度控制,其中12 例完全控制,7例发作次数减少50%以上,其中3例发作次数减少75%以上。利用线性回归分析,以雷帕霉素为自变量,惊厥控制程度为因变量(惊厥控制为1,惊厥减少75%为0.75,惊厥次数减少50%为0.5)得到的一元回归方程为y=0.0251x+0.6035,R²=0.02661,拟合度较差,提示雷帕霉素平均浓度与癫痫控制没有线性关系。用药期间有2 例患儿出现一过性口腔溃疡,未发现其他不良反应。
3 讨论
雷帕霉素靶蛋白是一种从酵母到人类在进化上非常保守的丝氨酸苏氨酸蛋白激酶,其蛋白产物为雷帕霉素和FKBP12(FK506 binding protein)结合后的靶点,因此将哺乳动物中相应蛋白命名为哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)或者雷帕霉素机制性靶标(mechanistic target of rapamycin,mTOR)。mTOR 蛋白在细胞中参与形成两种各自具有特定结构和功能的蛋白复合体,即对雷帕霉素敏感的mTOR 复合体1(mTORC 1)和对短期雷帕霉素处理不敏感的mTOR 复合体2(mTORC 2)。mTOR 复合体(mTORC)通过调控其底物的活性调节细胞的分解合成代谢和自噬进而控制细胞生长[10],可调节神经系统神经元迁移和增殖、突触生长和可塑性,增强神经兴奋性,并于个体发育停止后继续调节神经元和胶质细胞功能[3,11]。mTOR 途径过度激活引起神经元变异,表现出药物难治性癫痫、行为异常和认知障碍其他神经精神症状相关的神经系统表现[12-13]。使用mTOR 抑制剂可以获得改善,因此mTOR 及其信号转导通路成为相关神经系统疾病治疗的靶点之一。第一代mTOR抑制剂包括雷帕霉素(又名西罗莫司)及其衍生物依维莫司。第二代mTOR 抑制剂目前尚处于探索阶段。
本研究19例TSC伴难治性癫痫患儿,就诊年龄8月~13岁不等,临床均有颅内病变,这与选取的患儿均为TSC 伴癫痫症状有关。皮疹发生率89.5%,肾囊肿/平滑肌瘤和心脏横纹肌瘤发生率52.6%,但仅有1 例伴肝脏错构瘤,均无肺部淋巴管平滑肌瘤病,说明肝脏、肺部等部位病变可能更多见于年龄偏大的患者。19例患儿常规使用抗癫痫药物控制癫痫效果差。在众多抗癫痫药物中,奥卡西平、开浦兰、德巴金和妥泰是使用频率最高的药物。虽然对于TSC患者伴婴儿痉挛症,喜宝宁作为一线治疗,类固醇和经典抗癫痫药物为二线治疗[1],但促肾上腺皮质激素(ACTH)和喜宝宁在中国许多地方尚不能获得,因此其使用受到一定限制。
TSC基因变异多样,一般TSC 1致病性变异占30%左右。TSC2基因中变异个数远大于TSC1基因,TSC1基因包含23个外显子,TSC2基因包含42个外显子[14]。TSC 1和TSC 2基因变异类型有5 种:错义变异、无义变异、移码变异、剪切变异和大片段缺失,以错义变异、剪切变异和移码变异的发生率最高。TSC 1基因变异是无义变异或移码变异、剪切变异,从而导致蛋白质翻译过程提前终止。而TSC 2的变异多为错义变异(25%~32%)、大片段缺失或重组(12%~17%)[15]。本研究中,TSC基因未发现变异有3例,占15.8%;基因变异中TSC1、TSC2致病性变异占比分别为25%和75%,约为1∶3,以无义变异、错义变异和移码变异发生率最高。3例患儿未检测出变异考虑可能是父母存在生殖细胞嵌合或内含子序列受累,或者还有身份不明的基因位点或其他类型基因变异。
雷帕霉素属于大环内酯类药物,主要作用于哺乳动物mTORC 1 蛋白,可与FKBP 12 形成复合物,实现对mTOR 及其下游信号分子的抑制,临床上已经开始用于治疗结节性硬化伴癫痫患者[2-4]。2006年Franz 首次报告5 例TSC 患者室管膜下巨细胞型星形细胞瘤(SEGA)予西罗莫司治疗后体积均缩小,而停药后体积再次增大。mTOR 抑制剂不仅可缓解TSC症状包括皮肤病变[16],也对治疗TSC相关癫痫有效[17-18]。French等[19]发现TSC患者癫痫的控制率与mTOR抑制剂有剂量依赖性,长期治疗效果更好。早期使用mTOR抑制剂不仅可预防TSC继发的癫痫,同时可以减少其他神经系统症状,抑制SEGA生长,减少结节数目和缩小体积[20]。本组患儿用药后随访,12例惊厥控制,7例惊厥发作次数减少50%以上,说明雷帕霉素能有效控制癫痫发作。同时发现,雷帕霉素用药剂量增大,患者血细胞mTORC1活性也会逐渐下降,9 例患儿雷帕霉素加至每日1.5 mg/m2,1例患儿加至每日2 mg/m2时mTORC1活性基本降至正常对照。结合文献我们把雷帕霉素初始剂量定为1 mg/(m2·d)。但雷帕霉素是mTOR抑制剂,主要是抑制瘤体增长,从而间接抑制惊厥发作,所以短期随访显示雷帕霉素平均浓度与癫痫控制不呈正相关,两者关系还需要长期随访疗效的大样本资料。2例TSC基因正常的患儿使用雷帕霉素后癫痫控制,提示未检测出基因变异患者预后更好,但需要更多的循证医学证据。
临床上主要通过监测雷帕霉素浓度对患者用药剂量进行调节。但雷帕霉素应用仍存在以下问题:①雷帕霉素过量使用会导致一系列不良反应,比如代谢紊乱、心血管不良反应和胃肠紊乱,其中最严重的不良反应是免疫抑制引发严重感染,如呼吸道感染、脓毒症和泌尿道感染[21],这些都是临床用药需要重点考虑的问题。②雷帕霉素用药剂量有效范围很大,文献报道为1~5mg/(m2·d),针对每例患者的个体化最适用药剂量的研究目前国内外还是空白[2]。③用药后血药浓度检测正常值范围非常宽(血药浓度正常值 0~30 ng/mL),根据血药浓度临床调整用药剂量非常困难,不符合当前提倡的精准个体化治疗要求。④许多医院目前还不能进行血药浓度检查,标本外送化验结果不及时。因此迫切需要能及时反应mTOR信号通路的活性并及时反馈用药有效性的检测指标。
本研究患儿随访半年,根据雷帕霉素浓度和mTORC 1 活性变化调整剂量,患儿使用剂量在1~2mg/(m2·d),平均剂量为1.3mg/(m2·d),平均血浓度为(6.87±2.01)ng/mL,这与文献报道的最适浓度基本一致。但血浓度个体差异大,测定值波动于3.0~10.7ng/mL,说明单纯依靠血浓度数值变化调整剂量还不能满足个体化精准用药方案。同时人群遗传背景存在异质性,比如mTOR 通路不同蛋白的变异,相同蛋白不同位点的变异,即使是同一蛋白的相同变异,在不同的遗传背景下对雷帕霉素的反应也不完全相同,血药浓度只是在测量抑制剂的多少,并不能完全反应mTORC1活性是否恢复正常,而mTORC 1 活性恢复正常使病情有效控制并减少不良反应才是最终目标。所以,如果结合mTORC 1活性测定来定一个比较合理的血药浓度区间,能更方便临床医师快速掌握患者用药剂量和mTOR 信号通路活性变化的相关性,对用药剂量进行实时调整。
用流式细胞仪检测mTORC 1 活性目前也存在不足。mTORC1通路活性测定是根据底物蛋白分子S6K或者S6的磷酸化进行相对定量,无法精确进行绝对值定量,目前样本量少,即使设计决定定量方法也暂时无法评估其是否正确,需要累积数据;同时个体mTORC活性受饮食、抗癫痫药物等较多影响,每次检测需要当天和受试人相同饮食的正常人对照标本。如何通过比较S 6 K 或者S 6 蛋白量和磷酸化给mTORC 活性数字化并结合大量正常样本和病人样本进行正常值的规定,将是下一步研究的重点。
对19 例TSC 伴难治性癫痫患儿雷帕霉素治疗研究发现,定期检测患者mTORC 1 活性变化,同时结合患者临床用药后惊厥控制情况、药物不良反应、血药浓度来调整用药剂量,对有效控制发病并避免不良反应提供一种思路,可作为mTOR 通路异常的谱系疾病使用雷帕霉素治疗的用药参考,为临床选择合适的雷帕霉素剂量提供理论依据,有望为患者个体化用药提供更精准的治疗方案。
