TTF电极阵列及头皮保护技术对放疗剂量分布影响的初步研究
2022-03-14胡小洋韩磊汪洋孙磊倪春霞刘颖
胡小洋,韩磊,汪洋,2,孙磊,倪春霞,刘颖
1.上海伽玛医院放疗科,上海 200235;2.复旦大学附属华山医院放射治疗中心,上海 200040;3.复旦大学附属华山医院射波刀中心,上海 200040;4.上海理工大学医疗器械与食品学院,上海 200093
前 言
胶质母细胞瘤(Glioblastoma,GBM)是恶性程度最高的原发性中枢神经系统肿瘤[1-2]。目前,针对GBM 的规范治疗是最大限度的手术安全切除,术后辅助放疗联合替莫唑胺(Temozolomide, TMZ)同步化疗、TMZ 序贯化疗,尽管如此,患者的中位生存期只有14.6个月,5年生存率约为5.1%,预后差[3]。
肿瘤治疗电场(Tumor Treating Fields,TTF)是一种新型肿瘤治疗手段,它是一种中等强度、低频的交变电场,作用靶点是细胞纺锤体,作用机制是抑制细胞的有丝分裂[4]。2018年,NCCN 将TTF联合化疗作为新诊断GBM 术后治疗的I 类推荐[5]。2019年,国家卫生健康委员会公布的《脑胶质瘤诊疗规范(2018版)》也推荐TTF 用于新诊断GBM 和复发高级别胶质瘤[6]。TTF 的治疗效果与依从性(每天佩戴治疗时间/24 h)密切相关,针对新诊断GBM 的Ⅲ期临床试验EF-14 表明,接受TTF 治疗的患者中,依从性高的患者(每天佩戴时间大于18 h)的总生存期高于每天佩戴小于18 h 的患者,两者有显著差别(22.6 个月vs19.1 个月,P=0.009),尤其是每天佩戴大于22 h 的患者生存获益最大,5年生存率达到29.3%[7]。
EF-14 的研究方案,TTF 是在放疗后与化疗同期使用。美国正在开展EF-32试验,评价放疗同期使用TTF的疗效。在放疗同期使用TTF治疗,可以提早进行TTF 治疗的时间,同时临床前研究和初步的临床研究显示放疗同期使用TTF,会起到放射增敏作用并提高疗效[8-9]。对于放疗同期使用TTF 治疗,可以采用放疗时取下电极阵列的方法,也可以采用不取下电极阵列的方法,后一种方法能缩短因每天取下和再贴上电极片所耗费的时间,延长患者每天佩戴电场阵列治疗时间,同时减少TTF 的消耗。EF-32 试验大多采用后一种方法,患者定位时,一般会在头枕和面罩上敷贴6.4 mm 厚海绵,海绵的作用是增加患者放疗时佩戴电极阵列时的服帖性,提高患者舒适度,TTF 采用的海绵不含乳胶。行常规定位CT 扫描,在定位CT 上制作治疗计划,在治疗时佩戴TTF,无需取下。
TTF电极贴片是高密度物体,在辐射场中可能会对剂量分布产生影响[10]。一方面,由于建成效应可能会增加TTF 电极下方的皮肤组织剂量;另一方面,TTF阵列可能会对射线产生衰减,降低深度组织的剂量。本文通过物理测量和放疗计划两个方面初步研究TTF 电极阵列对放疗剂量的影响,并尝试解决方案。
1 材料与方法
1.1 物理测量
使用IBA RW3 固体水、DOSE1 剂量仪、CC13 电离室。条件采用SSD=100 cm,10 cm×10 cm 方野,深度为1~10 cm。测量TTF 电极阵列对于中心点吸收剂量的影响及固定用海绵对于中心点吸收剂量的影响。所有数据以无TTF电极阵列及海绵时,深度1.5 cm的值为归一点。
使用IBA MatriXX 平板,OmniPro I'mRT 测量软件。条件采用SAD=100 cm,20 cm×20 cm 方野,MatriXX 平板本身建成为0.3 cm,测量深度取0.3、1.5、5.0 cm。测量TTF电极对二维平面剂量的影响。
1.2 放疗计划数据研究
1.2.1 模体影像获取使用ACR 头部模体,按照患者定位流程,采用专用B 枕固定,首先在模体头部敷贴无乳胶海绵(美国Jaybird & Mais 30/31 产品,厚度0.64 cm)。扫描定位CT,扫描电压为140 kV,电流为250 mA。扫描层厚2.5 mm,定义为标准CT1。然后在模体头部模拟患者敷贴TTF 电极阵列,再敷贴海绵,扫描定位CT,采用相同的扫描参数,定义CT 为CT-TTF1。再改变模体上TTF电极阵列的位置,扫描定位CT,采用相同的扫描参数,定义此CT 为CTTTF2。将得到的CT影像传入Monaco 5.11中。
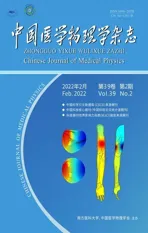
1.2.2 靶区及危及器官勾画以标准CT1 为基准,勾画晶体、视神经、眼球、垂体等危及器官。勾画患者表皮下5 mm 的组织,定义为头皮,如图1所示,蓝色区域为头皮组织。选取接受放疗同步TTF 治疗的患者8 例,将他们的放疗临床靶区CTV 复制到模体的标准CT1 上,并由医生根据模体CT 修改,模拟实际的靶区位置。计划靶区PTV为CTV外扩3 mm。
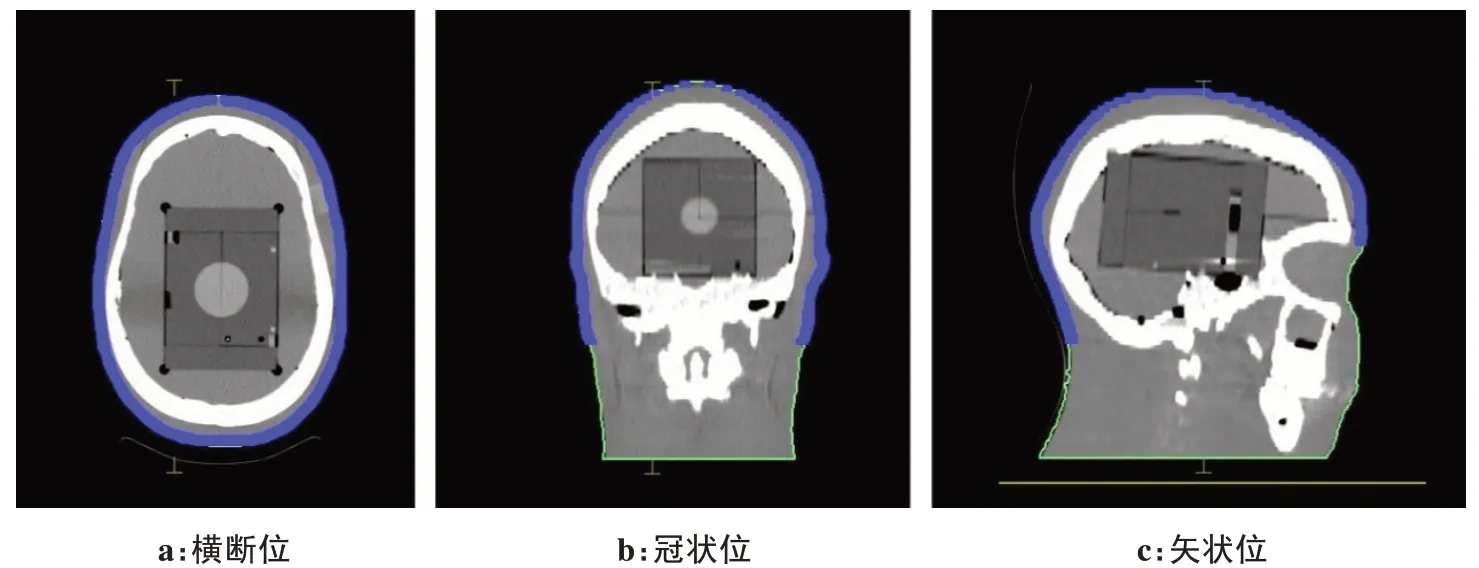
图1 头皮组织示意图Figure 1 Images of the scalp
TTF 电极贴片的主要成分为陶瓷,直径约2 cm,厚度约2.5 mm,密度约为7.75 g/cm3,定位CT 上出现大量伪影,如图2所示,左侧为带有TTF 电极阵列的定位影像。X线穿过金属时,光子的射束硬化和损失形成的金属伪影使影像质量明显下降[11-12],且伪影难以校正,对剂量的计算产生明显的影响[13]。本研究采用的方法是在CT-TTF1、CT-TTF2上勾画出TTF电极阵列,将CT-TTF1、CT-TTF2 分别与标准CT1 进行融合,将TTF 电极阵列复制到标准CT 上。按照实际中TTF电极阵列敷贴患者头皮的情况,对复制的TTF电极阵列做位置修正,将其完全敷贴于模体轮廓上,得到3 幅定位CT,分别是标准CT1、带有CT-TTF1 上电极阵列的CT2及带有CT-TTF2上电极阵列的CT3。
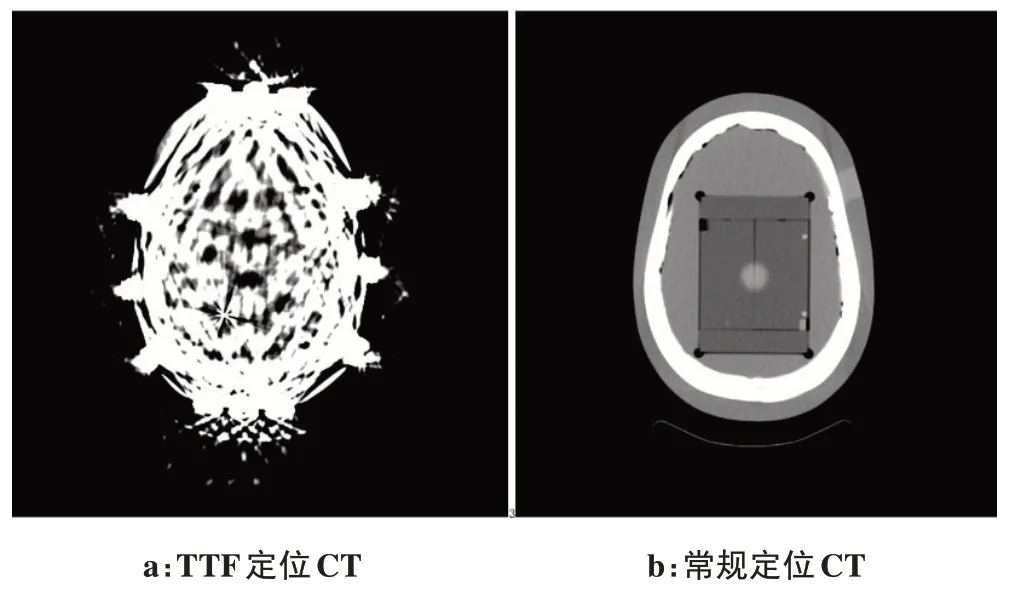
图2 TTF的定位CT和常规定位CTFigure 2 Positioning CT with tumor treating fields(TTF)and conventional positioning CT
1.2.3 放疗计划的设计所有的计划设计都基于Monaco 5.11 治疗计划系统(Treatment Planning System, TPS),直线加速器为Elekta Synegy 配备Agility机头。Agility机头具有共80对160片叶片,等中心处为5 mm。
在CT1 上设计VMAT 计划,计划设置为1Beam2Arcs,计划算法为蒙特卡罗算法,计算网格为2.5 mm,每个Arc的最大控制点为100,最小的子野宽度为5 mm,剂量沉积计算基于介质方式,蒙特卡罗算法的统计学不确定度为0.7%。靶区PTV 的处方剂量为首程剂量40 Gy/20 次,计划中心为PTV 靶区中心。要求结果满足处方剂量包含95%的靶区,正常组织满足给定的限值。将在CT1 上优化好的计划,原机器跳数(Monitor Units,MUs)、子野形状、等中心位置等都不变的情况下,在CT2、CT3 上重新计算,研究TTF电极阵列对剂量的影响。
1.2.4 头皮保护计划的设计设计头皮保护计划,使用的VMAT 计划参数设置与常规计划相同,在计划设计时,加入勾画的头皮结构为危及器官,优化时限制其高量区域。使用Overdose DVH 函数,参数设置标准为1 500 cGy、20%的体积及2 000 cGy、5%的体积。对于不同计划,为满足靶区剂量分布或者更低的头皮剂量,参数中使用的体积限值略有变化。使用Max Dose函数,参数设置为3 000 cGy,限制其最大剂量。按照美国EF-32试验的推荐,将头皮剂量限制为Dmean<20 Gy,D20cc<50 Gy,D30cc<40 Gy[14],评估头皮保护计划相对常规计划对头皮高量区域的限制。
1.2.5 计划评估靶区PTV剂量学参数评估为均匀性指数(HI)、适形度指数(CI)、Vref、D1%、D99%、Dmax、Dmean。HI=D5%/D95%,表示最高的5%PTV接受的剂量与最低的95%PTV接受的剂量之比,HI接近1时表示PTV的均匀性最好。CI=V2ref/(VT×V0),其中Vref为处方剂量包绕的靶区体积,VT为靶区体积,V0为处方剂量的等剂量线所包绕的全部体积,CI接近1表示靶区的适形度越好。Vref评估处方剂量包绕的靶区体积,D1%与Dmax评估靶区的最大剂量,D99%评估靶区接受的最小剂量,Dmean评估靶区的平均剂量。危及器官评估晶体、视神经、垂体接受的最大剂量,评估头皮的D20cc、D30cc、Dmean和Dmax(D20cc表示头皮20 cc体积接受的最大剂量,D30cc表示30 cc体积接受的最大剂量)。对于头皮保护计划,对比其与常规计划的靶区参数和头皮剂量,比较机器跳数MUs。
1.3 统计学方法
采用SPSS19.0 软件对数据进行分析,符合正态分布的计量资料用均数±标准差表示,两组间数据采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 物理测量结果
无乳胶海绵对于中心点剂量差异见图3,在建成区,无乳胶海绵会略微增加建成区剂量,深度1.0 cm处升高2.05%,1.5 cm 处升高0.44%。在2.0 cm 之后,对剂量基本没有影响。在定位CT 上,无乳胶海绵的CT 值大约为-800 HU,密度接近空气,理论上不会产生明显的建成效应,与实际测量一致。在TPS 中,无乳胶海绵没有包含在患者外轮廓结构内,不参与剂量计算。在本研究中不考虑无乳胶海绵的影响。
图3 无乳胶海绵的吸收剂量差异Figure 3 Difference in the absorbed dose of latex-free sponge
TTF电极阵列对中心点剂量的影响见图4,在深度1.0 cm 处,TTF 电极阵列的建成效应使剂量增高约2.58%。在1.5 cm处,TTF电极阵列使剂量衰减2.33%。从2.0 cm开始,剂量衰减大致相同,约3.4%~3.9%。
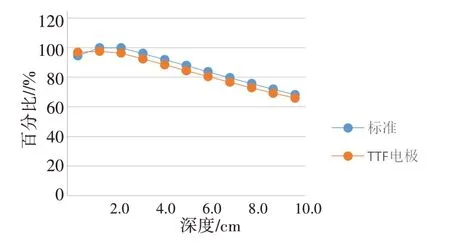
图4 TTF电极对吸收剂量的影响Figure 4 Effect of TTF electrodes on absorbed dose
二维平板测量的TTF 电极阵列引起的剂量差异见图5,图5从左至右依次为深度0.3、1.5、5.0 cm 的剂量对比图。在0.3 cm 处,因TTF 电极阵列的建成效应造成剂量升高约为10%。在1.5、5.0 cm 处,因TTF电极阵列对剂量的衰减,造成剂量降低约4.2%、4.0%。与点剂量测量结果接近。TTF 电极阵列在表浅建成区有明显的剂量升高,之后对剂量产生衰减,约为3.5%~4.0%。

图5 TTF对MatriXX剂量的差异Figure 5 Effects of TTF on Matrixx dose
2.2 计划剂量差异
Monaco TPS中剂量的计算是基于组织的相对电子密度(Relative Electron Density, R-ED),是以水的电子密度为基准得到的相对电子密度。TPS 中组织的相对电子密度是根据定位CT 的CT 值(HU)转化而来,为了剂量计算的准确性,针对不同的CT、扫描参数都应有其单独的HU 到ED 的转换曲线[15],TTF电极阵列在CT上的CT值大约为2 600~2 800 HU,在TPS 中对应的相对电子密度为2.3,但由于CT 值过大,使用的是HU-ED曲线的延展部分,距离实际值可能偏差过大。依据物理测量中心点5 cm 处有无TTF阵列的剂量比值96.1%。在TPS 中,建立30 cm×30 cm×30 cm 的水模体模型,采用SSD=100 cm,射野大小10 cm×10 cm,100 MUs 计算模体中剂量分布,记录5 cm 深度处的剂量。在模体表面勾画TTF 电极阵列,设定TTF电极阵列不同的R-ED,采用相同的射野参数,记录5 cm 深度处的剂量,比较不同R-ED 在5 cm 深度处的剂量比,得到TTF 电极阵列的R-ED 为3.0~3.2 时,与实测比值96.1%接近,在之后的计划计算中,对TTF电极阵列的R-ED取值为3.1。
2.2.1 TTF 电极阵列对计划剂量的影响CT1 的计划在CT2 上重新计算,CT1 的计划剂量与CT2 的计划剂量对比见表1和表2。通过表1可知,计划在带有TTF电极阵列的CT2上重新计算,靶区的Vref下降2.3%,D99%下降约0.6%,Dmean下降约0.55%,差异有统计学意义(P<0.05)。靶区的CI略有下降,靶区的D1%几乎没有差别,Dmax也下降约0.53%,差异无统计学意义(P>0.05)。表2是危及器官的剂量对比,在CT2上的剂量分布,左晶体Dmax升高1 cGy,右晶体Dmax下降约6 cGy,左侧视神经Dmax降低8 cGy,右侧视神经Dmax升高3 cGy,垂体Dmax升高5 cGy,整体剂量的差异不大,只有右晶体差异有统计学意义(P<0.05)。头皮的D20cc、D30cc、Dmean和Dmax都大幅升高,分别为8.8%、8.9%、8.1%和4.0%,结果差异均有统计学意义(P<0.05)。

表1 CT1与CT2的靶区剂量学差异Table 1 Dosimetric comparison of the target area in CT1 and CT2
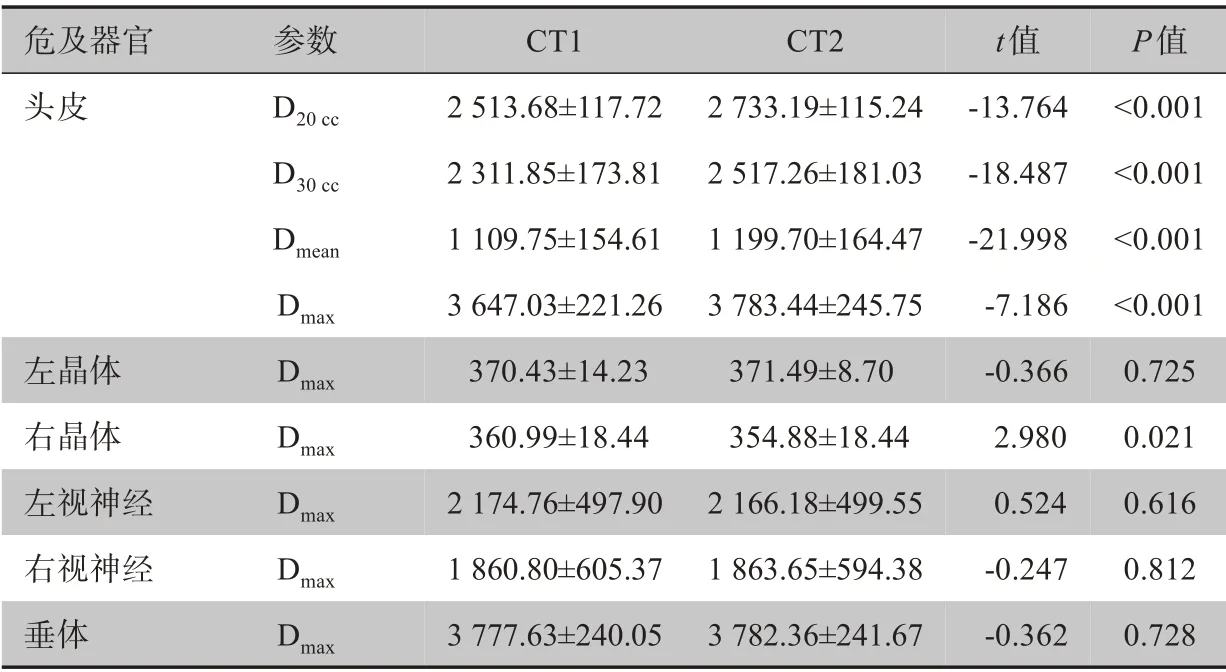
表2 CT1与CT2的危及器官剂量学差异(cGy)Table 2 Dosimetric comparison of organs-at-risk in CT1 and CT2(cGy)
2.2.2 TTF 电极阵列不同位置的剂量学差异不同TTF 电极阵列位置的CT2 与CT3 的计划数据对比见表3、表4。通过表3可知,TTF 电极阵列位置的变化对于靶区的剂量影响不大,CT3上的靶区剂量参数相对于CT2,Vref下降0.34%,D1%下降约6 cGy,D99%下降约4 cGy,差异有统计学意义(P<0.05)。Dmax、Dmean升高约14、6 cGy,但差异无统计学意义(P>0.05)。通过表4知,右晶体Dmax、头皮的D20cc、D30cc和Dmean差异均有统计学意义(P<0.05),CT3 的剂量参数相对比于CT2,左晶体Dmax降低3 cGy,右晶体Dmax上升8 cGy,左、右视神经Dmax降低约13、9 cGy,垂体Dmax下降5 cGy,整体剂量差异不大。对于头皮剂量,CT3整体低于CT2,头皮的D20cc、D30cc、Dmean和Dmax的变化为1.6%、1.2%、0.6%和0.9%。

表3 CT2与CT3的靶区剂量学差异Table 3 Dosimetric comparison of the target area in CT2 and CT3

表4 CT2与CT3的危及器官剂量学差异(cGy)Table 4 Dosimetric comparison of organs-at-risk in CT2 and CT3(cGy)
2.2.3 头皮保护计划的剂量差异对比表5、表6是头皮保护计划与未采用头皮保护的常规计划的剂量学差异,包含靶区剂量、危及器官剂量及计划间的MUs对比。通过表5可知,常规计划与头皮保护计划的HI、CI、Vref、D1%、D99%、Dmax、Dmean都非常接近,其中D99%差异有统计学意义(P<0.05)。通过表6可知,头皮保护计划对比常规计划的剂量差异,头皮保护计划的左、右晶体Dmax高约1、22 cGy,左、右视神经Dmax低约160、250 cGy,垂体Dmax低约6 cGy,右晶体Dmax差异有统计学意义(P<0.05)。对于头皮的D20cc、D30cc、Dmean和Dmax,头皮保护计划下降8.4%、7.0%、4.2%和19.7%,差异有统计学意义(P<0.05)。头皮保护计划的MUs相比于常规计划升高约18.7%,差异有统计学意义(P<0.05)。
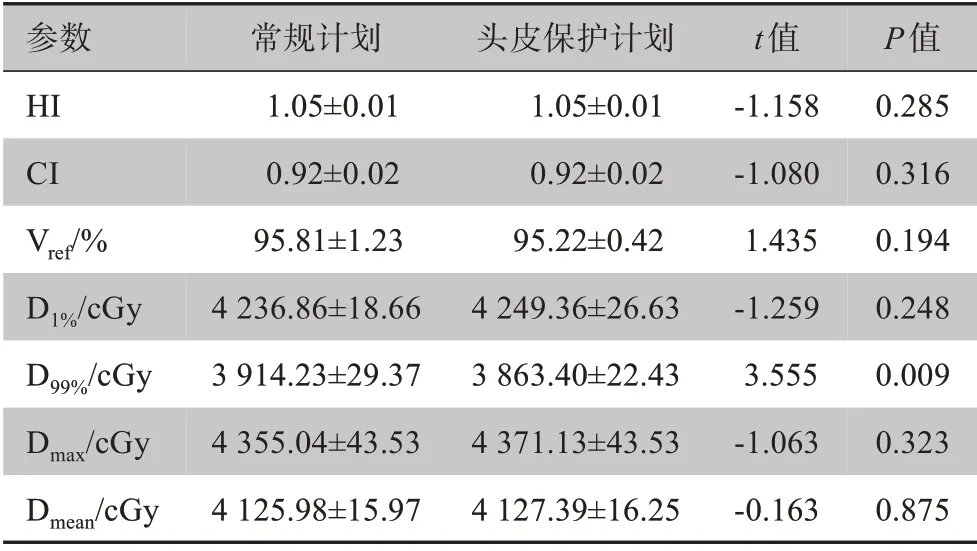
表5 头皮保护计划的靶区剂量学对比Table 5 Dosimetric comparison of the target area in scalp sparing plans

表6 头皮保护计划的危及器官剂量学差异(cGy)Table 6 Dosimetric comparison of organs-at-risk in scalp sparing plans(cGy)
3 讨论
TTF 作为最近10年内发展起来的技术,可明显延长新诊断GBM 患者的总生存期。《脑胶质瘤诊疗规范(2018年版)》推荐TTF 用于新发GBM(1 级证据)和复发高级别胶质瘤(2B 级证据)的治疗。国外的临床试验中,TTF 佩戴时间超过18 h/d,患者可明显获益。但TTF 治疗也有临床不良反应,最常见的就是接触电极片的皮肤不良反应[16],复发性GBM 试验表明,16%患者会出现I-II 级接触性皮炎,3%会出现严重皮肤不良反应[17],新诊断GBM 试验表明近一半患者会出现相关性皮肤不良反应,2%患者皮肤不良反应达到3级[18]。由于TTF电极阵列属于高密度,在放疗时,需要研究电极阵列对于辐射剂量的影响,以确保头皮表浅组织和危及器官的剂量在安全范围内,保证放疗顺利进行。
本研究结果显示,TTF电极阵列对于下方的组织有明显的剂量建成效应,在3 mm 处,剂量有大约10%的升高。对处方剂量40 Gy/20次的计划,头皮的D20cc、D30cc、Dmean和Dmax升高约8.8%、8.9%、8.1%和4.0%。Taoran 等[14]研究表明TTF 电极阵列会使患者的皮肤剂量增大130%~260%,即增加30%~160%。TTF电极阵列对于深度组织的剂量衰减、点剂量及二维面剂量表明衰减值为3.5%~4.0%,在CT2重新计算的VMAT 计划表明,靶区的平均剂量下降在1%以内,约0.55%,靶区的Vref下降约2.3%。同样,对比有无TTF 电极阵列计划的危及器官剂量,整体差异不大,说明TTF 电极阵列对于深度组织和靶区剂量影响不大。
接受TTF 治疗的患者,每3 d 需要更换一次电极,更换后的电极位置不可能完全一致,研究中通过CT2、CT3 的计划对比,表明TTF 电极片位置的不同,对于靶区和危及器官的剂量影响不大,靶区的剂量学参数差异都在1%以内,危及器官中头皮的D20cc、D30cc差异略超过1%,其余差异都在1%之内,与Straube 等[19]研究结果一致。CT3 中头皮剂量相对于CT2的整体降低,推测是因为本试验中是将TTF电极勾画出,CT3 中TTF 结构的体积略小于CT2,整体建成效应也略微减小,导致CT3 中头皮的剂量参数略低于CT2。
由于TTF 治疗中最常见的不良反应是皮肤反应,而TTF 电极阵列会使覆盖下的皮肤剂量升高,在计划设计时应重点考虑头皮组织,设计头皮保护计划,本次试验的头皮保护剂量主要限制头皮的高量区域,即1 500、2 000 cGy 以上的体积及头皮最大剂量。结果相比于常规计划,使D20cc、D30cc、Dmean、Dmax下降8.4%、7.0%、4.2%、19.7%。带有TTF 电极阵列的CT2 上头皮剂量的变化为D20cc、D30cc、Dmean、Dmax升高约8.8%、8.9%、8.1%、4.0%。头皮保护计划相比常规计划可以在一定程度上抵消因TTF 电极带来的头皮剂量升高,减少头皮不良反应发生的概率。
本研究也有诸多不足:TTF 电极阵列在CT 上产生的伪影,无法通过去金属伪影算法消除[20],只能通过勾画TTF 结构的方法进行剂量对比,与实际的情况会有细微的不同,比如连接各电极的结构无法在CT 上表示;实际测量的样本量少;对于头皮保护计划,还需结合临床实际情况作进一步的研究,以避免因放疗时同期使用TTF 电极贴片造成的头皮剂量过高。
4 结论
本次研究中,利用物理测量和TPS 计划两种方法,测量放疗中TTF电极阵列对剂量的影响。TTF电极阵列对射线有明显的建成效应和衰减,3 mm 深度剂量增大约10%,建成区之后有3.5%~4.0%的剂量衰减。对于VMAT计划,TTF电极阵列对靶区的平均剂量影响约为0.55%,表明TTF 电极阵列对于放疗靶区的影响是可接受的。TTF 电极阵列会导致头皮剂量明显增高,平均剂量升高约8.1%,对其余深部的危及器官的剂量影响不大。TTF 电极阵列位置的不同对靶区剂量及危及器官剂量影响不大。对于TTF 同步放疗的患者,建议设计头皮保护计划,相比于常规计划可明显降低头皮的高量区域,减少因头皮剂量过高而引起的皮肤不良反应的概率。