基于深度学习方法的食管癌术后调强放疗三维剂量分布预测
2022-03-14王文成周解平张朋吴爱林吴爱东
王文成,周解平,张朋,吴爱林,吴爱东,
1.安徽医科大学生物医学工程学院,安徽合肥 230032;2.中国科学技术大学附属第一医院放疗科,安徽合肥 230001
前言
调强适形放射治疗(IMRT)在降低肿瘤周围正常组织受射剂量的同时也为靶区提供高度适形的剂量分布。而调强放疗计划设计过程中,物理师根据医生的处方剂量要求,凭借个人计划设计经验花费大量时间不断尝试和修改优化函数以期获得最优放疗计划。研究表明,不同医疗机构以及不同物理师之间由于经验、水平、技巧运用和熟练程度的差异,设计出的IMRT 计划质量参差不齐,严重影响患者治疗疗效[1-4]。近年来,随着深度学习技术在图像处理、人脸识别等领域取得不断的发展,深度神经网络已经应用于对直肠癌、前列腺癌和头颈癌等肿瘤的剂量分布预测研究中,并取得一定的成果[5-9]。本文采用基于3D U-Net 以及Residual-Net 残差网络构建的3D U-Res-Net 混合神经网络为训练模型,研究将该混合神经网络技术应用到食管癌的三维剂量分布预测中,通过建立计算机断层扫描(CT)解剖结构图像和剂量图像之间的关系,实现对中上段食管癌术后调强放疗计划三维剂量分布的精准预测。
1 资料与方法
1.1 食管癌患者IMRT计划及数据处理
1.1.1 患者及计划数据收集2016年2月~2020年10月在中国科技大学附属第一医院的中上段食管癌术后IMRT患者计划共100例,胸部CT增强等影像资料提示无阳性淋巴结转移,年龄42~82 岁,中位年龄65岁。随机选取其中10 例计划作为测试集,其余90 例计划为训练集数据进行预测模型训练,为解决训练数据较少可能会导致预测模型精确度不高的问题,研究中使用基于Python的自编程序将训练集数据按照8:1比例分为训练组和验证组进行九折交叉验证并分别进行训练,得到9个预测模型,选取一个最优模型对测试集病例进行三维剂量预测。所用患者靶区处方剂量均为95%计划靶区体积(PTV)50 Gy/25次,危及器官剂量限量取:心脏V30<40%、V40<30%;全肺V20<25%、V30<20%、V5<55%、Dmean<13 Gy;脊 髓Dmax<45 Gy。采用飞利浦Pinnacle 9.10 计划系统,6 MV X 射线共面5 野设计IMRT 计划,该组所有计划剂量常数参数均满足上述处方剂量要求,并均经过主任物理师审核确认。
1.1.2 计划数据的处理利用Python自编的程序提取IMRT 计划的CT 影像信息、结构组信息、三维剂量分布信息和适形射束信息,并将这些信息均裁剪成大小为128×128×128、分辨率为2.5 mm×2.5 mm×2.5 mm格式且组成各自的三维矩阵保存作为输出参数。具体操作为:(1)CT影像的三维矩阵:将已经获取的CT影像CT值截取至-200~300 HU,并归一化至-1~1;(2)结构组的三维矩阵:首先找出各结构所对应的CT 层面,分别用二进制标记靶区PTV 和各危及器官的结构位置,即若对应体素存在于某结构中标记为1,否则为0;(3)IMRT剂量三维矩阵:将IMRT计划三维剂量的坐标系调整至CT影像的坐标系,剂量归一至0~1;(4)射束的三维矩阵:采用三维适形放射治疗的剂量方法进行设定,其中每个IMRT 计划的5 个射束各自权重比例均为20%,其方向、数量与对应IMRT 计划相同,适形射野尺寸由PTV 射野方向观投影大小并均匀外放5 mm 形成,在Pinnacle 计划系统中运用卷积叠加算法计算得到最终的三维全空间剂量分布。
1.2 神经网络模型构建与训练
本研究采用以TensorFlow 为后端的Python 深度学习库Keras 构建一个基于3D U-Net 和残差网络(Residual-Net)[10]的三维深度神经网络学习模型(3D U-Res-Net)[11]。3D U-Net 网络旨在解决因卷积神经网络池化操作而导致的分辨率降低问题,Residual-Net 网络为了解决因深度学习层数过深而导致的训练误差上升的问题,构建的混合神经网络分为编码区和解码区,编码区负责提取CT 影像、靶区、危及器官结构和射束信息的三维特征,解码区负责实现三维特征到剂量分布的回归拟合。编码区由5 个编码模块组成,每个编码模块还含有不同数量的残差块Res_block。残差块采用残差网络结构,包含4个卷积层,卷积核大小分别为1×1×1、3×3×3、1×1×1和3×3×3,前4个编码模块末端采用大小为3×3×3,步长为2×2×2的卷积操作进行下采样操作;所有卷积层后均采用归一化和线性修正单元(ReLU)处理,以加快神经网络的收敛速度。解码区包含5个解码模块,其中第一个模块仅包含一个3×3×3 的卷积层,其余4 个模块均包含一个卷积块Conv_block,Conv_block 包含3 个卷积层,卷积核大小分别为1×1×1、3×3×3 和3×3×3。前4 个模块末端还采用大小为3×3×3,步长为2×2×2 的反卷积进行上采样操作;所有(反)卷积层后均执行ReLU 操作,基本结构如图1所示。最终,以3×3×3 卷积层和ReLU操作预测得到最终剂量[12-13]。在食管癌IMRT剂量预测的模型训练过程中,CT影像、靶区、危及器官结构和射束信息的7 类三维矩阵以128×128×128×7 的形式作为输入,IMRT 剂量的三维矩阵以128×128×128×1的形式输出,预测剂量和原临床剂量的均方差作为损失函数,采用Adam 优化算法训练3D U-Res-Net模型,选取一个最优模型对测试集进行三维剂量分布预测。
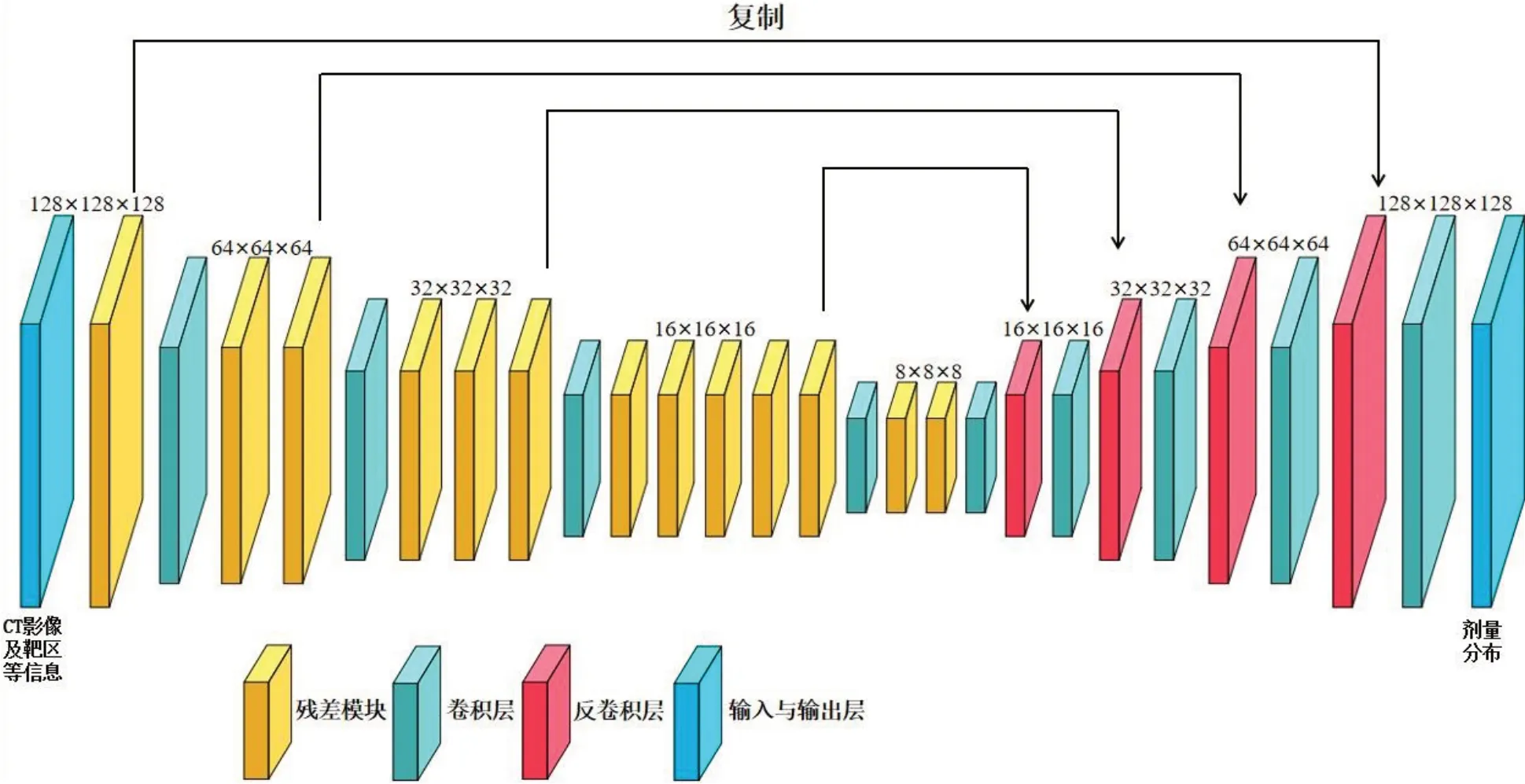
图1 本研究使用的深度神经网络框架Figure 1 Deep neural network framework used in the study
1.3 三维剂量分布评估
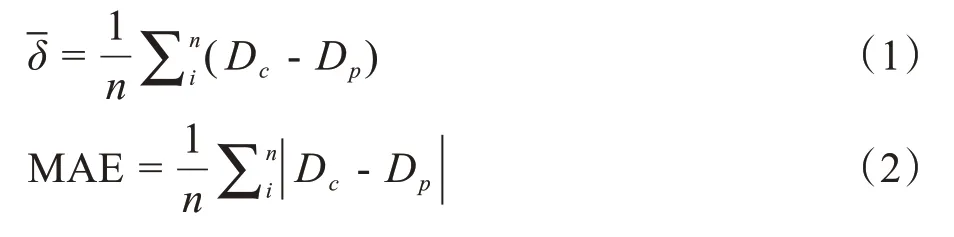
式中,Dc和Dp分别为体素剂量的临床值和预测值,i代表某一体素,n代表所有体素。
采用戴斯相似性系数(Dice Similarity Coefficient, DSC)及豪斯多夫距离(Hausdorff Distance,HD95)评估预测和原临床等三维剂量面的相似程度。DSC计算预测与临床剂量面的符合程度:
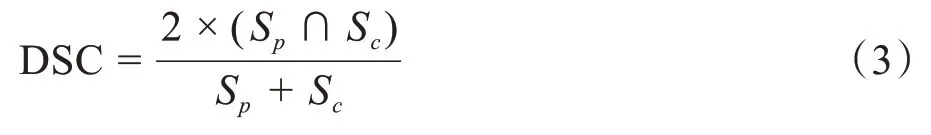
其中,Sp和Sc分别为预测和原临床的三维等剂量面,Sp∩Sc表示两种计划95%等剂量面交叠部分体素个数,Sp+Sc表示总体素个数。本研究DSC 值介于0~1间,计算的剂量范围为1~50 Gy,间隔为1 Gy,且DSC值越大,表明两个样本的重合度越高。
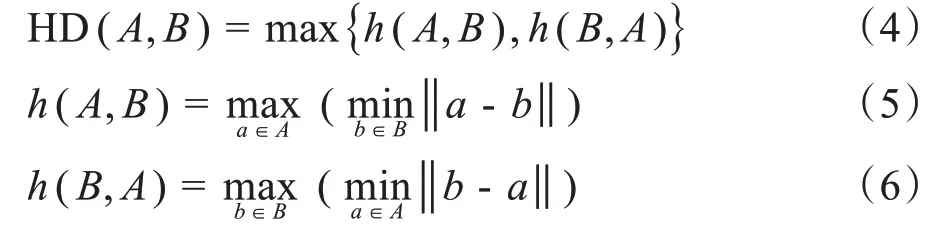
其中,HD(A,B)是单向距离h(A,B)和h(B,A)中较大的一个,它表征两个点集之间的最大失配距离,h(A,B)表示A集合的任一点到B集合任意点最小距离集中的最大值,HD 越小,表示A与B重合度越高,即三维等剂量面符合度越好。本研究取HD 最大值的第95百分位数,即HD95,剂量计算范围为20~50 Gy,每隔5 Gy取一等剂量面计算相应的HD95。
剂量学参数评估:确保95% PTV 满足处方剂量的前提下,分别评估原临床计划和预测计划中PTV剂量学参数D98、D50、D2和Dmean;危及器官剂量学参数:心脏V30和V40,脊髓Dmax,全肺V30、V20和V5的值。
1.4 统计学方法
采用SPSS23.0 软件对数据进行统计学处理,计量资料用均数±标准差表示,采用配对t检验方法;不符合正态分布的计量资料用M(Q1,Q3)表示,用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 三维剂量分布和DVH预测结果比较
从训练生成的9 个预测模型中选取一个最优模型对10 例IMRT 病例进行预测并得到相应的剂量分布和DVH 曲线,然后与临床治疗计划进行比较。随机选取1 例测试集病例的剂量分布及其DVH 曲线分别如图2和图3所示,由图可知,原临床与预测的食管癌计划三维剂量分布差异较小,两组计划PTV 和危及器官的DVH 曲线很大程度上一致且吻合度高,预测效果良好。经数据相似性评估分析可知,测试集病例的三维剂量平均预测偏差-δ为-0.23%~0.78%,MAE 为1.67%~3.07%,两组计划等剂量面DSC 除个别病例在50 Gy 附近略有降低外,其余均在0.90 以上,且平均DSC 系数大于0.91,30 Gy 以下的DSC 达到0.95 以上(图4)。平均HD95为0.51~0.73 cm,表明临床和预测之间误差保持在较小范围内,相似度较高。
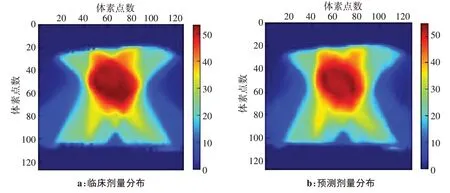
图2 临床与预测三维剂量分布比较Figure 2 Comparison between clinical and predicted three-dimensional dose distributions
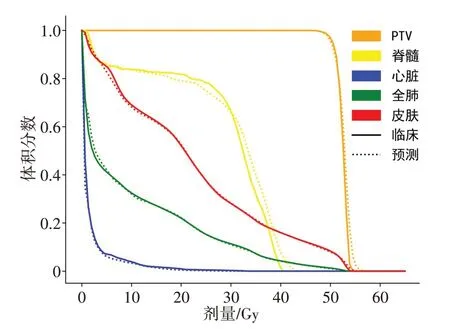
图3 总DVH曲线图Figure 3 Overall DVH curve
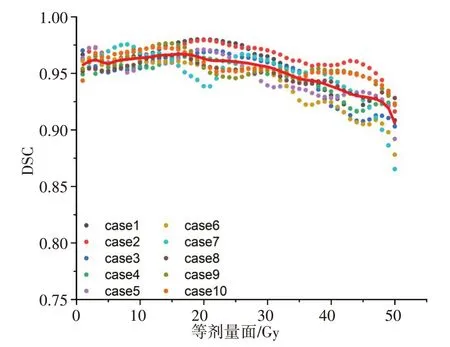
图4 10例测试集病例等剂量面DSC(红实线表示平均值)Figure 4 Dice similarity coefficients of isodose surfaces in 10 cases from test set(The solid red line indicates the average value)
2.2 剂量学参数比较
两组计划肿瘤PTV 和危及器官的剂量学参数详见表1。所有剂量学参数均在临床允许的范围之内且相对剂量偏差小于2%,除靶区D2、脊髓Dmax、全肺V30差异有统计意义外(P<0.05),其余剂量学参数差别不大,与临床计划相比,预测计划全肺V30值更低,有利于保护肺组织,靶区D2、脊髓Dmax值虽然稍高,但仍在临床可接受剂量范围内。
表1 10例测试集病例DVH剂量学参数临床值和预测值比较结果表(± s)Table 1 Dosimetric comparison between predicted value and clinical truth for 10 cases from test set(Mean±SD)
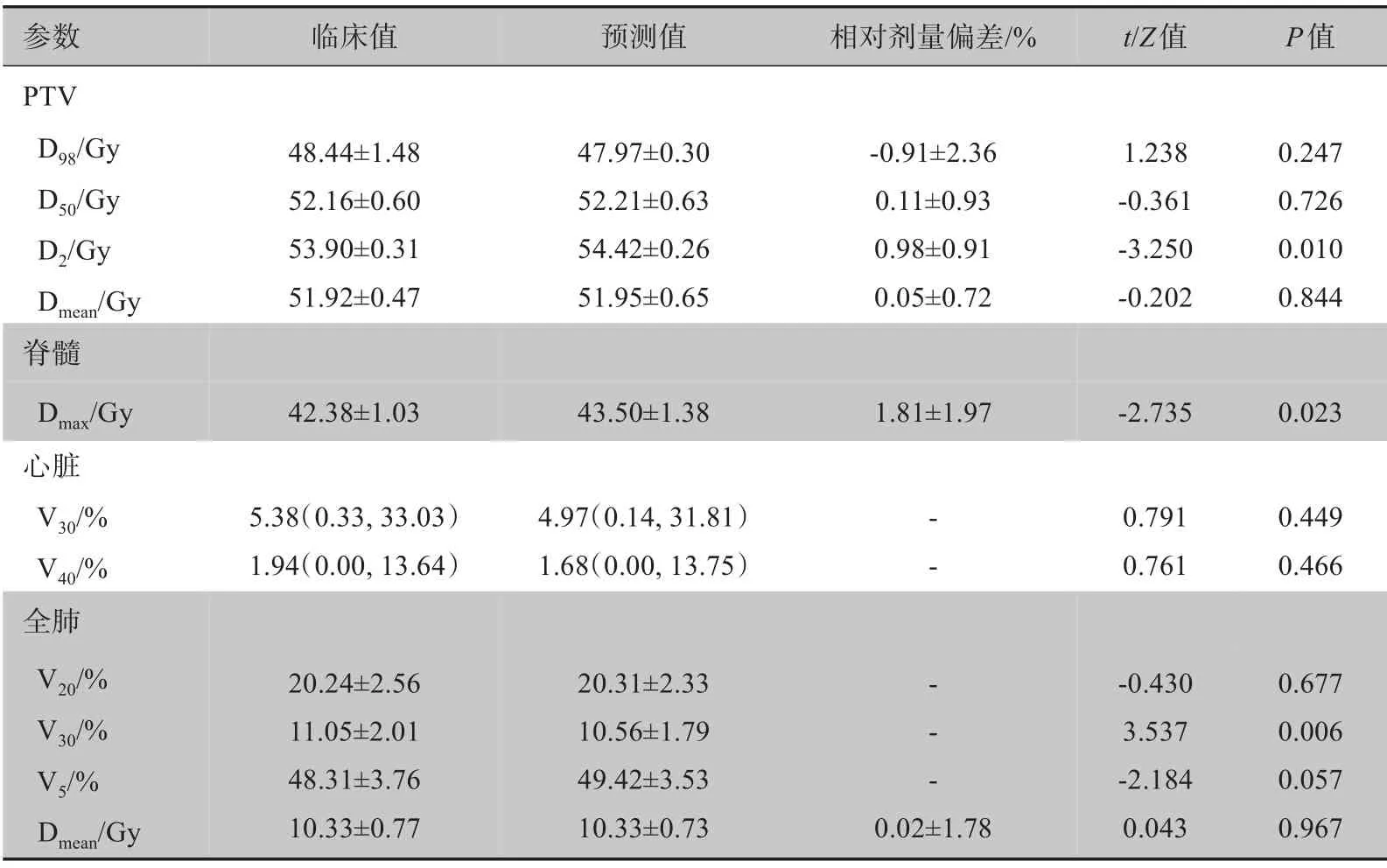
表1 10例测试集病例DVH剂量学参数临床值和预测值比较结果表(± s)Table 1 Dosimetric comparison between predicted value and clinical truth for 10 cases from test set(Mean±SD)
参数PTV D98/Gy D50/Gy D2/Gy Dmean/Gy脊髓Dmax/Gy心脏V30/%V40/%全肺V20/%V30/%V5/%Dmean/Gy临床值预测值相对剂量偏差/%t/Z值P值48.44±1.48 52.16±0.60 53.90±0.31 51.92±0.47 47.97±0.30 52.21±0.63 54.42±0.26 51.95±0.65-0.91±2.36 0.11±0.93 0.98±0.91 0.05±0.72 1.238-0.361-3.250-0.202 0.247 0.726 0.010 0.844 42.38±1.03 43.50±1.38 1.81±1.97-2.735 0.023 5.38(0.33,33.03)1.94(0.00,13.64)4.97(0.14,31.81)1.68(0.00,13.75)0.791 0.761 0.449 0.466 20.24±2.56 11.05±2.01 48.31±3.76 10.33±0.77 20.31±2.33 10.56±1.79 49.42±3.53 10.33±0.73-- - - -0.02±1.78-0.430 3.537-2.184 0.043 0.677 0.006 0.057 0.967
3 讨论
本研究基于食管癌患者CT 影像、靶区及危及器官结构组、适形射野信息和构建的3D U-Res-Net 深度学习训练模型实现了对食管癌IMRT 三维剂量分布剂量精准预测。从预测结果可知,原临床计划与预测计划的剂量分布相似度较好,一些临床关键剂量参数差异较小且在临床可接受的范围之内。10 例IMRT 测试集病例平均预测偏差-δ为-0.23%~0.78%,MAE是1.67%~3.07%,平均HD95为0.51~0.73 cm。两组计划PTV 和危及器官的DVH 曲线很大程度上一致且吻合度高,预测效果良好,两组计划等剂量面平均DSC系数大于0.91,30 Gy以下的DSC达到0.95以上,50 Gy附近存在个别点低于0.90,这可能是训练数据数量较少或对患者图像高剂量区域提取信息不完善所致。除靶区D2、脊髓Dmax、全肺V30外,其余结构组剂量学参数差异均无明显差异,两组计划的肿瘤PTV和危及器官的相对剂量偏差小于2%。综合以上结果表明,本研究构建的3D U-Res-Net 深度神经网络训练模型对中上段食管癌术后调强放疗计划预测具有较高的精确度且满足临床需求。但由于肿瘤靶区、危及器官勾画以及计划处方剂量的差异,该研究结果仅适用于本单位放疗中心,其它放疗单位应充分利用自己优质的放疗病例数据库,建立自己的三维剂量分布预测模型得到满意的预测结果[14]。
深度学习方法依靠大量病例数据及训练模型实现对患者个性化的三维剂量预测,进而实现自动计划的设计,不仅能够减轻物理师工作负担,而且可有望克服不同放疗中心计划设计水平差异的问题[15]。近年来,基于深度学习的三维剂量分布预测研究取得不断的进展[16-19]。Nguyen 等[20]针对头颈癌的治疗计划提出基于层次密集型连接U-Net网络(HD U-Net)的深度学习模型预测三维剂量分布,这种网络比标准U-Net 和密集型网络(Densely Net)有更好的训练效果,预测误差也更低,预测速度是密集型网络的4倍,训练参数却比标准U-Net 少12 倍。Chen 等[14]利用卷积神经网络模型自动优化策略对140 例宫颈癌患者进行自动IMRT 计划设计,与人工手动计划相比,深度卷积神经网络模型自动IMRT 计划设计的时间大大缩短,而靶区适形度和剂量均匀性无显著差异,自动计划的绝大多数危及器官的受照射剂量有所减少,自动计划明显优于人工计划。本次研究采用自编的Python 程序直接读取食管癌患者计划CT影像、靶区及危及器官结构组、三维剂量分布信息以及射束信息,避免了人为复杂耗时的手动提取;另外为减少射野差异导致射束不确定性的影响,研究所选取的食管癌病例均采用五野共面布野,且各射束权重相同,但在临床实践中物理师常常凭借自身经验,根据患者靶区形状和位置的不同,采用不同的射野数量和布野方案,若将来能够采用某种策略根据靶区形状和位置自动生成个性化布野,更将会极大地提高放疗计划设计效率。此外,由于本次研究所得预测结果是根据选取的90 例病例数据训练所得,其剂量分布预测水平只能反映以往放疗计划平均水平,如若想得到更好的结果,可能需要引入新的优化目标函数;对于不同的处方剂量和体积能否达到相同预测效果也还需要进一步的探索研究,这些也是自动计划功能实现所需要考虑的问题。
综上所述,本研究构建的3D U-Res-Net 深度学习模型实现对食管癌三维剂量分布的精准预测,若该预测模型以模块的形式嵌入放疗计划系统,物理师可在设计放疗计划前,通过系统自动生成的患者个性化三维剂量分布提前了解目标计划权重参数偏向,进而有意识地进行相应权重赋值,这将会有效减少物理师所需要花费的时间,提高计划设计质量和效率,也可克服不同放疗单位计划设计的差异,间接提升放疗计划总体设计水平。