纳米制剂在糖尿病创面愈合中的应用研究
2022-03-13梅银柳
梅银柳,吴 洁
(中国药科大学生命科学与技术学院,南京 211198)
糖尿病是一种慢性非传染性疾病,目前已成为日益严峻的全球性公共卫生问题。截至2019年,4. 63亿成年人患有糖尿病,预计到2030年这一数字将增加到5. 78 亿[1]。糖尿病的特征是高血糖、胰岛素分泌不足或活性不足。高血糖会导致某些代谢途径的激活,这些代谢途径在异常状态下会导致血管功能不足、神经损害,进而影响伤口愈合,如糖尿病足溃疡(diabetic foot ulcers,DFUs)糖尿病患者一生中有15% ~ 25% 的概率发展为DFUs,愈合后5 年内复发率为50% ~ 70%[2-3],严重者最终会导致部分肢体或整个下肢截肢。
目前糖尿病患者伤口的基础治疗包括清创和清除感染;同时有湿性敷料、高压氧治疗、负压伤口治疗、皮肤移植、干细胞移植、人类生长因子和组织工程等新型生物治疗策略[4]。但是上述部分方法在临床应用中存在缺陷[5]。例如,合成人造敷料无法有效释放生物活性成分,天然敷料可能引起过敏反应,组织工程类似物面临血管生成减少和生理排斥的问题,慢性伤口中产生的内源性酶会降解生长因子,而全身干细胞疗法归巢于靶组织的活细胞数量少[6]。纳米颗粒作为一种新的局部药物递送系统有诸多优点,可保护和负载药物到特定靶点,缓控释放药物,减缓药物降解,增强药物在应用区域渗透性,并能提高治疗效果及减少不良反应,展示出良好的应用前景[6-7]。本文介绍了糖尿病伤口难愈的病理生理学,并对各种类型纳米颗粒在动物模型和临床糖尿病患者伤口愈合研究中的应用及作用机制进行综述。
1 糖尿病伤口愈合过程和病理生理学
正常伤口愈合过程包括4个相互关联、相互重叠的阶段:止血、炎症、增生和组织重塑[8]。止血期包括局部血管收缩、血小板血栓和纤维蛋白激活形成凝块限制出血,同时为新迁移的细胞提供一个支撑平台[9]。止血期释放的趋化因子吸引炎症细胞,刺激驻地免疫细胞,两者一起启动伤口愈合的炎症期,此阶段主要依赖于中性粒细胞与巨噬细胞对入侵微生物、坏死组织和凋亡细胞进行清除。糖尿病伤口处炎症细胞功能受损,凋亡异常,极易引发感染。炎症信号传导异常,炎症介质增加,使伤口处于慢性炎症状态难以进入下一阶段[10]。在增生期,角质细胞、成纤维细胞和内皮细胞在血小板和巨噬细胞分泌的细胞因子的作用下,支持损伤部位再上皮化、血管再生、胶原沉积和肉芽组织形成[11-13]。糖尿病状态下高血糖、胰岛素抵抗、氧化应激水平高引起伤口血管新生和细胞增生减少,多种细胞因子及生长因子表达降低,导致伤口难以愈合。重塑期的主要特征是胶原蛋白沉积在有组织有秩序的网络中,III型胶原被I型胶原替代[14]。许多新生成的毛细血管发生消退,使创面血管密度恢复正常[15]。伤口边缘的肌成纤维细胞收缩伤口[16]。而对于糖尿病伤口而言,细胞凋亡异常和胶原转化减少使得这一过程难以正常进行。
神经病变(神经损伤)、感染和血管病变(血流量不足)是糖尿病伤口难愈的病理生理学原因。糖尿病周围神经病变(diabetic peripheral neuropa⁃thy,DPN)主要由于高血糖引起的微血管病变、代谢障碍、氧化应激等所致。微血管病变使得血管扩张减少和血管收缩增强,这种神经内膜微血管的功能变化加剧了神经内膜的缺氧,进而导致DPN。长期高血糖状态刺激醛糖还原酶和山梨醇脱氢酶生成增加,导致细胞内积累大量的山梨醇和果糖,使细胞内渗透压升高,神经施万细胞和毛细血管细胞水肿、变性、坏死[17-18];另外,葡萄糖和山梨醇的结构类似于肌醇,竞争抑制神经细胞肌醇的合成,中断正常的神经元传导[19]。糖尿病中的糖代谢受损是导致氧化应激的一个关键机制:过量的葡萄糖分流到如多元醇和己糖胺等其他代谢或非代谢途径[20],导致有毒代谢物的积累和烟酸腺嘌呤二核苷酸磷酸的过度消耗,从而增加细胞内氧化应激和对蛋白质[21]、脂质和DNA 的异常修饰,从而增加线粒体损伤和ROS 的过量产生,造成施万细胞(Sehwann cells)丢失[22]。
糖尿病患者存在一定的血管病变,血管生成因子(如TGF-β、FGF2、VEGF)和血管抑制因子(如血小板反应素、内皮抑制素)之间处于不平衡状态,新生血管的异常凋亡以及高血糖和慢性炎症造成内皮祖细胞归巢功能受损,最终导致血管损伤,再生能力不足,造成伤口愈合损伤。
高血糖是细菌生长的良好培养基,主要是需氧革兰氏阳性球菌,如金黄色葡萄球菌和β-溶血性链球菌。同时,糖尿病患者免疫系统受损,主要表现为白细胞功能缺陷和形态改变,这些加重了糖尿病患者感染风险[23]。
2 用于糖尿病创面愈合的纳米颗粒类型
纳米颗粒直径在1 ~ 100 nm 不等,如今被广泛应用于生物医学、药物递送、材料科学、环境治理和再生能源等领域。在伤口愈合领域,基于纳米颗粒的伤口愈合疗法也表现出新的前景和效益。由于纳米材料的特性,纳米颗粒有利于伤口愈合或者可作为无机骨架包封运载药物[24]。负载的药物有活性分子(生长因子、多酚类化合物、基因、干细胞和药物等)和非活性元素(金属离子、一氧化氮、氧气等)。
2. 1 碳基纳米材料
碳基纳米材料包括富勒烯、碳纳米角、碳纳米管和石墨烯。在伤口愈合领域,富勒烯和石墨烯通过改善伤口愈合的炎症期与增生期可达到治疗效果。富勒烯有强大的抗菌和抗炎作用,可以中和活性氧与活性氮[25],对高血糖引起氧化应激导致的组织损伤有缓解作用[26]。但是富勒烯之间有强烈的范德华力,导致溶解度下降,出现团聚现象,具有毒性,影响人角质细胞增殖。为改变这一现象,常使用己二羧基、三羧基和γ-环糊精对其功能化修饰[27]。Zhou等[28]设计合成了一系列抗氧化和对人角质细胞活力无影响的富勒烯衍生物,利用改良的划痕实验和体外人皮肤模型研究它们加速伤口愈合的能力。石墨烯为二维蜂窝晶格结构,具有特殊的导电性、稳定性、生物力学和生物相容性。还原的氧化石墨烯相对于石墨烯与氧化石墨烯毒性降低,一定浓度下可以诱导血管新生[29]。最近,研究者构建了一种复合生物支架:间充质干细胞嵌合氧化石墨烯,不仅改善了天然支架材料的理化特性,而且还构建了用于糖尿病创面愈合的干细胞局部移植系统。复合生物支架在体外为干细胞和增殖提供良好环境,在糖尿病小鼠创面愈合期间,递送间充质干细胞支持血管新生和胶原沉淀,再上皮化[30]。负载抗氧化剂N-乙酰半胱氨酸的氧化石墨烯和胶原蛋白杂化膜在大鼠伤口模型上施用14 d 后,愈合程度上比对照组快22%,有望成为用于糖尿病创面愈合的新型敷料[31]。
2. 2 陶瓷纳米颗粒
使用陶瓷纳米颗粒中含有的二氧化硅及其衍生物,钙盐和羟磷灰石可运用于伤口愈合[32]。钙流入细胞可调节炎症细胞浸润、成纤维细胞增殖和角质形成细胞迁移[33]。Kawai 等[34]设计胶原蛋白涂抹的钙基纳米颗粒,当暴露在酸性条件下时,它很容易分解。通过改变CaCl2和甘油磷酸的浓度可修饰涂层溶液的离子组成。实验表明,钙基纳米颗粒通过增加体外成纤维细胞的钙摄取,加速伤口收缩进而促进伤口愈合。
Gan 等[35]设计葡甘露聚糖修饰的二氧化硅纳米颗粒通过诱导甘露糖受体在巨噬细胞表面聚集,有效激活巨噬细胞分化为M2 型表型。这种方式不同于递送关键因子、巨噬细胞原位激活或加入外源性巨噬细胞,而是促进巨噬细胞表型转变以促进伤口修复[36-38]。同时此颗粒自身有潜力通过刺激成纤维细胞的增殖和活化,促进糖尿病创面的愈合能力[38-39]。
生物活性玻璃由SiO2、Na2O、CaO 和P2O5等组成,研究发现,其离子产物通过促进巨噬细胞表达M2 表型,并刺激巨噬细胞表达更多的抗炎和血管生成生长因子,促进成纤维细胞增殖和肉芽组织生长,进而促进糖尿病创面愈合[40]。
2. 3 金属及金属氧化物纳米颗粒
银纳米颗粒(silver nanoparticles,AgNPs)具有广谱抗菌活性,对真菌、细菌、酵母甚至病毒都有抗菌活性,可用于预防糖尿病伤口感染。猪接触性皮炎模型揭示,AgNPs可显著增加炎症细胞的凋亡和降低促炎因子水平[41]。AgNPs通过抗菌特性,减少伤口炎症,刺激角质形成细胞的增殖和迁移来加速伤口愈合[42-43]。这可以改善DFUs中角质形成细胞的过度增殖、不能完全分化和无迁移能力的缺陷[44]。但是,AgNPs会因许多因素(例如大小,固有特性和表面化学性质)导致纳米颗粒对细胞具有毒性。在医学设计中,常用生物相容性的涂层材料或生物可降解或生物相容的纳米颗粒改善其性能和降低其毒性[45]。Orlowski等[46]设计多酚修饰的金银双金属纳米颗粒,小鼠局部淋巴结实验表明其不会引起皮肤毒性反应,对伤口愈合也有促进作用。Acticoat®和SilvaSorb®是含AgNPs 的商业敷料[47],通过提供持续性释放Ag+,克服伤口液因形成阴离子和蛋白质复合物而导致银颗粒失活的缺点。
金纳米颗粒(gold nanoparticles,Au NPs)具有抗氧化性,可以抑制脂质过氧化,防止形成活性氧,对DFUs 的治疗非常有效[48]。有研究者设计角质细胞生长因子(keratinocyte growth factor,KGF)与AuNPs 结合形成纳米复合材料,体内实验表明其通过促进上皮化和收缩伤口加速了糖尿病大鼠创面的愈合[49]。神经节苷脂-单唾液酸3 合成酶(GM3S)是糖尿病小鼠过表达的已知靶点,可引起胰岛素抵抗和阻碍伤口愈合。Randeria 等[50]研究表明,通过靶向GM3S siRNA 的球形核酸共轭AuNPs 在糖尿病小鼠中敲除GM3S,可逆转其伤口愈合受损且无细胞毒性。
白蛋白修饰的硫化铜纳米颗粒具有制备简单、成本低、毒性小、生物相容性好等优点。将此纳米颗粒作为光热治疗试剂,不仅发挥硫化铜纳米颗粒优越的抗菌活性,而且具备良好光热性能,已成功用于治疗糖尿病伤口感染[51]。
另外氧化铈纳米颗粒(CeO2NPs)和氧化锌纳米颗粒(ZnONPs)也可运用于伤口愈合。CeO2NPs可促进细胞增殖和血管形成,在动物模型中有很好的促伤口愈合作用[52]。将阻断炎症功效的miR-146a 与CeO2NPs 结合,成功促进伤口愈合[53]。ZnONPs 具有抗菌、抑炎和防腐性能[47],其中锌离子可通过增加血小板聚集、角质形成细胞迁移、上调VEGF和FGF等关键血管生长因子,并调节单核细胞分化为巨噬细胞来促进伤口愈合过程[54]。
2. 4 聚合物纳米颗粒
聚合物分为天然聚合物,包括蛋白质(胶原蛋白、明胶、蚕丝、角蛋白和天然橡胶蛋白等)及多糖(甲壳素、壳聚糖、淀粉、海藻酸盐、纤维素和透明质酸等),和合成聚合物[聚乳酸- 羟基乙酸(PLGA)、聚己内酯和聚乙二醇等]。他们由于其优良的力学性能、生物相容性、生物降解性和非免疫原性[55]等多方面的特性,近年来在临床和生物医学领域的应用显著增加。
PLGA 水解的代谢单体乳酸和乙醇酸容易通过柠檬酸循环被人体代谢掉,以及乳酸可促进血管新生[56],故被FDA 批准作为药物递送载体运用于人体临床试验[57]。包裹姜黄素的PLGA 纳米颗粒能淬灭活性氧,抑制髓过氧化物酶,下调谷胱甘肽过氧化物和NF-kB的mRNA表达水平,进而降低炎症反应,加速上皮再生,促进肉芽组织形成[58]。Hasan 等[59]发明一种负载聚乙烯亚胺/二氮杂二酸的PLGA纳米颗粒(PLGA-PEI/NO NPs),可作为NO供体,与耐甲氧西林金黄色葡萄球菌(MRSA)生物膜基质结合并发挥抗菌作用,促进伤口愈合能力。另有研究者制备了芝麻酚-PLGA纳米混悬液,可通过增加再上皮化,胶原蛋白沉积,成纤维细胞迁移,炎症细胞浸润减少和血管再生促进糖尿病大鼠伤口愈合[60]。
壳聚糖是氨基葡萄糖和N-乙酰氨基葡萄糖通过β-1,4-糖苷键连接形成,是几丁质一种活性去乙酰化形式,因具有良好的生物相容性和生物可降解性,并且具有止血、组织再生、无毒、无免疫原性、刺激成纤维细胞增殖和抗菌活性,在伤口愈合中有广泛的应用。Sun 等[61]使用离子交联法合成了含儿茶素、抗坏血酸、明胶和壳聚糖组合的纳米颗粒,可通过增加糖尿病小鼠创面胶原的积累、促进血管生成、减少炎症细胞的浸润最终促进创面愈合。Riberiro 等[62]制备包含胰岛素的壳聚糖纳米颗粒,可促进糖尿病大鼠伤口愈合。
2. 5 脂质纳米颗粒
传统的脂质体是脂质双分子层围绕一个亲水内核。而脂质纳米颗粒则不同,它拥有致密电子的内核,内核中阳离子/可电离的脂质与多阴离子的RNA 通过静电吸附作用自组装呈倒置胶束[63-64]。正是这种结构使脂质纳米颗粒拥有优越的稳定性和结构的可塑性,可以负载RNA 在肿瘤免疫治疗中发挥作用[65]。最近有研究者针对TNFα,设计了一种负载siRNA 的脂质纳米颗粒,局部使用可使糖尿病鼠创面TNF-α 的mRNA 表达降低50% 左右[66]。脂质纳米颗粒负载具有抗菌、抗氧化和降血糖的桉树精油或迷迭香精油,同时为防止纳米颗粒聚集用卵磷脂作为表面活性剂,用于糖尿病大鼠烧伤模型,可加速组织修复能力[67]。
纳米递送载体在递送、保护和缓释药物、延长有效药物作用时间方面具有多种优势,现分类归纳见表1。
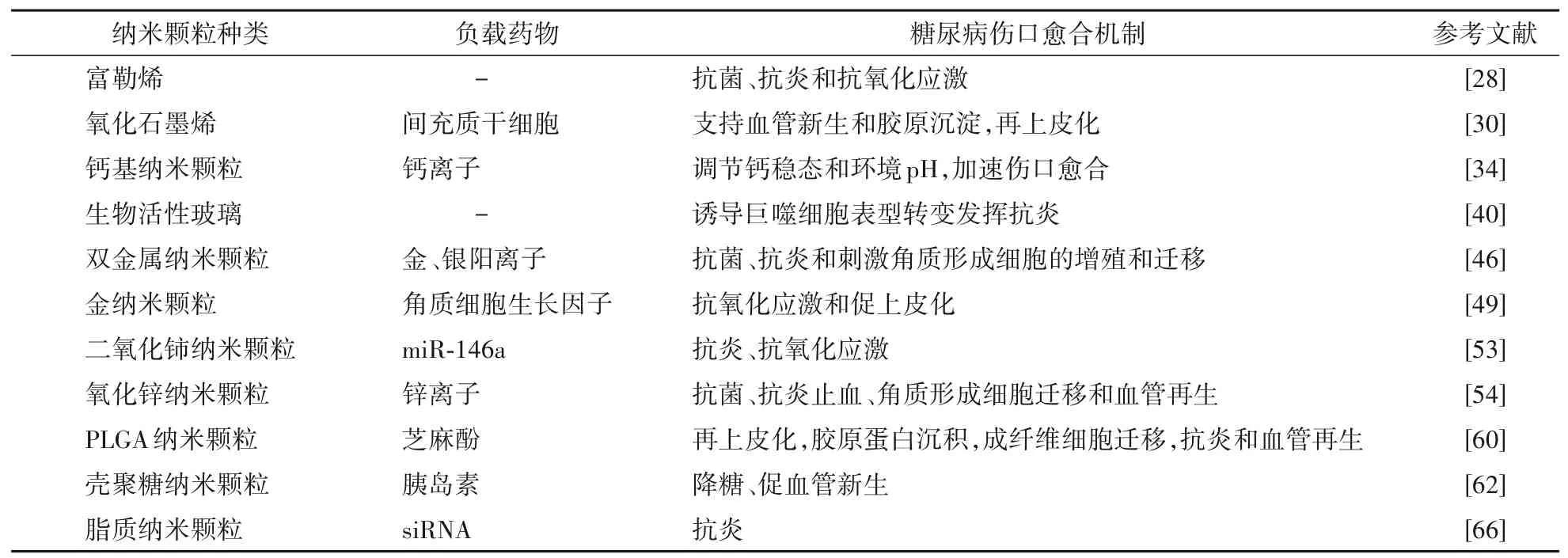
表1 纳米颗粒对糖尿病伤口愈合的作用机制
3 总结与展望
近年来,纳米颗粒作为药物递送系统的潜力已经被广泛证明。药物递送纳米颗粒的优点是用途广泛、尺寸可控、合成方法能耗和成本较低、比表面积大、靶向能力较强,能够持续稳定地缓释药物,减缓药物降解,降低全身吸收,减少不良反应,增强药物渗透,最终提高治疗效果。与传统抗生素相比,基于纳米颗粒的抗菌治疗更有可能消除细菌产生的耐药性。但是这些纳米颗粒和纳米复合材料离获得临床应用仍然存在一定距离,首先获取高纯度纳米颗粒具有一定的难度,其次,部分纳米颗粒会损伤肝、肾等器官,因而还需要进一步研究它们的毒性、安全性、药代动力学和组织生物学分布,为其临床应用提供更多的理论和实验依据。
