关于高中化学平衡常数的两点认识
2022-03-13潘红梅
潘红梅





摘 要:平衡常数是化学平衡中最重要的核心概念,用于定量表征反应进行的程度。一定温度下,反应达平衡时的状态可能不相同,但平衡常数相等。这为研究化学反应提供了定量依据,尤其是真实情境下复杂的反应体系,可运用平衡常数进行定量分析。
关键词:平衡常数;化学反应;相等;分析;定量
2017年版课程标准要求学生能够认识化学平衡常数是表征化学反应限度的物理量,知道化学平衡常数的含义。多年的教学实践发现学生对平衡常数的认识存在两个问题:“温度决定平衡常数”“平衡常数与化学反应的关联”。究其原因就是不理解平衡常数的特征、含义,不能利用平衡常数从定量的角度认识化学反应,本文就此展开论述。
1 温度决定平衡常数
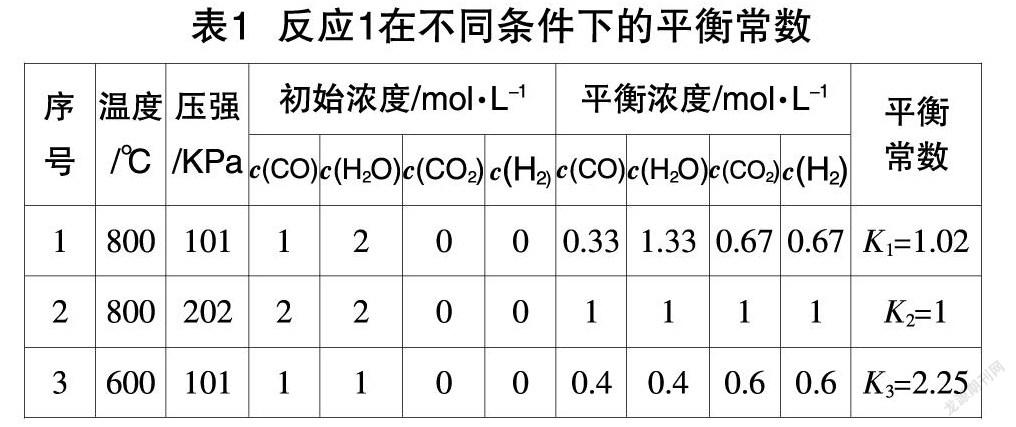
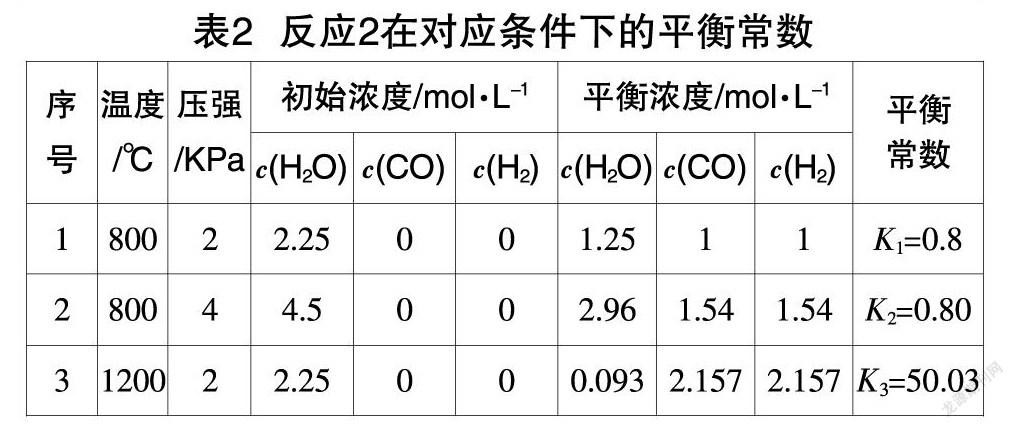
对于平衡常数特征的教学,通常采用“根据实验时测量的各组分浓度,求算平衡常数”。下面以工业制氢气的两个反应为例,其中表1提供了反应1:CO(g)+H2O(g)?葑CO2(g)+H2(g),ΔH<0,在不同的温度、压强下,各组分的初始浓度、平衡浓度;表2呈现了反应2:C(s)+H2O(g)?葑CO(g)+H2(g),ΔH>0,在不同的温度、压强下,各组分的初始濃度、平衡浓度。
根据表1、表2中平衡常数的计算结果,平衡常数与温度之间的关系落地生成:“平衡常数只与温度有关,温度相同平衡常数相等”,同时还收获了“不同的平衡状态具有相同的平衡常数”,为工业生产中化学反应的调控提供重要依据。
通过实验数据,总结了温度与平衡常数的关系,大部分学生只机械地记住这一结论,没感受科学家是如何认识温度与平衡常数的关系。事实上,荷兰化学家范特霍夫已经从热力学原理推导出标准平衡常数随温度变化的关系式:从关系式可知,升高温度,放热反应的化学平衡常数减小,吸热反应的化学平衡常数增大。利用关系式ln=(-),还可以判断变化过程中的热效应以及平衡移动方向。例如根据表3中一水合氨的电离平衡常数随温度的变化关系,推断“氨水的电离是吸热的过程,升高温度有利于一水合氨向电离方向移动”。
相比之下,较难的多相反应CaCO3(s)?葑CaO(s)+CO2(g),若保持温度不变,缩小容器体积,则c(CO2)随时间变化关系如图1所示。再次达平衡时,c(CO2)保持不变的根本原因:“温度相同平衡常数(K)相等,而K=c(CO2)”。
2 定量地认识化学反应
2.1 理解“反应”“平衡”
平衡常数的大小反映了化学反应可能进行的程度。平衡常数的数值越大,说明反应可以进行得越完全[ 1 ]。一般认为,平衡常数非常大(K>105)为完全反应,平衡常数非常小(K<10-5)基本不发生反应,10-5<K<105为可调控反应,提供了定量地认识化学反应依据。在反应体系中,学生常分不清“化学反应”“化学平衡”谁占主导,教师可引导学生用平衡常数从定量的角度理解主次关系。例如盐酸与醋酸钠溶液混合时,化学反应方程式:HCl(aq)+CH3COONa(aq)=CH3COOH(aq)+NaCl(aq),平衡常数K==5.68×104。与此同时,混合溶液中存在醋酸的电离平衡:CH3COOH ?葑CH3COO-+H+,平衡常数Ka=1.76×10-5[ 2 ]。
以平衡常数作为依据,学生很容易判断该混合体系以“化学反应”为主,从而快速解答水溶液体系中微粒关系问题,进而建立复杂反应体系的微粒分析模型。
2.2 判断反应产物
熟悉物质间的“陌生”反应同样可以用化学平衡常数来定量分析,之所以说“熟悉”“陌生”,“熟悉”是学生能对反应进行简单的类比,但往往会类推出错误的结果;“陌生”是教材中出现过但只作模糊处理,内容不明示。例如“漂白粉在使用时需要加水浸泡片刻,才能更好地发挥漂白效果,因为次氯酸盐溶于水后与空气中的二氧化碳反应生成次氯酸”[ 3 ]。那么家庭中经常使用的84消毒液(主要成分是NaClO)漂白原理如何?绝大多数同学依据漂白粉的反应原理,认为反应产物是Na2CO3和HClO,而实际上生成了NaHCO3和HClO。
(已知25℃时,K(HClO)=2.95×10-8,Ka1(H2CO3)=4.3×10-7,Ka2(HCO3-)=5.61×10-11[ 2 ])
如何用平衡常数判断该反应产物呢?设NaClO+H2O+CO2=NaHCO3+HClO平衡常数为K1:
=14.58
假设2NaClO+H2O+CO2=Na2CO3+2HClO平衡常数为K2:
=2.77×10-2
两个化学反应的平衡常数相差526倍,由此可以断定:向次氯酸盐溶液中通入CO2,无论CO2量如何,次氯酸盐溶于水后与空气中的二氧化碳反应都理应生成次氯酸和碳酸氢盐。
2.3 分析复杂反应
漂白粉漂白时为何就生成CaCO3?下面继续计算Ca(HCO3)2转化成CaCO3(Ca2++2HCO3-=CaCO3+H2O+CO2)的平衡常数K3:
从平衡常数K3=4.76×104,可以判断上述反应比较完全。实验时使用的试剂有0.0001mol·L-1CaCl2、0.0001mol·L-1NaHCO3溶液、饱和NaHCO3溶液、饱和CaCl2溶液。当饱和NaHCO3溶液与饱和CaCl2溶液混合时,先产生白色沉淀随后有气体生成;若把浓度均为0.0001mol·L-1的NaHCO3溶液和CaCl2溶液混合时无上述现象,这也刚好解释了能否用CaCl2鉴别Na2CO3、NaHCO3这一具有争议性的问题。
为什么试剂的浓度会使实验现象出现差异?从定量的角度分析如下:随着CaCl2溶液的加入,促使NaHCO3溶液中HCO3-电离程度大于其水解程度。即HCO3-?葑CO32-+H+是NaHCO3溶液中的主要平衡,此时,Ca2+与CO32-结合生成CaCO3,HCO3-结合电离出的H+形成H2CO3。在饱和溶液中,Ca2+与CO32-的浓度积(Qc)大于Ksp,产生白色沉淀;浓度均为0.0001mol·L-1的溶液中,Ca2+与CO32-的浓度积(Qc)小于或等于Ksp,宏观上无现象。
反应体系中能否产生沉淀,可用溶度积规则[ 1 ]进行定量分析。饱和CaCl2溶液通CO2气体无沉淀产生的原因:c(HCO3-)、c(H+)主要来自H2CO3的第一步电离,溶液中c(HCO3-)≈c(H+),故c(CO32-)Ka2(HCO3-)=5.61×10-11 mol·L-1,此时Qc=c(Ca2+)·c(CO32-)=3.01×10-10<Ksp。
(已知25℃时,饱和CaCl2溶液的浓度约为5.38mol·L-1,Ksp=4.96×10-9 [ 2 ])
酸和盐的反应原理,在初中和高一阶段,学生只会根据“强”酸制“弱”酸的反应规律进行定性解释,但“强制弱”的反应规律不具有普适性,最典型的化学反应“CuSO4溶液中通H2S气体时会产生黑色沉淀CuS,同时生成硫酸”,其平衡常数K===7.9×1016 [ 2 ] ?垌105,可认为完全反应。因此,选择性必修《化学反应原理》中引入了“平衡常数”,它打开了我们认识化学反应的新视角,有助于我们全面地认识化学反应。
为落实化学学科核心素养,实现新一轮教改目标,教学中要求应用已有的知识解答真实的情境问题,而真实的问题一般都是复杂的反应体系,复杂体系的反应要求能从客观的实验现象进行定量地解释、分析。因此,教师要加强对平衡常数知识的有效整合,利用平衡常数,帮助学生从定量的角度全面认识化学反应。
参考文献:
[1] 王磊,陈光巨.化学反应原理(选择性必修一)[M].济南:山东科技出版社,2019:99,54,109.
[2] 王祖浩.化学反应原理[M].南京:凤凰教育出版社,2014:99-100.
[3] 王祖浩.化学第一册(必修)[M].南京:凤凰教育出版社,2019:62.
3953500338234
