苹果砧木M9T337不同部位内生固氮菌群分析
2022-03-12张宏雁张俊忠张东华闫向楠刘丽
张宏雁,张俊忠,张东华,闫向楠,刘丽
(西南林业大学生物多样性保护学院,云南 昆明 650224)
苹果是世界四大水果之一,隶属于蔷薇科(Rosaceae)苹果亚科(Maloideae)苹果属(Malus),原产于欧洲、中亚和中国新疆西部,经数代人的栽培嫁接,相继引种,现已广泛种植。21世纪以来,中国苹果产业较快发展,苹果栽培面积、总产量、人均占有量与出口量均居世界第一,已经成为世界上最大的苹果生产国和消费国[1]。目前,矮化密植栽培是苹果生产的主流栽培模式,应用矮化砧木是实现苹果矮化栽培的主要途径之一,也是现代苹果产业发展的重要标志[2]。M9T337作为生产中重要的苹果矮化砧木,具有比其它砧木更好的苗圃性状,不仅压条易繁殖,而且苗木生长整齐,容易生长出二次枝,在果业产业发达的国家一般选择利用该砧木[3]。研究表明M9T337作为砧木可影响品种对氮元素的吸收和利用[4],还可以提高富士苹果果实中氮、磷、钾等元素的质量分数[5]。
在自然界中,植物与微生物密切相关,微生物能够帮助植物抵抗病原体和环境的胁迫[6]。植物内生固氮微生物是指能够定殖在植物体内、与宿主植物联合固氮且对宿主无害的微生物[7],其占据着植物组织内有利于营养供应和微环境适宜的生态位,能避免化合态氮的抑制及土著微生物的竞争[8],几乎可以在宿主植物的各种营养器官内发挥固氮作用,为植物提供无机氮源,而不会引起宿主任何不良反应[9]。另外,内生固氮菌在促进植物生长、增强植株抗病性和抗逆性等方面同样具有重要作用[10,11]。相对于传统化学氮肥,微生物固氮菌肥效率高、污染小,是一种环境友好型生物肥料,对改良土壤环境、提高作物产量均有重要的经济和社会效益[12]。掌握植物自身的促生内生固氮菌的分布规律是合理开发使用微生物肥料的前提。
目前已在一些粮食作物如水稻[13]、玉米[14]和经济作物甘蔗[8]等中验证了内生固氮菌的存在,但对于非固氮树种的内生固氮菌研究较少。中国近年来才逐步开展对非固氮树种的固氮研究,迄今为止尚无关于果树内生固氮菌相关研究的报道。
高通量测序技术是一项不依赖于传统微生物培养的生物技术,广泛应用于不同环境中的微生物群落研究[15]。高通量测序的分子标记主要是16SrRNA的V3-V4序列或ITS序列等细菌、真菌的鉴别性基因,近年来逐渐发展起来一些AOA、AOB、NifH等功能基因,其中NifH基因是所有固氮微生物含有的最保守的功能基因,在进化上与16SrRNA基因有较高的相关性,常被作为固氮微生物多样性分析及物种分类的标准。本研究旨在应用高通量测序技术,分析苹果砧木M9T337不同部位内生固氮菌群落结构和多样性特征,以期为苹果砧木M9T337内生固氮菌的开发利用提供理论基础。
1 材料与方法
1.1 试验材料
两年生苹果矮化自根砧木M9T337的根、枝、叶,于2019年7月采自西南林业大学树木园,每个组织部位取4个重复,共计12个样本。样本均采自无明显病虫害、生长健康的植株。
1.2 试验方法
1.2.1 样本基因组DNA提取 取苹果砧木M9T337根(G)、枝(Z)、叶(Y)各3 g,先用流水冲洗10 min,再使用70%乙醇、0.1%升汞、无菌水依次洗涤。其中,70%乙醇浸泡60 s,0.1%升汞分别处理根、枝、叶20、10、3 min,无菌水冲洗4次。采用稀释涂布法将最后一次冲洗的无菌水涂布于NA培养基中,30℃培养2 d,以在NA培养基上无菌生长为消毒合格。经表面消毒后的根、枝、叶作为下一步试验样本,采用DNA提取试剂盒Fast DNA Spin Kit for Soil(MP Biomedicals公司)进行基因组DNA提取,具体方法参考试剂盒说明书。
1.2.2 内生固氮菌NifH基因的PCR扩增 以提取的植物总DNA为模板,采用NifH基因通用引物进行扩增,扩增片段长度330 bp。引物序列为POLF:5′-TGCGAYCCSAARGCBGACTC-3′;POLR:5′-ATSGCCATCATYTCRCCGGA-3′[16]。PCR扩 增 体系:DNA模板2μL,POLF 1μL,POLR 1μL,Mix 25μL,ddH2O 21μL;PCR反应条件:98℃2 min;98℃15 s,55℃30 s,72℃30 s,30个循环;72℃5 min。PCR产物回收(Vazyme VAHTSTM DNA Clean Beads)后用荧光定量系统(Quant-iT PicoGreen ds-DNA Assay Kit)进行检测,随后由昆明汉岭生物科技有限公司使用Illumina Miseq测序平台进行序列测定。
1.2.3 生物信息学分析 通过Miseq测序得到双端序列数据,首先根据PE之间的重叠关系,利用FLASH软件拼接、QIIME软件过滤、UCHIME去除嵌合体后,得到有效优化序列。然后利用UP-ARSE算法对优化序列在97%水平上进行OTU聚类分析,挑选出OTU代表性序列,并利用Greengene和Silva等数据库进行物种注释,去除注释为叶绿体、线粒体及非细菌界的OTU。通过对OTU进行Alpha多样性、Beta多样性、物种差异和群落组成分析等得到苹果砧木M9T337不同部位内生固氮菌群落结构组成及多样性特征。
2 结果与分析
2.1 M9T337不同部位测序结果的质量分析
通过对苹果砧木M9T337根、枝、叶部位进行Illumina Miseq高通量测序,分别获得1707754、1496676、1691076条原始序列,对原始序列进行质控过滤,优化后分别得到1468598、1311182、1464006条去除嵌合体后的高质量序列。按97%相似度的分类水平划分分类单元,并按最小样本序列数进行抽平,通过对抽平后的ASVOTU表格进行统计,根、枝、叶部位分别获得793、333、674个OTU。
Observed OTU指数是反映样本中微生物多样性的指数,利用各样本测序量在不同测序深度时的微生物多样性指数构建曲线,可以反映各样本在不同测序深度时的微生物多样性。结果(图1)表明,随着测序深度的增加,各部位样本的稀疏曲线斜率趋于平滑,说明本次测序数据合理,样本Alpha多样性指标达到稳定,继续增加测序深度对样本信息贡献量小。
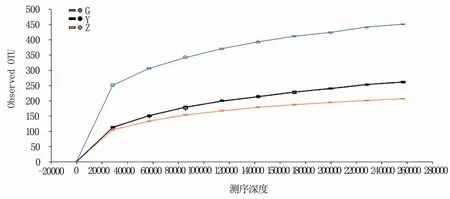
图1 基于Observed OTU指数构建的稀疏曲线
2.2 M9T337不同部位内生固氮菌Alpha多样性分析
Alpha多样性分析包括一系列统计学指数。以Chao1和Observed species指数表征丰富度,以Shannon和Simpson指数表征多样性,以Pielou指数表征均匀度,以Goods coverage指数表征覆盖度。
通过Kruskal-Wallis秩和检验,验证Alpha多样性差异的显著性,结果见图2。M9T337根、枝和叶部样本的覆盖度较高(>99.9%),表明测序数据足够真实反映M9T337不同部位内生固氮菌群落的多样性;M9T337根、枝、叶的内生固氮菌Shannon指数(2.53、1.93、2.47)和Simpson(0.57、0.49、0.59)指数无显著差异(P=0.58,P=0.94);Chao1指 数(555.519、242.005、365.417)和Observed species指数(457.875、201.175、289.15)差异显著(P=0.05,P=0.05),总体表现为根>叶>枝。Pielou指数显示,根、叶、枝内生固氮菌均匀度(0.286、0.302、0.252)无显著差异(P=0.87)。

图2 M9T337不同部位内生固氮菌的Alpha多样性指数
2.3 M9T337不同部位内生固氮菌Beta多样性分析
Beta多样性是指沿着环境梯度变化的不同群落之间,物种组成的相似性、差异性以及物种沿环境梯度的更替速率,因此也被称为生境间多样性(between-habitat diversity)。通过主坐标分析(principal coordinate analysis,PCoA)可展示样本组间是否具有差异。由图3可知,主坐标1(Axis 1)和主坐标2(Axis 2)的样本差异贡献率分别为54.9%和7.3%。其中主坐标1是差异的主要来源,通过主坐标1可以对根部和枝部内生固氮菌群落聚类,表明根部和枝部组间群落结构差异较大。叶部有2个样本点落在根部聚类,2个样本点落在枝部聚类,说明叶部内生固氮菌群落结构与根和枝均有一定相似性。
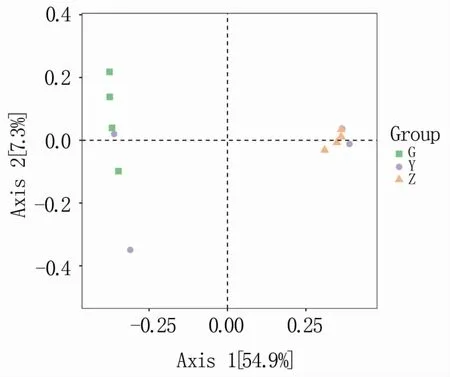
图3 M9T337不同部位内生固氮菌的PCoA分析
2.4 M9T337不同部位内生固氮菌种群归类分析
以97%相似水平对样本序列进行OTU聚类分析,M9T337不同部位的内生固氮菌分类阶层总数明显不同(表1)。其中,根部内生固氮菌可归类到4个门(phylum),6个纲(class),11个目(order),17个科(family),22个属(genus);枝部内生固氮菌可归类到4个门,6个纲,10个目,16个科,17个属;叶部内生固氮菌可归类到5个门,7个纲,12个目,19个科,26个属。叶部的内生固氮菌种类高于根部和枝部。

表1 M9T337不同部位内生固氮菌群落分类阶层总数
韦恩图能直观展示样本中共有和独有OTU数目,可反映出样本间OTU数目组成的相似性及重叠情况。由图4可知,不同部位内生固氮菌群体组成存在较大差异,3个部位共有OTU数为155个(14.78%)。根部特有的OTU数最多,为298个(28.41%),叶部特有OTU为95个(9.06%),枝部特有OTU为60个(5.72%)。叶部和根部共有的OTU数最多,为478个(45.57%),叶部和枝部共有OTU为256个(24.41%),根部和枝部共有OTU为172个(16.40%)。

图4 M9T337不同部位内生固氮菌总样本OTU的韦恩图
2.5 M9T337不同部位内生固氮菌群落组成
2.5.1 门水平下的群落组成 根部内生固氮菌群分布在4个门,包括变形菌门(Proteobacteria,85.15%)、放线菌门(Actinobacteria,0.36%)、蓝藻菌门(Cyanobacteria,0.03%、)和厚壁菌门(Firmicutes,0.0005%)(图5)。枝部内生固氮菌群分布在4个门,包括变形菌门(87.09%)、放线菌门(0.29%)、蓝藻菌门(0.01%)和厚壁菌门(0.007%)。叶部内生固氮菌群分布在5个门,包括变形菌门(83.07%)、放线菌门(1.78%)、蓝藻菌门(0.12%)、厚壁菌门(0.02%)和广古菌门(Euryarchaeota,0.003%)。
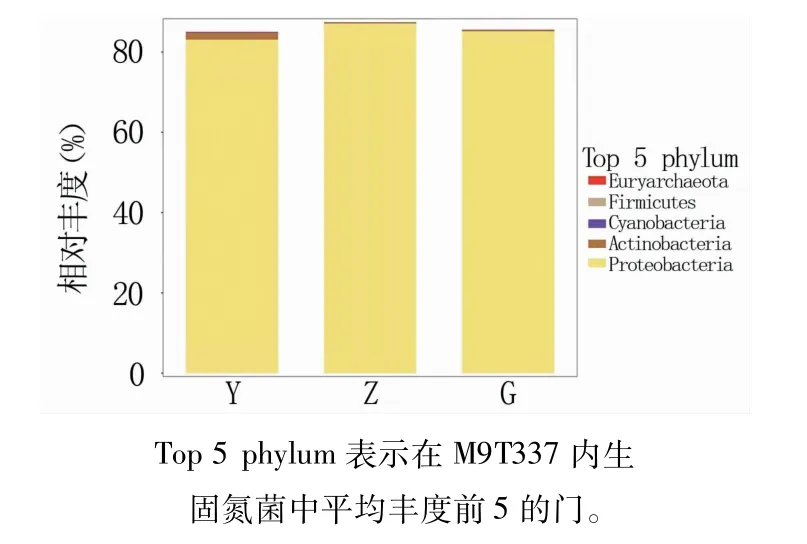
图5 M9T337内生固氮菌在门水平下的物种组成
3个部位共有的且相对丰度最高的均为变形菌门,其次是放线菌门。其中广古菌门是叶部样本所特有。此外,M9T337根、枝、叶部内生固氮菌存在未鉴定及不可归类的门,其相对丰度在12.59%~15.01%。
2.5.2 属水平下的群落组成 从属水平看(图6),M9T337根部丰度前20的内生固氮菌群包括固氮螺菌属(Azospirillum,31.19%)、慢生根瘤菌属(Bradyrhizobium,16.78%)、斯克尔曼氏菌属(Skermanella,0.39%)、弗兰克氏菌属(Frankia,0.36%)、固氮根瘤菌属(Azorhizobium,0.28%)、拜叶林克氏菌属(Beijerinckia,0.1%)、中华根瘤菌属(Sinorhizobium,0.08%)、中生根瘤菌属(Mesorhizobium,0.05%)、肠 杆 菌 属(Enterobacter,0.05%)、固氮菌属(Azotobacter,0.04%)、Methyloferula(0.03%)、假食酸菌属(Pseudacidovorax,0.03%)、甲基弯曲菌属(Methylosinus,0.006%)、嗜糖假单胞菌属(Pelomonas,0.002%)、芽孢杆菌属(Bacillus,0.0006%)、假 单 胞 菌 属(Pseudomonas,0.0006%)、脱硫弧菌属(Desulfovibrio,0.0002%)、地杆 菌 属(Geobacter,0.0002%)、Paraburkholderia(0.0001%)、Azonexus(0.0002%)。

图6 M9T337内生固氮菌在属水平下的物种组成
叶部丰度前20的内生固氮菌群包括慢生根瘤菌属(11.92%)、固氮螺菌属(1.88%)、弗兰克氏菌属(1.78%)、固氮根瘤菌属(1.29%)、肠杆菌属(0.38%)、斯克尔曼氏菌属(0.09%)、Methyloferula(0.07%)、Paraburkholderia(0.04%)、中生根瘤菌属(0.02%)、脱硫弧菌属(0.02%)、芽孢杆菌属(0.01%)、拜叶林克氏菌属(0.01%)、地杆菌属(0.01%)、Pleomorphomonas(0.01%)、黄色杆菌属(Xanthobacter,0.009%)、甲基弯曲菌属(0.008%)、甲烷丝菌属(Methanothrix,0.003%)、嗜糖假单胞菌属(0.002%)、类 芽 胞 杆 菌 属(Paenibacillus,0.001%)、固氮菌属(0.0007%)。
枝部可归类到属的内生固氮菌群仅有17种,包括慢生根瘤菌属(8.64%)、固氮根瘤菌属(1.79%)、固氮螺菌属(0.45%)、肠杆菌 属(0.31%)、弗兰克氏菌属(0.29%)、固氮弓菌属(Azoarcus,0.07%)、地杆菌属(0.06%)、脱硫弧菌属(0.05%)、甲基弯曲菌属(0.04%)、产氢细菌属(Ethanoligenens,0.007%)、黄 色 杆 菌 属(0.004%)、Methyloferula(0.002%)、Paraburkholderia(0.002%)、伯克霍尔德氏菌属(Burkholderia,0.0008)、斯克尔曼氏菌属(0.0007%)、中生根瘤菌属(0.0005%)、克雷伯氏菌属(Klebsiella,0.0002%)。
叶部和枝部的最优菌属是慢生根瘤菌属,根部的最优菌属是固氮螺菌属。甲烷丝菌属、类芽胞杆菌属、脱氯单胞菌属(Dechloromonas,0.0003%)、Azospira(0.0001%)是叶部特有属;产氢细菌属(0.007%)、克雷伯氏菌属(Klebsiella,0.0002%)是枝部特有属;Azonexus(0.0002%)、假单胞菌属(0.0006%)是根部特有属。此外,M9T337根、枝、叶部内生固氮菌存在大量未鉴定及不可归类的属,其相对丰度在50.61%~88.29%,这表明M9T337不同部位内生固氮菌存在大量新属种的可能。
2.6 M9T337不同部位样本间的相似性分析
为进一步比较样本间的物种组成差异,实现对各样本物种丰度分布趋势的展示,基于属水平的物种注释及丰度分析,选取M9T337中平均丰度前28位的内生固氮菌属绘制聚类热图。
结果(图7)显示,枝部和叶部样本聚类在一起,说明属水平枝与叶部内生固氮菌群落组成较相似。层级聚类可以展示不同菌属的相关性,不同类群菌属被拆分成3簇,固氮菌属、中华根瘤菌属、假食酸菌属、斯克尔曼氏菌属等聚在第1簇,在根部的丰度明显高于枝和叶部;固氮弓菌属、产氢细菌属、克雷伯氏菌属、脱硫弧菌属、地杆菌属等聚在第2簇,在枝部丰度明显高于根和叶部;肠杆菌属、黄色杆菌属、Methyloferula、Paraburkholderia以及弗兰克氏菌属聚在第3簇,在叶部丰度明显高于根和枝部。不同类群菌属组间丰度差异较大,均有各自区别于其他两个部位的高丰度菌属。
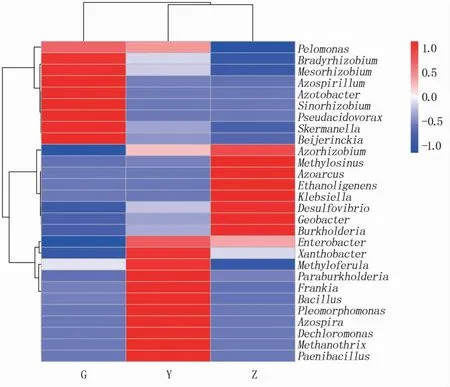
图7 M9T337内生固氮菌在属水平的物种组成聚类热图
3 讨论
本试验首次利用高通量测序技术对苹果植株内生固氮菌进行研究,结果表明内生固氮菌广泛分布在苹果砧木M9T337根、枝、叶各个组织。早在1958年,Dabereiner和Ruschei等首次从热带甘蔗的根际分离到固氮细菌。后期相继在水稻[17]、棕榈树[18]、玉米[19]、小麦[20]等植物中利用可培养技术分离获得内生固氮菌。随高通量测序技术的发展,前人利用基于NifH基因的高通量测序技术研究了玉米、巨菌草等植物内生固氮菌的多样性及群落结构[21,22]。现已在一系列草本、木本植物中验证了内生固氮菌的存在,暗示着内生固氮菌可能与内生菌一样普遍存在。
在Alpha多样性分析中,M9T337内生固氮菌群在根、枝、叶部位分布均匀,多样性差异不显著,Shannon指数范围在1.93~2.53,根部和叶部多样性总体一致并略高于枝部。内生固氮菌定殖于植物体内,在不同部位、不同地区、不同树种中均表现出丰富的群落多样性。贾雨雷等[11]研究发现禾本科作物巨菌草根的内生固氮菌群落多样性在不同地区有较大差异,Shannon指数范围在1.52~3.76;罗娜等[23]发现茄科植物辣椒根、茎、叶内生固氮菌多样性丰富,不同部位Shannon指数范围在0.53~1.07;牛艳芳[24]对内蒙古根河地区不同林木树种根际土壤固氮菌多样性进行研究,发现3个树种(兴安落叶松、白桦、山杨)的根际土壤固氮菌Shannon指数范围在0.92~1.87。
内生固氮菌分布具有很大的异质性,本研究中内生固氮菌丰富度在M9T337不同部位表现出显著差异,且根>叶>枝。林标声等[22]应用高通量测序技术发现巨菌草在同一生长时期内生固氮菌根部中的微生物菌群丰富度明显多于茎和叶,且根>叶>茎。李剑峰等[25]研究发现沙蓬内生固氮菌分布在宿主不同生长时期和不同组织部位,且主要分布于根系和叶片,根部的丰富度较高。不同植物不同部位的内生固氮菌总体表现为根部多样性与丰富度占优势。
M9T337根、枝、叶内生固氮菌组成及丰度存在差异,不同部位既有共有物种,又有独有物种。在门水平上,植株3个部位最优内生固氮菌门均为变形菌门,其次为放线菌门。已有研究表明变形菌门是多数植物内生菌的最优菌门[26],巨菌草[22]中优势内生固氮菌门为变形菌门和蓝藻菌门;玉米[27]中优势内生固氮菌门为变形菌门和拟杆菌门(Bacteroides)。在门水平上植物内生固氮菌的组成具有相似性。
在属水平上,慢生根瘤菌属是叶部和枝部的优势菌属,固氮螺菌属是根部的优势菌属。慢生根瘤菌属是一种普遍存在于植物内部具有固氮作用的根瘤菌,最早从豆科植物根部分离出来,属好氧或兼性厌氧菌[28]。固氮螺菌属是兼性内生固氮菌,为典型的植物根际联合固氮菌,许多固氮螺菌能将亚硝酸盐还原为N2O和N2,能利用多种碳源和氮源进行代谢[29]。除了几种主要的内生固氮菌外,总丰度较高的还有放线菌门的弗兰克氏菌属,此菌属最显著的特征是能与非豆科木本植物共生固氮[30]。此外,在根部丰度较高的斯克尔曼氏菌属以及固氮螺菌属都是变形菌门红螺菌目下的菌属,红螺菌目是由光合细菌组成的一个目,所有的种都营厌氧光合作用,不释放氧气[31]。每个部位除了共有的菌属,还有独有的菌属。根部中特有的假单胞菌属具有分泌有机酸(如甲酸、醋酸、丙酸)的能力,这些酸可将土壤中不溶性磷素转变为可溶性磷素,同时一些羟酸可与钙、铁等形成螯合物,使磷能够有效溶解及被植物吸收[32],是植物根际常见的联合固氮菌。叶部特有的Azospira以及根部特有的Azonexus也是变形菌门红螺菌目下的菌属,表明红螺菌目下的菌属作为内生固氮菌属普遍存在于M9T337植株不同组织部位。枝部特有的肠杆菌科的克雷伯氏菌属兼性厌氧菌,营养要求不高,有呼吸和发酵两种类型的代谢,部分菌株具有固氮能力,此外枝部特有的产氢细菌属具有高效产氢能力[33],参与植物体代谢活动。结合物种组成热图中的层级聚类分析,可以发现不同部位的菌属聚类有其规律,根中丰度较高的固氮菌属、中华根瘤菌属、假食酸菌属、斯克尔曼氏菌属等聚在第一簇,主要是一些典型的根际联合固氮菌[34-36];枝部丰度较高的固氮弓菌属、产氢细菌属、克雷伯氏菌属、脱硫弧菌属以及地杆菌属等聚在第2簇,主要是与厌氧呼吸及代谢活动有关的菌属[33,37];叶部中丰度较高的肠杆菌属、黄色杆菌属、Methyloferula以及弗兰克氏菌属等聚在第3簇,主要是与固氮、光合作用以及呼吸活动有关的菌属[38-40]。此外3个部位内生固氮菌还存在大量未定属的OTU序列,表明植株不同部位含有大量发挥固氮活性的内生固氮菌未找到与目前采用的数据库相匹配的分类信息,存在大量新属种的可能。
本研究首次在苹果叶部发现了特有的内生固氮古菌,归属于广古菌门甲烷微菌纲(Methanomicrobia)甲烷八叠球菌目(Methanosarcinales)甲烷丝菌属。早期的研究认为古菌主要存在于一些极端环境中,Xu等[41]应用可培养技术从我国西藏盐碱湖底泥中分离到两种嗜盐碱古菌新种,随后又有多名学者从不同的生境中分离得到了古菌,说明古菌普遍存在于土壤、淤泥等外界环境中。但利用非培养方法研究植物内生古菌的报道并不多,早期有学者构建了玉米内生古菌的克隆文库,但在克隆文库中检测到的古菌丰富度很低[42];孙磊[43]通过非培养方法发现水稻内生菌群落中存在古菌。本研究首次在苹果叶部发现内生固氮古菌的存在,后续可进一步扩大样品量明确其他部位是否存在内生固氮古菌。
在相似性分析中,叶部和枝部聚类在一起,表明这两个部位的内生固氮菌群相似性较高,结合Beta多样性分析,发现叶部内生固氮菌群与根、枝部都有交叉。推测由于土壤中的固氮微生物进入植株根部,部分从植株根部向枝部、茎部迁移,叶部、枝部便与根部产生共有物种。
4 结论
内生固氮菌在苹果砧木M9T337不同组织部位中普遍存在;植株根、枝、叶部内生固氮菌多样性无显著差别,但丰富度差异显著,根部丰富度最高,枝部丰富度最低;M9T337不同组织部位内生固氮菌的最优菌门均为变形菌门,叶部和枝部的最优菌属是慢生根瘤菌属,根部的最优菌属是固氮螺菌属;M9T337叶部存在内生固氮古菌。
