ApoE4转基因小鼠在阿尔茨海默病研究中的应用进展
2022-03-11贺云赵宏伟齐冬梅程肖蕊刘西建
贺云,赵宏伟,齐冬梅,程肖蕊*,刘西建*
(1.山东中医药大学中医学院,济南 250355;2.山东中医药大学中医药创新研究院,济南 250355)
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的神经退行性疾病,主要表现为渐进性认知功能退化、记忆丧失、人格和行为改变等,AD患者占AD及其他痴呆者的63% ~ 70%[1-2]。脑内Aβ沉积导致的斑块和Tau蛋白过度磷酸化形成的神经纤维缠结及神经元丢失是该病的主要病理特征[3]。AD发病机制复杂,迄今尚不明确,临床亦无有效治疗药物。大量临床和实验研究结果表明,ApoE4等位基因是散发型AD最强、最主要的遗传危险因素[4-5],但ApoE4诱导AD发病机制尚不清楚。ApoE4转基因小鼠也被广泛用于AD发病机制和防治药物的研究。本文对ApoE4转基因小鼠的AD样性状及其在AD研究中的应用进行系统综述,为AD相关研究提供借鉴。
1 ApoE4转基因小鼠
1.1 载脂蛋白E与AD发生的关系
ApoE是一种由299个氨基酸残基组成的糖蛋白,分子量约为34 × 103,主要在肝合成,通过介导肝清除脂蛋白颗粒而在血浆胆固醇稳态中发挥关键作用[6],同时也在大脑中产生,过去认为主要是在星形胶质细胞中产生[7],近期发现小胶质细胞及神经元中的表达量也增多[8-10]。在大脑中主要是参与胆固醇和脂质代谢,主要作用是将胆固醇输送到神经元,并且清除脂质碎片以促进髓鞘修复[11]。
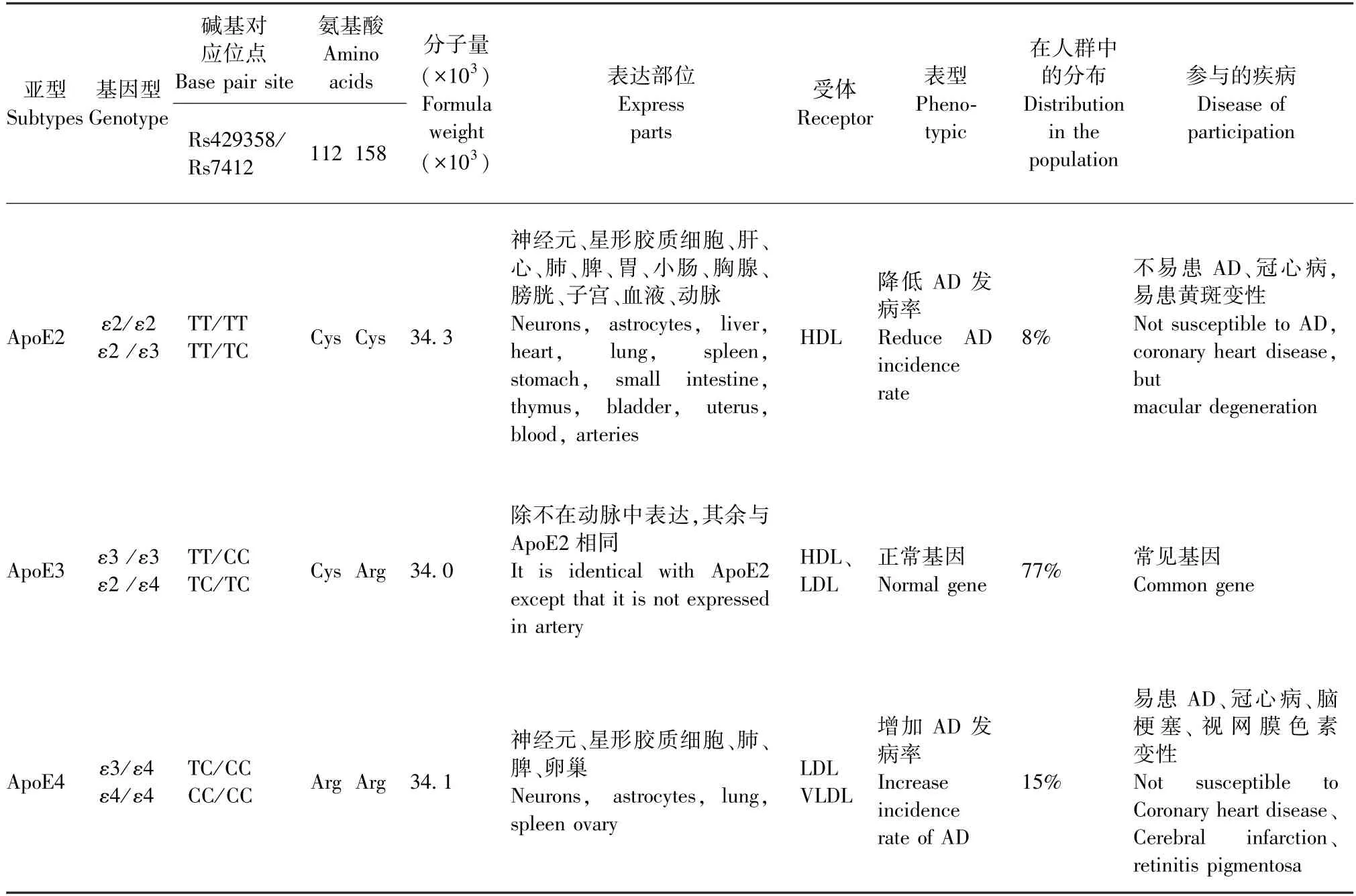
表1 载脂蛋白E各亚型的生物学信息Table 1 Biological information on subtypes of apolipoprotein E
1.2 ApoE4转基因小鼠的生物学特性
目前,已经建立了几个表达人类ApoE3或ApoE4的转基因小鼠品系(表2),主要有:NSEApoE3、NSE-ApoE4、ApoE4、ApoE3、GFAP-ApoE4和GFAP-ApoE3品系,其中NSE-ApoE4和GFAPApoE4转基因小鼠在12月龄时出现空间学习记忆能力的障碍,而ApoE4转基因小鼠则在9月龄表现出空间学习记忆缺陷[21]。在这些品系中,ApoE4转基因小鼠是最常用的,本文主要综述该品系小鼠在AD中的应用研究进展。

表2 不同品系ApoE4转基因小鼠的空间学习记忆能力Table 2 Spatial learning and memory ability of ApoE4 transgenic mice
1.2.1 ApoE4转基因小鼠的学习记忆功能
Kim等[30]通过Morris 水迷宫(morris water maze,MWM)实验对5月龄雌性小鼠进行检测发现,ApoE4转基因小鼠与野生型(wild type,WT)即C57BL/6J小鼠空间学习记忆能力无差异,而Kou等[21]发现9月龄雌、雄性ApoE4转基因小鼠相较于WT小鼠,其学习期逃避潜伏期延长,检测期穿环次数减少、目标象限停留时间和目标象限运动距离均缩短。Hartman等[31]、Chouinard-Watkins等[32]研究显示12月龄ApoE4转基因小鼠与WT小鼠在空间学习记忆方面无差别。Wang等[33]通过Morris水迷宫和放射迷宫(radial maze,RM)实验研究13 ~ 24月龄ApoE4转基因小鼠均有空间学习记忆功能的损伤。Chouinard-Watkins等[32]通过新异物体识别(natural object recognition,NOR)实验检测12月龄ApoE4转基因小鼠发现与ApoE3转基因小鼠相比,ApoE4转基因小鼠运动距离延长、辨识别指数降低,提示其新异物体识别能力发生损伤。Siegel等[34]通过避暗实验(passive avoidance,PA)发现,10 ~ 13月龄ApoE4转基因小鼠相较于ApoE2转基因小鼠,错误次数减少,进入暗室的逃避潜伏期缩短,说明被动回避反应能力未受到损害。Siegel等[34]高架十字迷宫(elevated plus maze,EPM)实验结果表明,10 ~ 13月龄ApoE4转基因小鼠相较于ApoE3和ApoE2转基因小鼠,在开臂停留时间(open-arms time,OE)短,但是Lin等[35]也有研究发现12月龄ApoE4转基因小鼠与ApoE3转基因小鼠开臂停留时间和进入开臂的次数(open-arms entries, OT)无差异。明暗箱实验[32](light-dark box,LDB)检测结果中12月龄ApoE4转基因小鼠相较于ApoE3转基因小鼠在明箱停留时间长,说明尚不能肯定ApoE4小鼠是否有焦虑情绪。悬尾实验(tail suspension tes,TST)结果表明,3月龄和12月龄小鼠ApoE4转基因小鼠与ApoE3转基因小鼠僵直不动时间无差异[35],糖水偏好实验(sucrose preference test,SPT)结果3月龄ApoE4转基因小鼠与ApoE3转基因小鼠糖水偏爱指数无差异,说明其没有抑郁情绪。
另外,转棒实验(rota-rod test,RRT)表明12 ~ 14月龄ApoE4转基因小鼠相较于WT小鼠,在转棒上停留时间缩短,说明其运动协调能力差[35]。
这些研究结果表明,ApoE4转基因小鼠学习记忆功能的显著损伤出现在13月龄以后,主要包括空间学习记忆能力和物体识别记忆能力,但其不表现焦虑与抑郁情绪(表3)。

表3 ApoE4转基因小鼠的认知功能Table 3 Cognitive function of ApoE4 transgenic mice

续表3
1.2.2 ApoE4转基因小鼠的病理特征
对于AD的特征性病理变化Aβ斑块,有研究采用DAB染色的免疫组化(immunohistochemistry,IHC)技术检测雌性3月龄ApoE4转基因小鼠的皮层,发现ApoE4转基因小鼠有少量的Aβ沉积,10月龄ApoE4转基因小鼠皮层中有显著Aβ沉积[39]。
正这时北村一个老婆婆疯了似的哭着跑来和李青山拼命。她捧住头,象捧住一块石头般地投向墙壁,嘴中发出短句:
Tau蛋白过度磷酸化是形成AD另一特征性病理NFT的原因,Liraz等[40]采用mAb AT8IHC检测4月龄ApoE4和ApoE3转基因小鼠海马中磷酸化Tau蛋白和总Tau蛋白含量,发现CA3和CA1区锥体神经元以及DG区颗粒神经元中的磷酸化Tau和总Tau水平明显高于ApoE3转基因小鼠。
对于脑体积变化,通过免疫组化技术检测9月龄的小鼠发现,WT小鼠与ApoE4转基因小鼠大脑体积无差异,未出现萎缩[41]。Wang等[33]使用7T磁共振成像检测12和24月龄小鼠脑体积比例的变化,发现12月龄ApoE4转基因小鼠与ApoE3转基因小鼠海马和皮层体积分别占全脑体积的比例无差异。而与24月龄ApoE3转基因小鼠相比,同龄ApoE4转基因小鼠的皮层、海马的体积分别占全脑体积的比例均降低,说明皮层和海马萎缩严重[33]。Dolejší等[42]进一步通过IHC检测4月龄ApoE4与ApoE3转基因小鼠海马突触前囊泡乙酰胆碱转运体(vesicular acetylcholine transporter,VAChT),发现ApoE4与ApoE3转基因小鼠突触前VAChT水平相似,但是对ApoE4转基因小鼠CA3和CA1海马亚区中突触前囊泡谷氨酸转运体(glutamatergic vesicular transporter,VGlut)的染色强度相较于ApoE3转基因小鼠低,说明ApoE4转基因小鼠海马中谷氨酸能神经元减少[40]。对于GABA能神经元,Andrews-Zwilling等[43]、Li等[44]通过脑切片IHC抗GAD67和抗生长抑素染色对6、12 ~ 13、16月龄的小鼠海马的GABAergic中间神经元定量分析发现,6、12 ~ 13、16月龄时相较于ApoE3转基因小鼠,ApoE4转基因小鼠齿状回GABAergic神经元均显著减少,16月龄的ApoE3转基因小鼠与ApoE4 转基因小鼠CA1区GABAergic神经元未出现差异。Sun等[45]、Klein等[46]通过生物素染色(biocytin staining,BS)法研究结果显示,相较于ApoE3转基因小鼠,ApoE4转基因小鼠在4月龄时其海马神经元的树突分枝少、长度短且树突棘密度低,在7月龄时其杏仁核神经元的树突分枝也少且长度短。Li等[44]通过共聚焦显微镜成像(confocal microscopic images,CMI)研究结果发现,与野生型小鼠相比,6 ~ 7月龄ApoE4转基因小鼠海马新生神经元树突长度短而分枝少。Zhu等[47]通过免疫荧光(immunofluorescence,IF)染色分别检测3月龄和9月龄ApoE3和ApoE4转基因小鼠海马和皮层突触体中突触结合蛋白1(synaptojanin 1,synj1)发现3月龄ApoE3和ApoE4转基因小鼠海马和皮层synj1无差异,但是9月龄ApoE4转基因小鼠海马和皮层synj1表达水平比ApoE3转基因小鼠高。这些研究结果提示,谷氨酸能与GABA能神经元的丢失、神经元中树突与突触减少是导致ApoE4转基因小鼠脑萎缩的原因。
综合以上研究结果发现,ApoE4转基因小鼠早在3月龄皮层中Aβ蛋白就有少量沉积,在10月龄Aβ蛋白显著增多,4月龄时海马Tau蛋白磷酸化水平就显著升高,谷氨酸能和GABA能神经元减少、成熟与新生神经元的树突分枝少长度短且树突棘密度低从而使其在老年时呈现脑萎缩。这些研究表明,ApoE4转基因小鼠具有AD的典型病理特征(表4)。

表4 ApoE4转基因小鼠的病理特征Table 4 Pathological characteristics of ApoE4 transgenic mice
1.2.3 ApoE4转基因小鼠的生理生化表型
ApoE4转基因小鼠除了呈现AD样认知行为学与病理学特征外,其生理生化也表现出一些特有变化(表5),如:相较于ApoE3转基因小鼠,ApoE4转基因小鼠在2.3 ~ 3月龄时,海马星形胶质细胞中Ca2+兴奋性增强[48];在4和12月龄时其海马突触可塑性降低,且12月龄与4月龄ApoE4转基因小鼠相比其突触活性降低[45];7月龄时,杏仁核中神经元突触传递减弱,锥体样神经元自发兴奋性突触后电流(spontaneous excitatory post-synaptic currents,sEPSCs)间隔时间延长,兴奋性传递损伤[46]。另外,与ApoE3转基因小鼠相比,ApoE4转基因小鼠海马和皮层中ApoE、ApoER2的表达(12月龄)[35]及免疫球蛋白G(IgG)水平(10月龄)[39]显著降低,同时海马中的磷酸肌醇二磷酸(phosphoinositol biphosphate,PIP2)(9月龄)[47]、胆固醇(12月龄)[47]、三磷酸腺苷(adenosine triphosphate,ATP)(16月龄)[49]也显著降低,而Aβ42水平显著升高(2 ~ 4月龄)[50]。

表5 ApoE4 转基因小鼠的生理生化表型Table 5 Physiological and biochemical phenotypes of ApoE4 transgenic mice
2 ApoE4参与AD的发病机制
目前的研究结果表明,ApoE4参与AD的发病机制可能涉及增加脑内Aβ沉积并减少其清除率、Tau蛋白过度磷酸化、血脑屏障损伤及脂质代谢异常,下面对其进行详述。
2.1 ApoE4参与AD中Aβ病理的形成
Aβ从大脑中清除主要通过细胞摄取和酶降解、血脑屏障(blood brain barrier,BBB)和血脑脊液屏障(blood cerebrospinal fluid barrier,BCSFB)运输、间质液(interstitial fluid,ISF)引流通路以及脑脊液(cerebrospinal fluid,CSF)吸收进入淋巴循环系统[51]。LDL受体相关蛋白1(LDL receptor related protein1,LRP1)是大脑中ApoE的主要受体,该蛋白在多种脑细胞类型特别是神经元中大量表达,通过与其他跨膜蛋白偶联,LRP1能够识别并高效结合30多种结构和功能不同的配体,包括ApoE、淀粉样前体蛋白和Aβ[52]。LRP1已经被证明可以介导神经元[53]、星形胶质细胞[54]、小胶质细胞[55]、血管平滑肌细胞和内皮细胞对[56]Aβ的清除。ApoE各个亚型与LRP1结合的能力是ApoE4 > ApoE3 >> ApoE2,提示ApoE4与Aβ竞争性结合LRP1,而导致Aβ被细胞清除的几率下降。另有研究表明,高浓度的ApoE可以形成高分子量的Aβ共聚集体,其中ApoE4比ApoE3更容易促进Aβ聚集,ApoE还以异构体依赖的方式增加Aβ寡聚体的水平(ApoE4 > ApoE3 > ApoE2)[57-58]。此外,ApoE4比ApoE3和ApoE2更能稳定Aβ寡聚体[59],在携带ApoE4基因型的AD患者的临床症状出现前几十年,Aβ就开始沉积在大脑中[60-61]。这些研究表明,ApoE4可加剧Aβ的沉积。
2.2 ApoE4参与AD中Tau蛋白过度磷酸化病理的形成
Tau蛋白过度磷酸化可导致Tau蛋白自我组装成成对的螺丝状丝,即神经纤维缠结(neurofibrillary tangles,NFTs)。研究发现,在患有原发性Tau病变患者中,ApoE中ε4等位基因与大脑区域神经退行性病变严重程度的增加有关[62]。在神经元中表达人类ApoE4的转基因小鼠,Tau蛋白的磷酸化水平升高,而在星形胶质细胞中表达ApoE4则没有显示Tau蛋白的磷酸化水平升高[63],这提示ApoE4在神经元中对Tau蛋白的磷酸化发挥作用。
2.3 ApoE4参与AD中血脑屏障的破坏
最近的研究表明,无论生物标志物Aβ和Tau如何变化,患有早期认知功能障碍的个体都会在海马体中发生脑毛细血管和BBB损伤[64-65],因此,BBB损伤被认为是认知功能障碍的早期生物标志物[64]。基于周皮细胞损伤的生物标志物可溶性血小板生长因子受体-β(soluble platelet-derived growth factor receptor-β,sPDGFRβ),研究发现ApoE4携带者CSF中sPDGFRβ水平增加,且其增加与海马和海马旁回中BBB通透性的增加相关,提示CSF中sPDGFRβ基线水平升高与BBB和周皮细胞细胞损伤有关[65]。临床痴呆评分(clinical dementia rating,CDR)分析发现ApoE4携带者伴认知障碍的CSF中sPDGFRβ增加,但ApoE3携带者却无变化[65]。而且发现BBB损伤的分子生物标志物白蛋白CSF/血浆熵(CSF/plasmaquotient)、以及CSF纤维蛋白原和纤溶酶原水平升高。这些研究结果提示,ApoE4可导致BBB损伤和脑毛细血管周皮细胞的退化[66]。
2.4 ApoE4导致AD脂质代谢异常
AD是一种缓慢进展的疾病,生活方式、习惯和营养模式可以通过影响不同的认知区域导致整体智力退化,脂质代谢失调参与AD的发病机制[67]。研究发现,AD患者和ApoE4携带者大脑和脑脊液中二十二碳六烯酸(DHA)水平降低[68-69]。进一步的研究表明,ApoE4基因可导致血脑屏障的破坏[70]、磷脂和胆固醇的失调[47]。相较于ApoE3转基因小鼠,ApoE4转基因小鼠早在8 ~ 20周龄其血浆胆固醇、甘油三酯水平显著升高[71]。与ApoE3/APP小鼠相比,12月龄ApoE4/APP小鼠脑中磷脂酰肌醇浓度降低[72],15月龄ApoE4/APP小鼠脑中磷脂酰甘油较低而鞘磷脂较高,且12月龄和15月龄的ApoE4/APP小鼠的磷脂酰胆碱也较高[72]。另外,高脂饮食(high fat diet,HFD)可增加ApoE3和ApoE4 转基因小鼠的脂质和葡萄糖代谢紊乱,但雄性HFD-ApoE4 转基因小鼠葡萄糖代谢速度和效率显著低于同性别HFD-ApoE3 转基因小鼠[36-73]。同时研究发现,标准饮食时,ApoE4转基因小鼠的CA1炎症明显多于WT小鼠,而HFD降低ApoE4 转基因小鼠CA1中的CD68的表达[74]。这些结果提示ApoE4可能通过调节脂质与葡萄糖代谢及神经炎症进而影响血浆和脑中低密度膜结构域中的脂质组成。
3 ApoE4转基因小鼠在AD防治药物研发中的应用
由于ApoE4转基因小鼠具有AD典型的认知行为学与病理特征,并参与AD的发病机制,其已被用于各类AD防治药物的研究中(见表6)。

表6 ApoE4转基因小鼠用于AD防治药物药效评价的研究Table 6 Study on the efficacy evaluation of apoE4 transgenic mice in the prevention and treatment of AD

续表6
Guardia-Escote等[75]通过给予10日龄大C57、ApoE3、ApoE4小鼠毒死蜱(溶于玉米油)灌胃5 d,同时对照组小鼠给予5 d玉米油,2个月后进行新物体识别检测,ApoE4转基因小鼠相较于ApoE3、C57小鼠,学习记忆能力出现损伤,2月龄小鼠给药乙酰胆碱酯酶抑制剂利斯的明(0.25 mg/kg),4个月后ApoE4转基因雄性小鼠相较于对照组小鼠学习记忆能力改善,雌性小鼠无改善作用。
已有文献表明ApoE4转基因小鼠用于贝沙罗汀、睾酮、谷氨酰胺酶拮抗剂JHU-083、水杨胺(salicylamide,SA)、戊巴比妥(pentobarbital,PB)等的评价。用类视黄醇X受体激动剂贝沙罗汀(100 mg/(kg·d))口服治疗4月龄雄性ApoE4 转基因小鼠10 d,能够缩短其在MWM中的逃避潜伏期[76]。睾酮(160 mg/(kg·d))腹腔注射6月龄ApoE4转基因小鼠可延长其在Morris水迷宫实验中的目标象限停留时间[77],而皮下注射雄激素受体拮抗剂羟氟他胺却缩短其目标象限停留时间、延长逃避潜伏期[77]。Hollinger等[78]研究发现6月龄雌性ApoE4转基因小鼠给予JHU-083(每周1.83 mg/kg共3次)灌胃4 ~ 5个月,可缩短其在巴恩斯迷宫中学习期和检测期的逃避潜伏期、加快发现目标的速度。Davies等[38]研究表明在4月龄雌、雄ApoE4 转基因小鼠开始饲喂1 g/L SA,持续到小鼠12 ~ 14月龄,可减少其在六臂放射性水迷宫实验中的错误次数、缩短逃避潜伏期。对9月龄雌、雄小鼠分别注射酮类(β-羟丁酸600 mg/(kg·d);乙酰乙酸150 mg/(kg·d))3个月,可缩短其在MWM中的逃避潜伏期、增加穿环次数、延长目标象限停留时间[79]。Tong等[80]研究发现,给予15.5月龄ApoE4转基因雌性小鼠2周GABAA受体增强剂PB(20 mg/kg),可使其在Morris水迷宫测试中逃避潜伏期缩短、目标象限停留时间延长。这些基于ApoE4转基因小鼠的研究表明,贝沙罗汀、睾酮、JHU-083、SA、酮类、PB具有改善空间学习记忆能力的作用,提示它们可能具有防治AD的潜能。
文献报道,王明辉[81]研究发现多酚物质姜黄素(40 mg(kg·d))处理9月龄ApoE4转基因小鼠能缩短其在Morris水迷宫实验中的逃避潜伏期缩短、穿环次数增加。而在雌和雄性E4FAD+、E4FAD-小鼠3月龄时喂养添加菊粉饲料至7月龄,发现对其空间学习记忆能力无作用[82]。
另外,Zaldua等[83]研究发现无论是给6月龄E4FAD-和E4FAD+小鼠表皮生长因子(epidermal growth factor, EGF)(每周300 μg/kg)腹腔注射2.5个月,还是给与8月龄E4FAD-和E4FAD+小鼠EGF治疗2个月,均可延长其在新物体识别实验中对新物体关注的时间、在Y迷宫实验中的新臂停留时间,说明EGF具有改善空间学习记忆的能力。Chouinard-Watkins等[32]喂食4月龄ApoE4转基因小鼠二十二碳六烯酸(docosahexaenoic acid,DHA)饲料8个月后发现ApoE4转基因小鼠在巴恩斯迷宫实验中逃避潜伏期曲线下面积变小,新物体识别实验中,对新物体偏爱指数增加。
4 小结
大量研究证实携带ApoE4基因会使AD的发生提前,是SAD的最大危险因素。本文通过系统综述ApoE4转基因小鼠的认知功能损伤、病理特征及生理生化表型,分析ApoE4参与AD的发病机制途径,列举使用ApoE4转基因小鼠进行AD防治药物药效的评价研究,以期为利用ApoE4转基因小鼠进行AD相关研究提供参考。但是就目前文献报道来看,ApoE4转基因小鼠的空间学习记忆、物体识别记忆、被动回避反应、主动回避反应、恐惧学习记忆等在内的认知能力还缺乏各个月龄的系统性研究,对于AD的特征性病理变化也缺乏充实的数据,其用于AD防治药物的研究也远不及AD其他动物模型如APP、PS1、Tau基因修饰类小鼠及快速老化模型小鼠(SAMP8)。但基于ApoE的生物学功能,ApoE4转基因小鼠对于脂质代谢异常相关的AD发病机制研究是一个相对理想的工具。