Mdr2基因敲除小鼠建立原发性肝癌模型观察
2022-03-11李萌平键徐列明
李萌,平键,3*,徐列明,3
(1.上海中医药大学附属曙光医院,上海 201203;2.上海中医药大学肝病研究所,上海 201203;3.肝肾疾病病证教育部重点实验室,上海 201203)
原发性肝癌是我国最常见的消化系统恶性肿瘤之一,不仅严重威胁人民生命健康,也为医疗资源带来重大负担。据统计,肝癌在2020年全球新发癌症疾病谱中排名第七位,在癌症致死人数中占第三位[1]。原发性肝癌包括两种主要的组织学类型:肝细胞癌(hepatocellular carcinoma,HCC)和肝内胆管癌(intrahepatic cholangiocarcinoma,ICC),其中ICC约占原发性肝癌的15%[2-3]。研究肝癌发病的机制既是重点也是难点,而选择适宜的原发性肝癌动物模型则是肝癌机制研究的必要条件。
Mdr2(multidrug resistance protein2,Mdr2)基因,又名ATP-结合盒B亚家族成员4(ATP-binding cassette subfamily B member 4,Abcb4),其编码的Mdr2蛋白作为一种脂质转运蛋白,能够将胆汁中磷脂的主要成分——磷脂酰胆碱(phosphatidylcholine,PC)从肝毛细胆管膜的内侧转移到外侧[2]。小鼠Mdr2基因敲除后,PC无法通过Mdr2蛋白被分泌到胆汁中,从而造成胆汁中磷脂的缺乏[4]。磷脂缺乏时,胆盐和胆固醇无法与之形成混合胶束,造成胆盐游离,引起胆管细胞损伤并导致胆汁淤积[4-5]。
文献报道显示,小鼠Mdr2基因敲除后表现为肝内外胆管的狭窄和狭窄所致的节段性扩张、“洋葱皮样”胆管周围纤维化和胆管局部性增生,并且随时间推进,逐渐发展为肝纤维化、肝硬化,甚至肝癌[6]。因其肝形态学变化与人类原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)相似,Mdr2-/-小鼠也是目前最常用的PSC转基因动物模型[7]。已有学者使用Mdr2-/-小鼠进行肝癌机制研究,但不同遗传背景的Mdr2-/-小鼠肝癌发生时间存在一定差异。为此,本文观察了C57BL/6背景Mdr2-/-小鼠原发性肝癌的发生时间及发生率,并对其组织学类型进行了鉴定。
1 材料与方法
1.1 材料
1.1.1 实验动物
9只SPF级Mdr2基因敲除小鼠C57BL/6-Abcb4tm1,包括雌6只、雄3只,(11.3 ± 4.2)周龄,约22 g。同周龄及体重的SPF级野生型小鼠C57BL/6野生型小鼠5只(雌3只,雄2只)亦购自苏州赛业实验动物技术有限公司【SCXK(苏)2018-0003】。小鼠饲养于上海中医药大学实验动物中心【SYXK(沪)2020-0009】,普通饲料饮食,自由饮水,相对湿度(55 ± 5)%,温度25℃,光照遵循昼夜节律。本实验通过上海中医药大学实验动物中心和实验动物伦理委员会批准(PZSHUTCM190524006),并且严格遵守实验动物使用的3R原则。
由苏州赛业实验动物技术有限公司采用CRISPR/Cas9技术构建并采用PCR和产物测序进行鉴定。Abcb4基因位于小鼠第5号染色体上(NCBI参考序列:NM_008830),共鉴定出28个外显子,选择第3 ~ 4外显子作为目标位点,设计gRNA(gRNA1∶5’-TACCAAGGGCGGTACCTTCAAGG-3’;gRNA2∶5’-GCTCCTTACCACAATGGTACTGG-3’)将此段基因进行剪切(见图1A)。产生的小鼠进行PCR扩增验证(引物F2∶5’-CTTTGCAGCTAAATA AAGTGGGAC-3’,引物R1∶5’-TCCACCCTAGACC CTTATTGTCTC-3’),然后对PCR产物进行测序,分析测序结果,确认基因型(见图1B)。通过杂合子互配进行扩增繁殖,并采用PCR(引物F1∶5’-TGTCATCTGGCAATTTAGGCTG-3’,引物R1∶5’-TCCACCCTAGACCCTTATTGTCTC-3’,612 bp;引物F2∶5’-CTTTGCAGCTAAATAAAGTGGGAC-3’,引物R1∶5’-TCCACCCTAGACCCTTATTGTCTC-3’,652 bp;纯合子小鼠仅在612 bp处出现条带)筛选出纯合子小鼠用于实验(见图1C),其反应条件为:94℃ 3 min,(94℃ 30 s,60℃ 35 s,72℃ 35 s)× 35循环,72℃ 5 min。
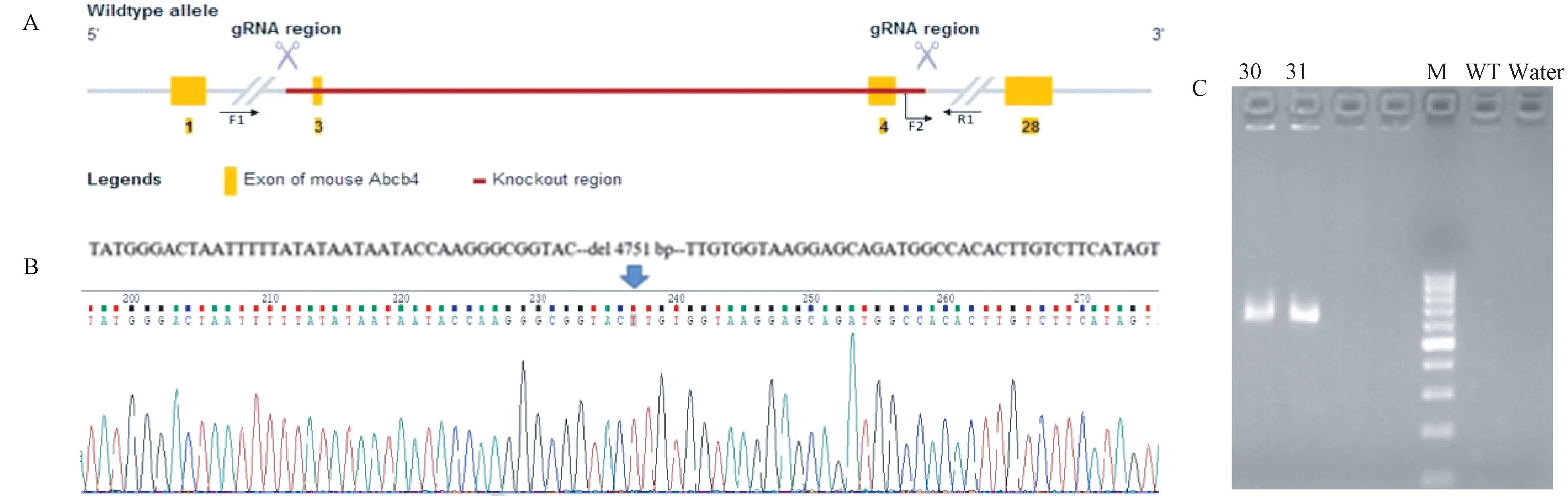
图1 Mdr2-/-小鼠构建原理与鉴定Note. A. gRNA cleaves the exon 3 ~ 4 region of Mdr2 gene. B. Sequencing showed that the 4751 bp sequence in the target region had been knocked out. C. PCR identifies mice as homozygous. 30, 31. Mouse number. M. Marker. WT. Wild type control. Water. Water control.Figure 1 Construction principle and identification of Mdr2-/- mice
1.1.2 主要试剂与仪器
丙氨酸氨基转移酶(laninne aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒,均为南京建成科技有限公司产品;甲胎蛋白(alpha fetal protein,AFP)检测试剂盒为酶联生物公司产品;细胞角蛋白7(cytokeratin-7,CK-7)I抗购自Abcam公司;细胞角蛋白19(cytokeratin-19,CK-19)I抗购自proteintech公司;通用二步法试剂盒、DAB显色试剂盒,均购自中杉金桥公司;山羊血清为上海碧云天生物技术有限公司产品。LEICA ASP300自动脱水机、LEICA EG1160石蜡包埋机、转轮切片机RM2035、HI1220烤片机、均为德国Leica公司产品。M5多功能酶标仪,美国Molecular Devices公司产品。
1.2 方法
1.2.1 血清采集及肝大体观察
小鼠饲养65周后,以20%乌拉坦腹腔注射麻醉,腹主动脉采血,室温静置1 h,以4℃、3000 r/min离心15 min并收取血清。摘取肝后观察其肿瘤发生情况并拍照,留取约0.5 × 0.5 × 0.3 cm3大小肝组织、肿瘤及肿瘤旁组织标本,予10%甲醛固定。
1.2.2 血清ALT、AST检测
按照试剂盒说明检测血清ALT、AST。
1.2.3 血清AFP检测
采用ELISA法检测小鼠血清AFP。按照说明书每样本孔加入血清50 μL,同时设标准品孔、空白孔。各孔中加入辣根过氧化物酶标记的检测抗体工作液100 μL,37℃孵育60 min,弃去液体,每孔加入350 μL洗涤液,静置1 min后吸弃,重复5次。每孔再加入底物A、B液50 μL,37℃避光孵育15 min后加入50 μL终止液,于450 nm波长处测定OD值并计算各样本浓度值。
1.2.4 肝组织病理学观察
将留取的肝组织标本10%甲醛固定48 h后逐级脱水、石蜡包埋,切取4 μm切片。石蜡切片脱蜡至水后进行苏木精-伊红(HE)染色、天狼猩红染色并在光学显微镜下观察照像。
免疫组化染色:将石蜡切片脱蜡至水后置入柠檬酸盐修复液(pH = 6.0)中沸煮30 min进行抗原修复,内源性过氧化物酶阻断剂孵育10 min、10%山羊血清封闭0.5 h。分别滴加CK-7(1 : 8000)或CK-19(1 : 1000)一抗过夜,洗片后,滴加山羊抗小鼠/兔二抗,孵育0.5 h,洗片后,加入DAB显色液显色,以苏木素染色液复染后封片观察。
1.3 统计学分析
2 结果
2.1 两组小鼠肝大体观察比较
小鼠饲养65周后取其肝进行观察。正常组小鼠肝形态均正常,色泽红润,质地柔软,表面光滑无肿块。9只Mdr2-/-小鼠肝表面均可见肿瘤结节,数量不等,形态不一,其余肝组织质地柔韧,各肝叶间偶有黏连(见图2)。

图2 Mdr2-/-小鼠肝肿瘤形态Figure 2 Morphology of liver tumors in Mdr2-/- mice
2.2 两组小鼠肝组织HE及天狼猩红染色观察比较
肝组织HE染色显示:野生型小鼠肝小叶结构清晰,肝细胞索由中央静脉向四周呈放射状排列,无变性坏死,肝窦未见狭窄或扩张。Mdr2-/-小鼠肝癌旁组织HE染色显示,肝小叶结构紊乱,汇管区明显扩大,可见淋巴细胞、单核细胞等炎性细胞浸润。肝肿瘤组织HE染色显示,肿瘤细胞大小不一,细胞形态不规则,排列结构无序,细胞核形态多样或消失(见图3)。
天狼猩红染色观察:野生型小鼠仅在汇管区和中央静脉壁见少量胶原纤维。Mdr2-/-小鼠肝癌旁组织内则胶原增生明显,汇管区有大量胶原纤维形成并向小叶内伸展;肝肿瘤组织天狼猩红染色显示,肝肿瘤内部无明显胶原纤维,而在肿瘤边缘有明显的胶原组织包绕(见图3)。
2.3 两组小鼠血清ALT、AST、AFP水平比较
与野生型小鼠相比,Mdr2-/-小鼠的血清ALT和AST活性均显著升高(P< 0.01,见表1)。ELISA法检测两组小鼠血清AFP水平,结果显示Mdr2-/-小鼠血清AFP水平较野生型小鼠显著升高(P< 0.01,见表1)。
表1 两组小鼠血清ALT、AST、AFP水平( ± s)Table 1 Serum ALT、AST、AFP levels of two groups of mice( s)

表1 两组小鼠血清ALT、AST、AFP水平( ± s)Table 1 Serum ALT、AST、AFP levels of two groups of mice( s)
注:与正常组比较,**P < 0.01。Note. Compared with the normal group,**P < 0.01.
2.4 两组小鼠肝组织CK-7、CK-19染色观察比较
免疫组化结果显示正常组CK-7、CK-19阳性细胞多分布于汇管区,形态规则呈小管状,提示胆管细胞排列规则,未见胆管增生或缺失。Mdr2-/-小鼠肝癌旁组织CK-7、CK-19阳性细胞数量明显增加,且多聚集于汇管区,有大量结缔组织包绕,提示Mdr2-/-小鼠肝有明显的胆管增生。而在肿瘤组织中,多数样本中均未见CK-7、CK-19阳性细胞,个别样本中有散在的CK-7、CK-19阳性细胞单个或小管样分布,但染色面积均未达到5%(见图4)。结合镜下观察及免疫组化染色结果,所有样本均被判断为原发性肝细胞癌。
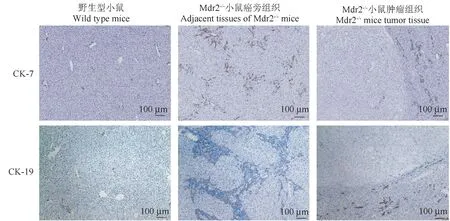
图4 两组小鼠肝CK-7、CK-19染色结果对比(×100)Figure 4 Comparison of CK-7 and CK-19 staining results in the liver of two groups of mice (×100)
3 讨论
目前常见的小鼠原发性肝癌造模方法有化学诱导法、肿瘤移植法以及采用基因修饰小鼠等。其中化学诱导法多采用硫代乙酰胺(thioacetamide,TAA)或二乙基亚硝胺(diethylnitrosamine,DEN)等化学药物长期给药,其建立小鼠原发性肝癌模型的时长多为6 ~ 12个月,诱发小鼠肝癌的成功率较高[8-9]。但高剂量染毒存在动物死亡率较高的风险,故在染毒剂量、方法和时长等方面还需不断优化,尚未形成较统一的造模方案。肿瘤移植法通常将肿瘤组织或细胞株移植到裸鼠皮下或肝,使其成为荷瘤动物模型,其优点是成瘤时间快、造模周期短、易于观测。但遗憾的是其无法模拟人类肿瘤的形成过程中组织学及微环境的自然癌变特征[10]。在本实验中,我们构建了C57BL/6.Mdr2基因敲除小鼠并观察其自发形成肝肿瘤情况。所观察的9只Mdr2-/-小鼠均自发形成肝肿瘤,观察期间未见小鼠死亡,且正常饮食无需染毒,避免了实验操作误差及接触有毒化学品的风险。并且,该小鼠肿瘤的形成机制可能与肝细胞持续存在慢性损伤和炎症相关,经过长期发展最终出现肝癌,此过程无需人为干预,与肿瘤发生的自然特征更为贴近。伴随基因编辑技术的不断进步,基于基因修饰造成肝癌的动物模型已逐渐被重视和采用。例如Kim等[11]建立的HBV相关的转基因肝癌小鼠模型,HBx基因转入CD1小鼠后,小鼠在8 ~ 10月龄时即出现肝肿瘤结节,并在11 ~ 15个月时大多数雄性小鼠将死于肝透明细胞癌。而Engelholm等[12]则利用CRISPR/Cas9技术发现Dnajb1-Prkaca基因融合足以诱导一种多发于儿童的肝癌——纤维层状肝细胞癌(fibrolamellar hepatocellular carcinoma,FL-HCC)。本实验结果显示,Mdr2-/-小鼠在连续饲养65周后均发生了肝肿瘤,此时小鼠的平均月龄为17.5个月,其肿瘤表型为肝细胞癌。
细胞角蛋白(cytokeratin,CK)主要分布于上皮细胞,是角质细胞中的主要骨架蛋白。在正常肝中,胆管上皮细胞主要表达CK-7和CK-19,而正常的成熟肝细胞则不表达,故而CK-7和CK-19对胆管上皮细胞和肝内胆管细胞癌具有特异性染色[13]。本实验中小鼠肝表现出了胆管细胞增生、管腔宽大畸形等胆管病变,但并未在肿瘤样本中发现胆管细胞癌性病变,结合组织病理学观察及CK-7和CK-19免疫组化结果,判断该小鼠自发肿瘤为肝细胞癌。结果表明Mdr2-/-小鼠适宜作为肝细胞癌的研究模型。
尽管Mdr2-/-小鼠肝癌模型具有造模简便、成瘤率高及死亡率低的特点,但其缺点在于造模周期较长。据报道,基于BALB/c背景的Mdr2敲除小鼠在7月龄时即可观测到肝癌发生,其组织学类型为肝细胞癌[6]。本实验构建了C57BL/6小鼠背景的Mdr2敲除小鼠,在饲养55周时处死的小鼠未观察到肝肿块,而在65周观察到本实验9只小鼠全部有肝肿块形成,可能与不同品系小鼠的差异有关。此外,已有研究表明,FVB背景的Mdr2-/-雌性小鼠较雄性疾病进展更快,表现出更严重的胆汁淤积和肝纤维化症状[14-15]。在本实验中雌性和雄性小鼠肿瘤最早发现时间均为71周龄,且血清AFP水平无明显差异,其原因除了品系差异外,也可能与样本数量较少有关。因此进一步探究雌性小鼠是否能更快进展为肝癌,或在Mdr2基因敲除的基础上联用化学药物干预能否进一步缩短造模时间,这些问题均需要更多的实验证据观察验证。另外,肝癌模型制备的重要用途之一是用于抗癌药物的研发,该模型是否可用于药物疗效评估,也有待于进一步探索。
总之,本实验显示连续饲养至(76.3 ± 4.2)周龄的C57BL/6.Mdr2-/-小鼠可自发形成肿瘤,其表型为肝细胞癌,该肿瘤模型的形成特征及应用前景需继续深入研究。
