川芎内生菌Pseudeurotium ovale代谢产物研究
2022-03-11郭文秀沈芋蓉李新爱郭大乐
郭文秀,巨 凤,沈芋蓉,谭 璐,李新爱,郭大乐,邓 赟
成都中医药大学药学院 西南特色中药资源国家重点实验室;中药材标准化教育部重点实验室,成都 611137
植物内生菌在与宿主互惠共生过程中也会产生很多具有药理活性的代谢产物[1]。川芎为伞形科植物川芎LigusticumchuanxiongHort.的干燥根茎。其味辛、微苦,性温。具有活血行气,祛风止痛的功效。目前有大量关于川芎的化学成分、药理活性等研究,但关于川芎内生菌的化学成分研究还较少。川芎中的内生菌种类繁多,Wang[2]等从川芎根茎中分离得到87株内生真菌;有学者对川芎内生菌Cladosporiumsp.[3]、Fusariumtricinctum[4]的代谢产物进行研究,从中分离得到一些结构新颖、活性良好的化合物。Pseudeurotium(假散囊菌属)属含有10个菌种,分别为P.bakeri、P.irregulare、P.jaipurense、P.desertorum、P.luteolum、P.ovale、P.punctatum、P.zonatum、P.macroglobosum、P.hygrophilum[5-8]。从1960年代末到21世纪初,一些学者对Pseudeurotium的代谢产物开展了一系列研究并从中分离得到卵磷脂[9],pseurotins A~E[10-12],细胞松弛素G、X、Y、Z[13]。课题组前期一直从事中药内生菌的化学成分研究,从川芎的根部获取一株P.ovale内生菌,本研究采用PDB培养基[14]对其进行大规模发酵,对其中的次生代谢产物进行分离纯化和结构鉴定,并检测抗炎活性,以期找到具有药理活性的化合物,丰富川芎内生菌的化学成分研究。
1 材料与方法
1.1 材料
Q Exactive UHMR复合四极杆-轨道阱质谱仪(美国赛默飞世尔公司),Bruker Bruker-Ascend-700-MHz核磁共振仪(德国布鲁克公司);NP7000型半制备高效液相色谱仪,NU3000型紫外检测器(中国江苏汉邦科技);HPLC柱(ChromCore PFP,10×250 mm,5 μm)(钠谱分析技术(苏州)有限公司)。大孔树脂D101(成都市科隆化学品有限公司),HP-20(日本三菱化学公司);MCI(75~150 μm,日本三菱化学公司);Sephadex LH-20(GE医疗生命科学中国);试剂为分析纯(成都市科隆化学品有限公司)
噻唑蓝(MTT)(德国Biofroxx);鬼臼毒素(中国食品药品检定研究院);小鼠巨噬细胞RAW 264.7细胞系(中国科学院上海生物科学研究院细胞资源中心);DMEM培养基,胎牛血清(美国Hyclone公司);青霉素,链霉素(北京索拉尔生物有限公司);小鼠IL-6 ELISA试剂盒(欣博盛生物科技有限公司,M200624-004a);NO检测试剂盒(南京建成生物工程研究所,A012-1-2);二甲基亚砜(DMSO)(法国MP Biomedicals)。
1.2 实验方法
1.2.1 菌种的获得及扩培
实验中使用的菌株从传统中药川芎(Ligusticumchuanxiong)的新鲜植株中分离得到,菌株在PDA平板上菌落为白色,呈同心圆生长,背面呈淡黄色,培养基菌丝周围有黑色球形的子囊壳;菌丝白色,子囊孢子球形,直径1.5~2.3 μm,光滑(如图1)。菌种(Pseudeurotiumovale)由生工生物工程(上海)股份有限公司鉴定完成(GenBank登录号DQ513513,序列号MH858209.1),现保存于成都中医药大学药学院生化制药实验室。

图1 Pseudeurotium ovale的形态特征Fig.1 Morphological characteristics of P.ovale注:A:菌落;B:菌丝;C:子囊孢子。Note:A:Colony;B:Mycelium;C:Ascospore
将获得的菌种P.ovale接种于PDB培养基中(500 mL锥形瓶,每瓶200 mL培养基)开展扩培,置于摇床中,以28 ℃、180 rpm培养14天,得到约30 L发酵液。
PDB培养基:马铃薯200 g/L,葡萄糖20 g/L。
1.2.2 提取和分离
发酵液用乙酸乙酯萃取3次并减压浓缩后获得浸膏(21.25 g),先用大孔树脂D101进行粗分,以甲醇-水(0∶100、30∶70、60∶40、90∶10)进行洗脱,获得4个部位(Fr.1~4)。再将Fr.4上HP-20树脂,以甲醇-水(60∶40→95∶5)进行洗脱分离得到14个组分(组分Frs.1~14)。将Frs.4经中压C18柱分离,以甲醇-水(60∶40→95∶5)为洗脱液洗脱,经半制备型HPLC进行纯化得到化合物1(以70%甲醇洗脱,tR13.437 min,3.47 mg);Frs.6经凝胶柱,以甲醇为洗脱液进行分离,得到化合物4(以80%甲醇洗脱,tR19.100 min,33.71 mg);Frs.7经中压MCI柱,以甲醇-水(40∶60→95∶5)进行分离,后经半制备型HPLC纯化后得到化合物2(以80%甲醇洗脱,tR18.413 min,4.05 mg)、3(以85%甲醇洗脱,tR14.040 min,0.52 mg)、5(以70%甲醇洗脱,tR14.930 min,0.99 mg)。
1.2.3 抗炎活性测定
通过MTT法测定化合物1对小鼠巨噬细胞(RAW 264.7)的细胞毒活性,阳性对照药物为鬼臼毒素,详细步骤参照Guo等[15]的方法。
抗炎活性测试,脂多糖(LPS)诱导的小鼠巨噬细胞RAW 264.7细胞炎症筛选模型用于测试化合物1的抗炎活性。Griess方法用于检测RAW 264.7细胞释放的NO量,通过测量亚硝酸盐的积累来测量NO的产生。在24孔板中接种RAW 264.7巨噬细胞(1×105个/mL),在培养箱中培养过夜,然后分别与浓度为7.5、15、30 μg/mL的化合物1和1 μg/mL脂多糖(LPS)培养24小时,将没有亚硝酸盐的细胞培养基用作空白对照,并以亚硝酸钠为标准溶液计算培养基中亚硝酸盐的浓度。同时,用ELISA法检测RAW 264.7细胞中IL-6和TNF-α的释放,并通过细胞因子分析检查化合物1对促炎细胞因子(IL-6和TNF-α)的抑制作用。使用小鼠酶联免疫吸附测定(ELISA)试剂盒测定用LPS(1 μg/mL)处理的RAW 264.7巨噬细胞上清液中促炎细胞因子的表达情况。
2 实验结果

图2 化合物1~5的结构Fig.2 The structure of compounds 1~5
2.1 结构鉴定
化合物1淡黄色无定形粉末;由HR-ESI-MS:m/z207.101 5 [M+H]+(calcd for C12H15O3,207.102 1)推测该化合物的分子式为C12H14O3。红外光谱显示该化合物有羰基和双键,1H NMR(700 MHz,CD3OD)和13C NMR(175 MHz,CD3OD)见表1。

表1 化合物1的NMR数据(CD3OD)Table 1 NMR spectroscopic data of compound 1 (CD3OD)
化合物1含有两个甲基(δH1.88、δC8.65;δH1.86、δC18.71),一个甲氧基(δH3.94,δC57.29),13C NMR数据δ:167.31、102.34、168.96、97.04、159.59表示化合物1与3-methyldes-methoxyyangonin[16]具有相似的氧化的芳香族结构。另外,在δ:121.43、137.02、131.90、137.61处的13C NMR数据表明它可能含有1,3-丁二烯片段。1H NMR数据表明,并且化学位移δ6.17(1H,d,J=15.4 Hz,H-1′)、7.06(1H,dd,J=15.3,10.9 Hz,H-2′)、6.27(1H,dd,J=15.0,10.9 Hz,H-3′)、6.11(1H,dq,J=14.0,6.9Hz,H-4′)表明存化合物1存在反式1,3丁二烯结构。
根据HMBC的结果(图3),δH3.94(H-8)与δC168.96(C-4)相关,表明甲氧基与C-4连接;δH1.88(H-7)与δC167.31(C-2)、δC102.34(C-3)、δC168.96(C-4)相关,故C-7与C-3连接;δH6.17(H-1′)与δC159.59(C-6),δC97.04(C-5)的HMBC相关表明C-1′和C-6相连。故化合物1的平面结构可归纳为4-methoxy-3-methyl-6-(1E,3E)-1,3-pentadien-1-yl-2H-pyran-2-one。
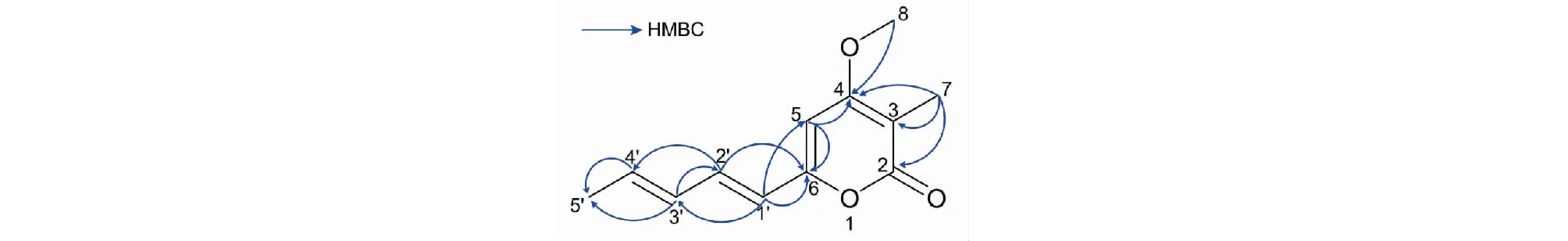
图3 化合物1的关键HMBC相关Fig.3 Key HMBC correlations of compound 1
化合物2淡黄色无定形粉末;1H NMR(700 MHz,CD3OD)δ:7.56(1H,s,H-4′),7.41(1H,dd,J=14.8,11.0 Hz,H-3),7.12(1H,d,J=14.8 Hz,H-2),6.45(1H,ddd,J=14.4,11.0,1.3 Hz,H-4),6.30(1H,dq,J=13.7,6.8 Hz,H-5),2.19(3H,s,H-7′),2.08(3H,s,H-8′),1.91(3H,dd,J=6.8,1.3 Hz,H-6);13C NMR(175 MHz,CD3OD)δ:193.91(C-1),163.64(C-6′),162.28(C-2′),145.33(C-3),141.66(C-5),131.98(C-4),130.04(C-4′),123.48(C-2),117.26(C-3′),113.94(C-1′),112.04(C-5′),18.91(C-6),16.36(C-7′),8.02(C-8′)。以上数据与文献[17]报道一致,故鉴定为(2E,4E)-1-(2,6-dihydroxy-3,5-dimethylphenyl)-2,4-hexadien-1-one。
化合物3淡黄色粉末;1H NMR(700 MHz,CD3OD)δ:7.47(1H,s,H-2′),5.51(2H,dq,J=4.9,2.1 Hz,H-4,5),2.97(2H,t,J=7.0 Hz,H-2),2.36(2H,m,H-3),2.17(3H,s,H-7′),2.06(3H,s,H-8′),1.64(3H,m,H-6);13C NMR(175 MHz,CD3OD)δ:205.98(C-1),162.52(C-5′),161.97(C-4′),131.04(C-4),130.43(C-2′),126.83(C-5),117.18(C-3′),113.39(C-6′),111.93(C-1′),38.71(C-2),29.01(C-3),18.05(C-6),16.35(C-7′),7.97(C-8′)。以上数据与文献[18]报道一致,故鉴定为2-deoxy-sohirnone C。
化合物4黄色无定形粉末;1H NMR(700 MHz,CD3OD)δ:7.29(1H,dd,J=14.8,11.0 Hz,H-3′),6.38(1H,dd,J=14.8,11.3 Hz,H-2′),6.32(1H,d,J=14.8 Hz,H-4′),6.22(1H,dq,J=13.8,6.8 Hz,H-5′),3.09(1H,s,H-1),1.90(3H,d,J=6.9 Hz,H-6′),1.39(3H,s,4-CH3),1.36(3H,s,2-CH3);13C NMR(175 MHz,CD3OD)δ:201.36(C-5),175.76(C-1′),144.10(C-3′),140.77(C-5′),132.23(C-4′),120.15(C-2′),105.74(C-3),104.55(C-6),80.29(C-2),60.93(C-4),58.59(C-1),21.81(4-CH3),19.80(2-CH3),18.91(C-6′)。以上数据与文献[19]报道一致,故鉴定为trichodimerol。
化合物5无色针状结晶;1H NMR(700 MHz,CD3OD)δ:6.70(2H,d,J=2.2 Hz,H-4,6),6.56(2H,dd,J=2.3,0.7 Hz,H-2,8),2.80(6H,s,1-CH3,9-CH3);13C NMR(175 MHz,CD3OD)δ:159.18(C-4a,5a),156.92(C-3,7),132.88(C-1,9),117.58(C-9a,9b),114.78(C-2,8),96.56(C-4,6),25.05(1-CH3,9-CH3)。以上数据与文献[20]报道一致,故鉴定为3,7-dihydroxy-1,9-dimethyldibenzofuran。
2.2 抗炎活性
化合物1在56.27 μg/mL浓度下对RAW 264.7无明显的抑制作用,对LPS诱导RAW 264.7细胞的NO、细胞炎性因子IL-6和TNF-α释放量的影响如图3所示。与模型LPS组相比,将化合物1和LPS与RAW 264.7细胞孵育后,NO、IL-6和TNF-α的表达显著降低(P<0.001),并且浓度在7.5~30 μg/mL之间存在剂量依赖关系。当化合物浓度为30 μg/mL时,NO、IL-6和TNF-α的表达水平最低。因此,化合物1对经LPS诱导的RAW 264.7巨噬细胞的NO和炎性因子都具有良好保护作用,即具有良好的抗炎活性。

图4 化合物1对LPS诱导的RAW 264.7细胞中NO、IL-6和TNF-α含量的影响Fig.4 Effect of compounds 1 on content of NO,IL-6 and TNF-α in LPS induced RAW 264.7 cells注:与空白组相比,###P<0.001;与LPS组相比,*P<0.05,***P<0.001。Note:Compared with control group,###P<0.001;Compared with LPS group,*P<0.05,***P<0.001.
3 讨论
本研究从川芎中分离得到一株内生菌P.ovale,并将其扩大发酵后的乙酸乙酯萃取部位经大孔树脂、中压C18、中压MCI、凝胶柱分离得到1个新的聚酮类化合物及4个已知的化合物。5个化合物均为首次从该属菌中分离得到。此次P.ovale发酵分离的代谢物种,由分析型高效液相显示其过了D101大孔树脂的60%(Fr.3)甲醇部位还有很多化合物,且多为同系物,但因发酵量不够未分离得到,由此猜测此菌还有很多未发现的化学成分,其中不乏具有结构新颖的化合物值得探索;又因化合物1具有较好的抗炎活性,据文献报道,化合物2也具有较强的抗炎活性[21],除以上活性外,化合物3显示出对MRSA有中等抗菌活性,MIC值为80 μg/mL[18];化合物4对P388和A-549细胞系具有细胞毒活性,并对肝癌细胞(CBRH-7919)具有显着的抑制作用[22],如果对P.ovale进行进一步的研究,有望从中得到更多具有良好药理活性的化合物。
