菊花菌核病病原菌鉴定、抗性筛选与防治
2022-03-11杨顺超蒋甲福陈素梅陈发棣管志勇房伟民
杨顺超 刘 晔 蒋甲福 陈素梅 陈发棣 管志勇 房伟民
(南京农业大学作物遗传与种质创新国家重点实验室/农业农村部景观设计重点实验室/ 南京农业大学园艺学院,江苏 南京 210095)
菊花(Chrysanthemummorifolium),多年生草本植物,原产于我国,与月季、香石竹和唐菖蒲并称四大切花,具有很高的观赏价值和经济价值[1]。随着菊花生产规模的扩大,优异种质资源筛选不足、育种技术滞后、病虫害现象增多等问题逐渐凸显,严重制约着菊花产业的发展[2]。
目前有研究报道,造成植物菌核病的病原菌为子囊菌亚门核盘属真菌[3]。该属真菌能造成多种植物病害,寄主广泛,在我国的寄主多达两百余种,其中以十字花科、菊科、豆科等植物为主,如大白菜菌核病[4]、大豆菌核病[5]、向日葵菌核病[6]及桑葚肥大性菌核病[7]等。2003年有研究报道菊花菌核病是由核盘菌引起[8]。2011年,在菊花上发现另一种疑似核盘菌引起的病害,经研究确定为齐整小核菌,也称罗尔夫式菌核菌,同样会引起菊花的茎叶浸水状腐烂或枯萎[9]。由核盘菌引起的菊花菌核病,常发生在季节交替的高湿环境下,其适应极强、传播范围广,能随着水流、空气、昆虫和人类衣物被带到各处,防控难度大,造成巨大的经济损失[10]。有植株受到感染后,若处理不当,病情会迅速扩展,同时病原菌会产生草酸等次生代谢产物,造成危害[11]。我国关于核盘菌引起菊花菌核病的报道相对较少,防治也以加强田间管理与使用广谱型杀菌剂为主,存在一定的局限性。
种质资源抗病性是植物育种工作的基础,对于推动新品种选育和种质资源创新具有重要意义[12]。此外,越来越多的新型杀菌剂被研究报道,相比传统杀菌剂效果更好、毒性更小、成本更低,如植物源类杀菌剂[13]、酰胺类杀菌剂[14]和吡咯类杀菌剂[15]。但是这些新型杀菌剂对菊花菌核病的应用浓度和防控效果均未知,与传统杀菌剂的差异也鲜有研究。因此,本研究通过病原菌的分离提取、形态学观察以及核糖体内转录间隔区(rDNA-Internal transcribed space, rDNA-ITS)测序等方法对该病害进行鉴定,并对病原菌的生物学特性进行初步观察,对33份菊花品种进行抗病性筛选,选取7种不同杀菌剂进行防治试验,以期为菊花病害诊断、防治和抗病机制等工作提供理论依据。
1 材料与方法
1.1 材料与试剂
供试病样及植株:发病植株(品种为神马)采集于南京农业大学湖熟基地菊花资源保存中心,分离获得菌株Cm-H。
培养基:马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA):马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL;查彼培养基(Czapek):MgSO4·7H2O 0.5 g、K2HPO441 g、KCl 0.5 g、NaNO30.5 g、FeSO4·7H2O 0.01 g、 蔗糖25 g、琼脂20 g、蒸馏水1 000 mL;基础培养基(minimal medium, MM):K2HPO41.74 g、KH2PO41.36 g、(NH4)2SO40.53 g、NaCl 0.15 g、 MgSO4·7H2O 0.49 g、CaCl2·2H2O 0.07 g、FeSO41.368 mg、葡萄糖1.8 g、琼脂20 g、蒸馏水100 mL;酵母浸出粉葡萄糖培养基(yeast extract peptone dextrose, YEPD):蛋白胨10 g、酵母粉3 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL;琼脂水培养基(agar water, AW):琼脂200 g、蒸馏水1 000 mL。
杀菌剂:75%百菌清粉剂,浙江利民化工有限公司;8%宁南霉素药剂,黑龙江德强生物有限公司;3%甲霜灵药剂,河北中保绿农有限公司;嘧菌酯药剂,先正达(中国)有限公司;42.4%氟酰胺药剂,德国巴斯夫欧洲公司;43%肟菌酯药剂,德国拜耳股份公司;10%苯醚甲环唑粉剂,先正达(中国)有限公司。
试剂:真菌DNA快速提取试剂盒由美国OMEGA BIOTEK公司提供;试验中使用的试剂药品等由南京寿德生物科技有限公司提供。
1.2 试验方法
1.2.1 病原菌分离 参照董汉松[16]的组织分离法略作修改。将保存的病株进行表面清理,除去杂质和泥土等,在超净工作台中,从菊花茎部病健交界处切取直径约5 mm小组织块,在75%乙醇溶液中浸泡30 s,再用10%的次氯酸钠溶液浸泡3 min,然后用灭菌水冲洗3次,用无菌滤纸吸干后接种到PDA培养基上,置于恒温培养箱中28℃恒温培养。长出菌落后,挑取菌落边缘少许菌丝转移至新的PDA培养基中,挑取单菌落进行菌株的纯化培养,得到纯化后的菌株放置于4℃冰箱作为菌种保存备用。
1.2.2 病原菌鉴定 形态学鉴定:将菌株培养在PDA培养基上,3~10 d后在光学显微镜下观察菌落的大小与形态特征,1个月后于体式显微镜下观察形成的菌核;将菌核在4℃低温保存2~3个月后取出放置于无菌脱脂棉或无菌细砂上,于25℃培养10~20 d,观察菌核萌发状态。
分子鉴定:培养7 d后,收集菌丝,按照真菌提取试剂盒提取病原菌DNA后,在PCR仪(艾本德中国有限公司,上海)中进行18S rDNA-ITS PCR序列扩增,引物序列为ITS1-F:5′-C TTGGTCATT T AGAGGAAGT AA-3′,ITS4: 5′-TCCTCCGC TT ATTGAT ATGC-3′[17]。PCR反应体系为50 μL:模板DNA 1 μL,引物ITS1-F/ITS4 [10 μmol·L-1,通用生物系统(安徽)有限公司]各2 μL, dNTP [10 mmol·L-1,通用生物系统(安徽)有限公司] 2 μL,10× Buffer [含Mg2+,通用生物系统(安徽)有限公司] 8 μL,Taq DNA polymerase [5 U·μL-1, 普洛麦格(北京)生物技术有限公司] 0.5 μL,ddH2O 34.5 μL。PCR程序为:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸5 min[18]。后经琼脂糖凝胶电泳,将回收产物送南京思普金生物科技有限公司测序。得到序列后在NCBI的Genbank中进行BLAST比对,从对比结果中选取相关菌株的序列,用MEGA7.0采用邻接法构建该菌株的系统发育树。得到序列后在NCBI中进行Blastn比对,从对比结果中选取相关菌株的序列,用MEGA7.0采用邻接法构建该菌株的系统发育树。
1.2.3 病原菌致病力测定 将分离的病原菌培养在马铃薯葡萄糖水培养基(potato dertrose agar, PPW)培养基中于25℃摇床摇菌5 d后,用1 mL移液枪吸取0.5 mL菌丝悬浮液于无菌培养皿中,用毛笔或镊子挑出培养皿中的菌丝,接种到供试菊花叶片上(接种叶片为从菊花顶端向下第4或第5片大小形态相一致的真叶),重复3次,每次3株,接种后套袋2 d,观察统计发病情况,PDW培养基作对照。
待植株发病后,观察发病症状,并重新提取发病植株的病原菌,进行分离纯化,鉴定方法同第一次。确定是否与最初分离到的病原菌一致,若一致,则表明该病原菌是该病害的致病菌;若不一致,再重复1~2次,仍不一致则确定不是同一种致病菌或致病菌分离错误。
1.2.4 病原菌生物学特性测定 不同培养基对该病原菌生长的影响:用直径5 mm打孔器取培养5 d的菌落边缘菌块,分别转接到PDA、MM、YEPD和Czapek培养基上,以AW培养基做对照,28℃培养3 d后,用十字交叉法测量菌落直径(以下菌落直径测量方法相同)。
不同温度对病原菌生长的影响:将菌块接种在PDA培养基上后,置于恒温培养箱中,调节培养箱的温度分别为5、15、20、25、30、35和40℃,培养3 d,测量菌落直径。
不同pH值对病原菌菌丝生长的影响:用1 mol·L-1HCl和1 mol·L-1NaOH将PDA培养基的pH值分别调成5、6、7、8、9和10共6个梯度,转接菌块培养,28℃培养3 d后,测量菌落直径。
不同氮源和碳源对菌丝生长的影响:用蔗糖、果糖或乳糖替换基础培养基中的葡萄糖,用氯化铵、硝酸钠、蛋白胨或甘氨酸替换基础培养基中的硫酸铵,以基础培养基作对照,28℃培养3 d后,测量菌落直径。
1.2.5 不同菊花材料抗性鉴定 活体接种:选取长势一致无病虫害的菊花材料进行试验。将培养好的菌丝悬浮液取出(菌丝悬浮液培养方法同致病力测定),吸取0.5 mL于干净的培养皿中,用毛笔或镊子等将菌丝聚集成团,置于叶片靠中间部位,避开主脉以防接触不均匀。将大小适中的自封袋套住菊花叶片置于恒温培养箱中培养(若恒温培养箱可以控制湿度在80%以上则无需套用自封袋),白天温度设置为25℃,夜间温度设置为22℃,光周期设置为16 h光照,8 h黑暗,相对湿度保持在70%~80%。
离体接种:准备干净的培养皿,其中铺平一层脱脂棉,再盖一层滤纸,加适量无菌水使培养皿处于湿润状态。取菊花相同部位叶片洗净放置于培养皿中。菌丝接种方法同上,接种后将培养皿放置于恒温培养中培养,培养箱条件设置同上。
病情统计方法:以叶片感染程度分为0~4级统计发病情况。病级:0级:叶片健康,无病症;1级:叶片病斑面积占比0~1/4;2级:叶片病斑面积占比1/4~1/2; 3级:叶片病斑面积占比1/2~3/4;4级:叶片病斑面积占比3/4~整片叶。病情指数(disease severity index, DSI)的计算公式如下:
DSI=[∑(病级×病级数值)/(接种苗数×最高病级数值)]×100%
(1)。
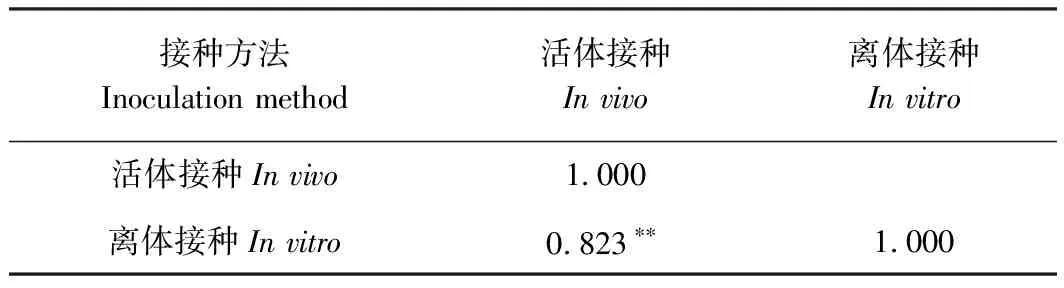
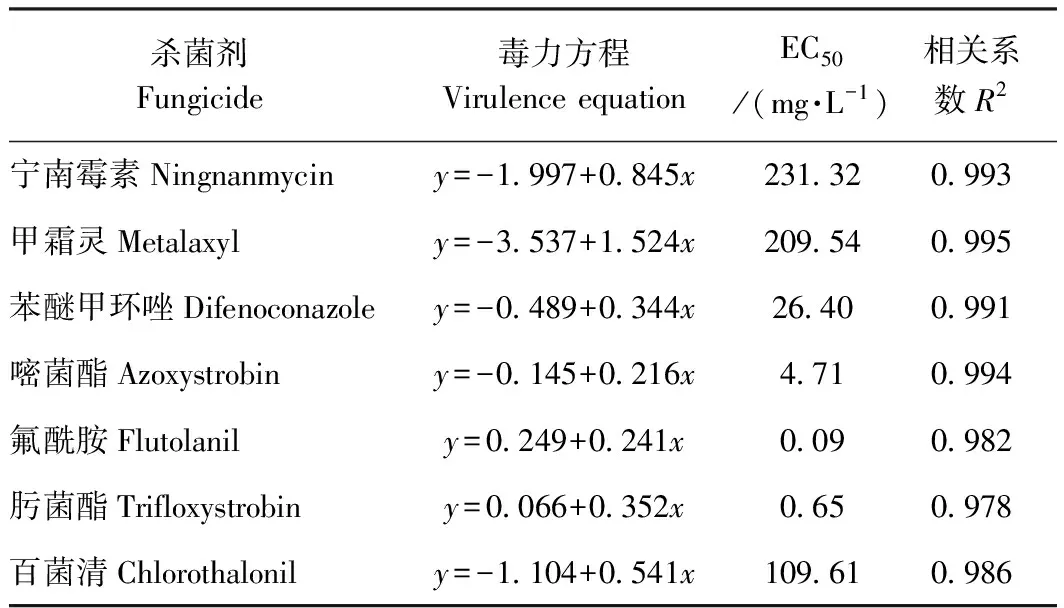
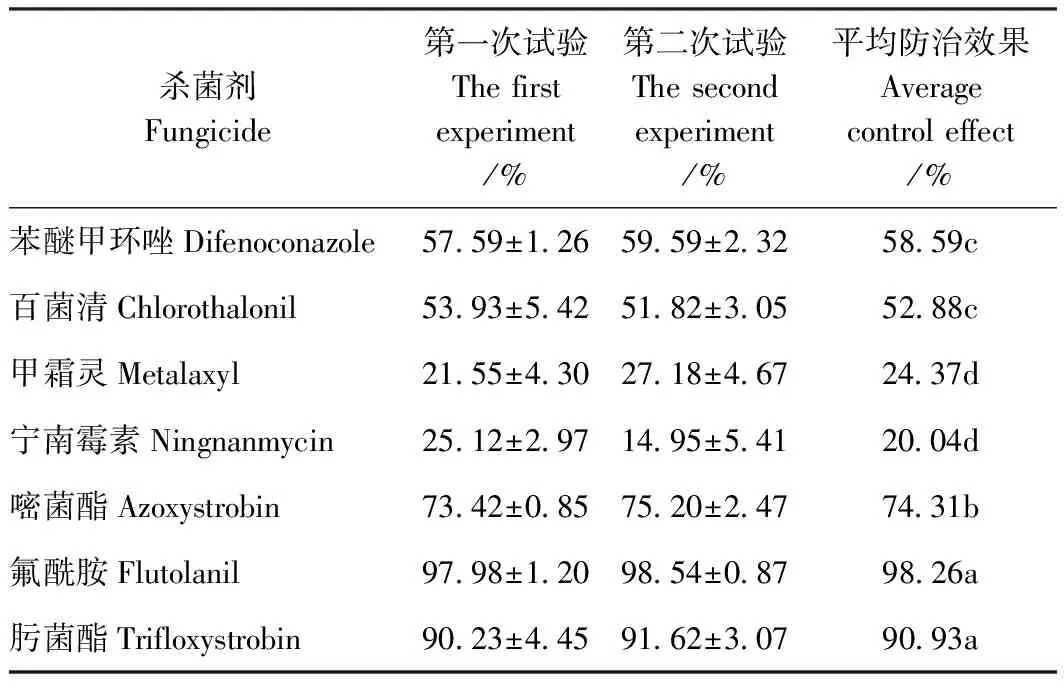
抗性水平:抗病(resistant R):DSI≤25%;中抗(moderately resistant MR):25% 1.2.6 不同杀菌剂毒力测定与病害防治 选取7个杀菌剂分别配置成5个浓度梯度的PDA培养基平板:1 000、500、250、125和50 mg·L-1,无菌水作为对照。用直径5 mm打孔器,取培养5 d病原菌菌块,转移到含杀菌剂的培养基上,25℃恒温培养箱培养,5 d后利用十字交叉法测定不同处理的菌落直径,每个处理3组,每组5个重复。 病原菌抑制率=(对照组平均菌落直径-处理组平均菌落直径)/对照组平均菌落直径×100% (2) 将得到的数据结果输入SPSS分析软件,利用Probit模型分析得到毒力方程,查表得到半数效应浓度EC50与相关系数R2值。 选用神马品种进行杀菌剂防治试验,采用活体接种,方法同上。在病害接种后24 h分别喷施7种杀菌剂,浓度为100 mg·L-1,每个处理3组,每组5株,利用十字交叉法统计病斑直径。按照公式计算病害防治效果: 病害防治效果=(对照组平均病斑直径-处理组平均病斑直径)/对照组平均病斑直径×100% (3) 1.2.7 数据分析 利用Excel 2010、MEGA 7.0和SPSS 20.0对试验数据进行处理,应用邓肯氏新复极差法进行差异显著性检验。 在田间自然条件下,菊花植株的根、茎、叶、花都有可能受到感染。菊花感染菌核病后,感染部位会出现水渍状病斑,在适宜的温湿度条件下,病斑迅速扩展,潮湿环境下则会出现白色霉层,病部软腐霉烂,菌丝聚集成团,逐渐变为灰白色,后期可形成鼠粪状黑色菌核,整株枯萎腐烂(图1)。菊花的整个生长期内都有可能发生菌核病,其中春秋季为发病高峰期,菊花栽培密度过大时极易出现成片感染。 将分离得到的菌株Cm-H进行回接,接种24 h后,叶片接种部位腐烂变褐,向外圈扩展,48~72 h后出现白色霉层聚集,叶片腐烂,病斑向其他部位扩展,与自然条件下的症状相同。未接种的叶片无明显症状。再次分离鉴定接种后的病株,得到的病原菌与原菌株Cm-H 相同(图2)。由科赫法则可以证明,分离得到的病原菌Cm-H可以侵染菊花造成病害,是菊花菌核病的致病菌。 注:a:茎感染症状;b:花感染症状;c:全株感染症状。Note:a: Symptoms of stem infection. b: Symptoms of flower infection. c: Symptoms of whole plant infection.图1 菊花菌核病症状Fig.1 Symptoms of chrysanthemum S. sclerotiorum 注:a:菊花接种菌核病病原菌后72 h症状;b:对照。Note:a: Symptoms of chrysanthemum inoculated with S. sclerotiorum pathogen for 72 hours. b: Control.图2 菊花菌核病致病性测定Fig.2 Determination of pathogenicity of chrysanthemum S. sclerotiorum 注:a:菌落反面形态;b:菌落正面形态;c:孢子;d:孢子梗;e:菌核;f:菌核萌发。Note:a: Colony morphology aTThe contrary side. b: Colony morphology aTThe positive side. c: Spore. d: Sporophore. e: Sclerotium. f: Sclerotium germination.图3 菊花菌核病病原菌的形态特征Fig.3 The morphological characteristics of the pathogen of chrysanthemum S. sclerotiorum 由菊花病株分离得到菌株Cm-H,在PDA培养基上25℃培养后,菌落呈圆形扩展,生长迅速。初期菌落呈现白色,中心区域较稀疏,边缘较密集,3~5 d后菌丝开始变成灰白色,7 d后菌落变成灰褐色,中间和边缘出现菌丝聚集,15~20 d后形成大小不一的黑色菌核。菌丝体宽3~8 μm,近无色透明,交错生长。菌核褐色或黑色,直径(0.5~1.0)×(4.0~5.0) cm,萌发时长出多个子囊盘,最长可至5~7 cm;孢子(5~8)×(2~4) μm,椭圆形或近圆形(图3)。根据该病原菌的形态学特征初步将其鉴定为核盘菌(Sclerotiniasclerotiorum)。 对分离得到的病原菌Cm-H进行DNA提取后,采用18S rDNA ITS PCR进行扩增,扩增产物经过琼脂糖凝胶电泳检测,得到一条550 bp左右的清晰亮带(图4-a)。将得到的序列结果与NCBI中的核酸序列进行Blastn比对分析,构建系统发育树。结果显示,该病原菌序列与核盘菌WB15(MH201315.1)的同源性达到了98%(图4-b)。结合病原菌的形态特征、病害症状、ITS序列比对分析和系统发育树,最终将该病原菌鉴定为子囊菌亚门核盘菌属核盘菌(Sclerotiniasclerotiorum)。 菌株Cm-H在供试的5种培养基上均可生长,但差异显著(图5-A)。在完全培养基YEPD上菌株生长最快,菌落直径79.33 mm;半完全培养基PDA次之,菌落直径达到63.50 mm;菌株在基础培养基MM上与对照相比差异不显著;Czapek上菌株生长最慢,为6.50 mm。由此表明,YEPD培养基和PDA培养基更适合菌株Cm-H的生长。 注:a:ITS目的基因片段PCR检测结果;M:Maker 2000;1:病原菌H;2:病原菌H的重复; b:基于18S rDNA-ITS PCR序列构建的系统发育树。Note:a: PCR detection results of ITS targeTGene. M: Maker 2000. 1: Pathogen H. 2: Duplication of pathogen H. b: Phylogenetic tree based on 18S rDNA-ITS PCR sequences.图4 菊花菌核病病原菌分子鉴定Fig.4 Molecular identification of the pathogen of Chrysanthemum S. sclerotiorum 菌株Cm-H在5~40℃之间均可生长(图5-B)。在20~30℃下生长较快,菌落直径达到53.80~59.15 mm;15和35℃时生长减缓,分别为34.50和22.70 mm;5和40℃时菌落生受到显著抑制,菌落直径6.21和4.35 mm,但无致死作用。表明菌株Cm-H的最适生长温度范围为20~30℃,温度过高或过低都会抑制该病原菌的生长。 注:不同小写字母表示在P<0.05水平上有显着性差异。Note: Different lowercase letters indicate the significant difference at 0.05 level, respectively.图5 培养基(A)、温度(B)、pH(C)、碳源(D)和氮源(E)对核盘菌菌落生长的影响Fig.5 Effect of medium(A), temperature(B), pH(C), carbon source(D) and nitrogen source(E) on colony growth of S. sclerotiorum 在值pH 5~10的范围内,菌株Cm-H都能生长(图5-C)。在pH值5~7时,菌落直径无显著差异,菌落直径为47.50~48.17 mm;pH值小于4时培养基不凝固,无法测量;pH值为8~10时,菌丝生长受到抑制,菌落直径最低,为30.12 mm,显著低于pH 5.0~7.0。表明菌株Cm-H适宜在中性及偏酸性环境条件下生长,pH过高会显著抑制菌丝的生长。 菌株Cm-H在供试5种不同碳源培养基中均可生长,且生长差异不显著(图5-D)。生长最快的是以果糖为碳源的培养基,菌落直径达24.13 mm;生长最慢的以葡萄糖为碳源的MM基础培养基,菌落直径达到20.50 mm。表明该菌株生长对碳源的要求不严格。 菌株Cm-H在供试5种不同氮源培养基中亦可以正常生长(图5-E)。以蛋白胨为氮源时生长最好,菌落直径达到19.70 mm;甘氨酸为氮源时生长最差,菌落直径为16.00 mm,表明该菌株在以有机氮为主的蛋白胨培养基下较适宜生长。 选取33个切花菊品种分别进行活体与离体的接种试验,用以对比离体条件下进行品种的大量抗性筛选时的稳定性。结果发现,筛选的33个切花菊品种中,有6个品种(占比18.18%)表现为中抗,病情指数从小到大排名前三位的是南农金鹂、南农芝士和南农锦衣,病情指数分别为26.86、27.93和43.96;13个切花菊品种(占比39.39%)为中感,其中病情指数最高的为南农雾松,最低的为南农冰洁,病情指数分别为73.74和50.59;14个切花菊品种表现为感病(占比42.43%),病情指数最高的3个品种为南农粉莺、南农红雀和南农思绿,病情指数分别为86.48、90.20和90.68(表1)。此外,利用SPSS分析离体与活体接种 表1 33个切花菊品种活体与离体抗性筛选结果Table 1 Results of disease resistance screening of 33 cuTChrysanthemum in vitro and vivo 图6 3种不同抗性切花菊品种的离体与活体接种症状Fig.6 Inoculation symptoms of three different resistanTCuTChrysanthemum in vivo and vitro 表2 离体与活体接种相关性分析Table 2 Correlation analysis of inoculation in vitro and in vivo 试验的相关性达到了0.823,在0.01水平(双侧)差异性显著(表2),说明在需要进行大量品种的抗病性筛选时,可以通过离体接种代替活体接种以减少工作时间和工作量。 通过设置不同浓度的杀菌剂进行核盘菌的抑制试验,分析得到每种杀菌剂的毒力方程和EC50,EC50越小表明其毒力越大(表3)。研究结果发现,氟酰胺和肟菌酯的抑制效果最好,EC50分别为0.09 mg·L-1和0.65 mg·L-1;嘧菌酯和苯醚甲环唑次之,EC50分别为4.71 mg·L-1和26.40 mg·L-1;然后是百菌清,EC50为109.61 mg·L-1;宁南霉素和甲霜灵的效果最差,EC50分别为231.32 mg·L-1和209.54 mg·L-1。由此可见氟酰胺和肟菌酯的抑菌效果远好于其他杀菌剂。 在接种核盘菌24 h后喷施7种杀菌剂,分别进行2次生物学重复。由表4可知,氟酰胺和肟菌酯的效果最好,均显著高于其他杀菌剂,平均防治效果分别达到98.26%和90.93%;嘧菌酯次之,防治效果达到74.31%;然后是苯醚甲环唑和百菌清,防治效果分别达到58.59%和52.88%,显著高于甲霜灵和宁南霉素;甲霜灵和宁南霉素的效果最差,仅有24.37%和20.04%,显著低于其他处理。由此可见,在菊花活体植株的核盘菌接种后防治上,氟酰胺和肟菌酯依然具有良好的效果,与核盘菌的抑制试验和毒力方程表现出一致性,为氟酰胺和肟菌酯用于菊花菌核病的防治奠定了理论基础。 表3 七种杀菌剂的毒力测定Table 3 Toxicity determination of seven fungicides 表4 7种杀菌剂对菊花菌核病的防治效果Table 4 Control effect of seven fungicides on chrysanthemum S. sclerotiorum 图7 7种杀菌剂的防控效果对比Fig.7 Comparison of control effect of seven fungicides 菌核病寄主广泛,致病菌种类较多[19]。包立军等[20]研究发现桑椹菌核病,除了核盘菌外,桑实杯盘菌等核盘菌属真菌也能导致菌核病。确定菊花菌核病的致病病原菌是开展抗性鉴定等后续研究工作的关键。核盘菌以接触、气流和水流传播为主,以菌核形态在植株残体和土壤中越冬,在发生期为10月至次年5月并处于高湿条件下的病情更为严重,具有极大的隐匿性和感染性[21-22]。有研究发现核盘菌致病时会产生草酸,形成酸性环境并对植株产生毒害作用[23-24],与本研究发现核盘菌适宜在偏酸性条件下生长相一致。但是目前国内有关菊花菌核病的研究还相对较少,致病机理等尚需进一步明确。 形态学鉴定是鉴定病原菌最基础也是最直观的方法[25],但易受外界环境的干扰而导致结果不可信,因此多种鉴定方法结合更为准确[26]。随着分子生物学技术应用于真菌鉴定,有研究表明rDNA-ITS序列在不同真菌的种间虽然存在丰富的变异性,但是种内不同菌株间却相对高度保守[27]。真菌rDNA-ITS序列包含18S rDNA、转录间隔区1(介于18S与5.8S之间)、5.8S rDNA、转录间隔区2(介于5.8S与28S之间)和28S rDNA,此类序列片段的长度适中,进化速率比较快(高等真菌一般小于1 000 bp),可以被用于鉴定真菌种类[28]。分子生物学可以为研究真菌的系统发育和分类提供有效的技术支持。本研究运用形态学和分子生物学特性,再结合DNA序列分析技术对核盘菌进行鉴定,鉴定结果更加准确。抗病性筛选鉴定是植物育种与资源评价工作的重要环节。同一时间、同一条件下批量进行品种资源的抗性筛选,得到的结果更具有可比性和实际意义。为此,需要建立可靠的抗性鉴定方法,进行菊花材料的抗病性筛选。目前对于抗性鉴定的研究报道较多,如冉毅等[29]运用花期牙签茎杆接种法筛选出12份油菜菌核病的高抗材料,何烈干等[30]通过改进该方法又筛选出2份高抗材料。本研究通过离体与活体对比试验进行抗性鉴定,结果更加可靠。同时本试验发现离体接种周期更短,操作更简易,有助于进行大批量抗性筛选鉴定。不同科属植物的基因不同,生理生化特性不同,对菌核病的抗性也不同,导致高抗品种的筛选存在不确定性,但依然可以通过鉴定筛选结果对品种材料的抗性作出初步评价。高崇等[31]对延边烟草菌核病的抗性鉴定结果为:材料以感病品种为主,未筛选到高抗品种。同样,本研究在筛选的33份材料中没有发现高抗品种,中抗品种的占比只有18.18%,可以看出切花菊对菌核病的抗性相对较弱,但也存在筛选群体不足的原因,因此抗性鉴定与抗病品种选育工作仍需进一步拓展。 生物科技的发展和致病机理的研究使得新型杀菌剂的发明越来越多,氟酰胺和肟菌酯就是其中的两种高效低毒杀菌剂。氟酰胺属于琥珀酸脱氢酶抑制剂类杀菌剂,肟菌酯属于甲氧基酸酯类杀菌剂,具有良好的内吸性[32-33]。黄文枫等[34]研究发现氟酰胺的辣椒白斑病防控效果达到75.01%,而苯醚甲环唑的防效仅有27.51%,张伟等[35]研究发现肟菌酯在小麦白粉病的防治中防效达到70%以上。此外,杨明方等[36]研究发现戊唑醇与吡唑醚菌酯混合悬浮剂对桑椹菌核病的防治效果最好,校正防效可达100%。张海洋等[37]通过室内毒力测定和田间试验研究发现,50%啶酰菌胺对向日葵的防治效果最好,达89.68%。但是目前对于新型杀菌剂用于菊花菌核病的防治研究相对较少。本研究通过不同杀菌剂在菊花上的对比试验发现,供试杀菌剂中氟酰胺和肟菌酯的防治效果最好,均能有效抑制病原菌达到90%以上,而传统广谱性杀菌剂的防效仅有52.88%。氟酰胺和肟菌酯防治菊花菌核病的效果显著优于传统杀菌剂,可为菊花生产提供有效保障,也为菌核病的致病和抗病机理研究提供理论依据。 本研究从菊花发病植株中分离出菌核病病原菌并鉴定为核盘菌,发现其具有生长温度范围广、酸碱性适应强的特性,并在此基础上通过人工接种对33个切花菊品种进行了抗性鉴定和防治药剂筛选。筛选得到了6份中抗品种、13份中感品种和14份感病品种,鉴定结果表现出多层次的抗性差异。此外,本研究还发现氟酰胺和肟菌酯两种疗效达90%的杀菌剂,可作为现用传统农药的替代品,用于菊花种植生产中。2 结果与分析
2.1 菊花菌核病田间病害特征
2.2 菊花菌核病病原菌的致病力测定


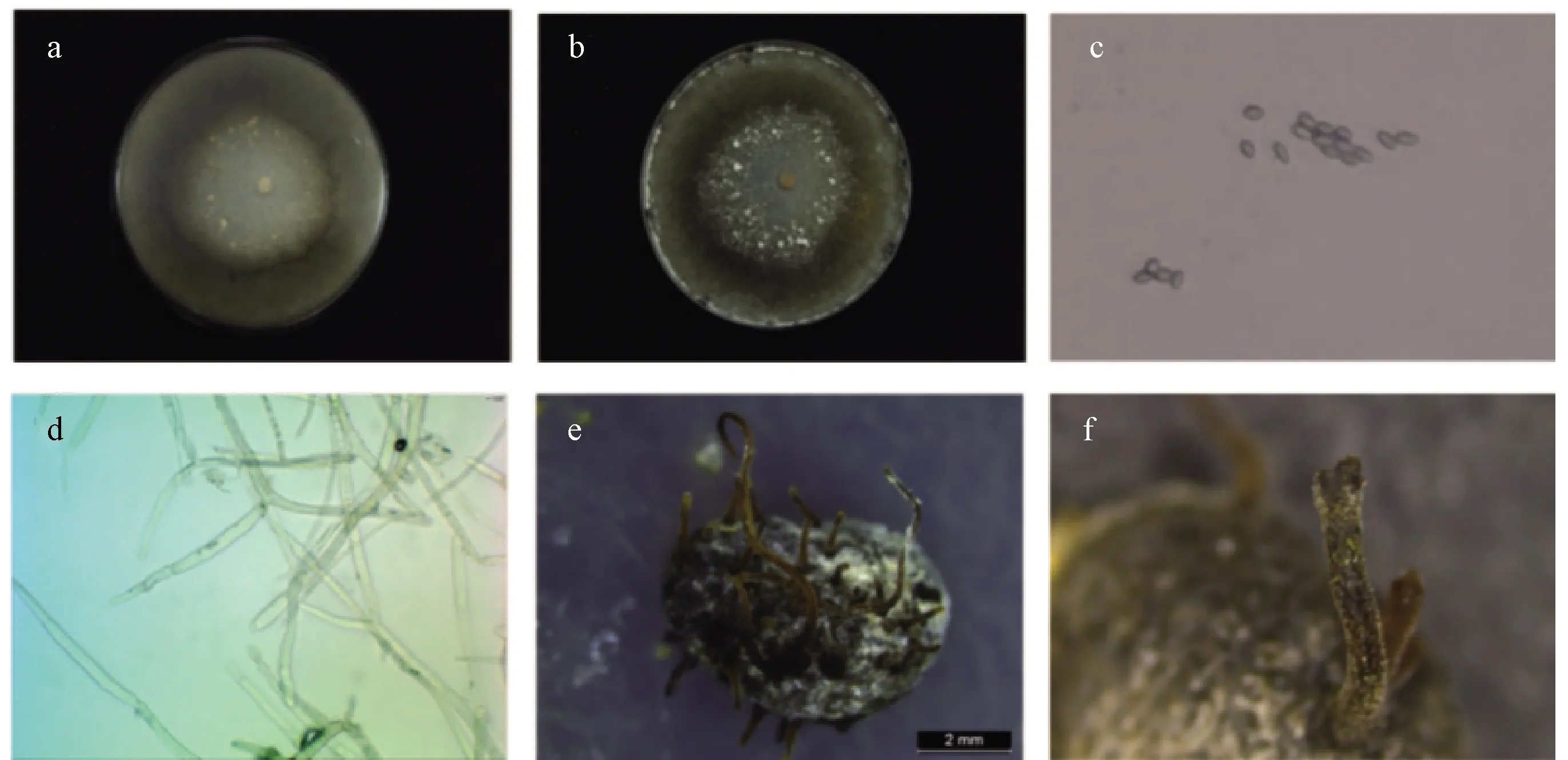
2.3 菊花菌核病病原菌形态学特征
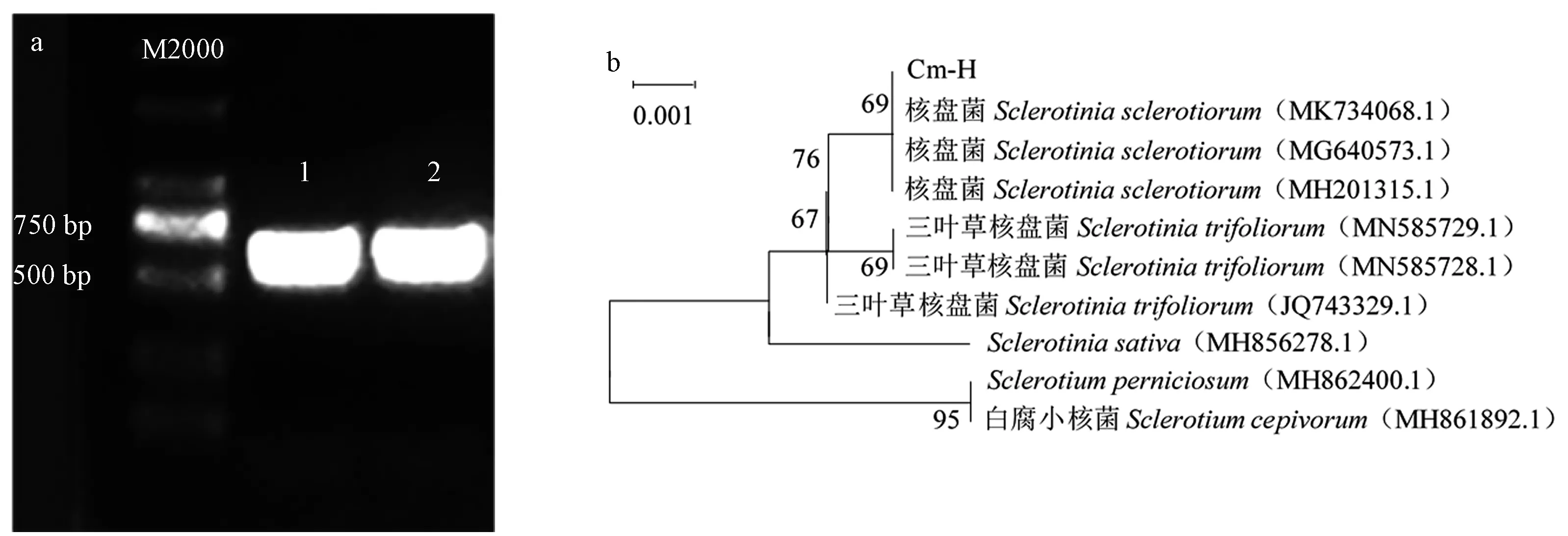
2.4 菊花菌核病分子学鉴定
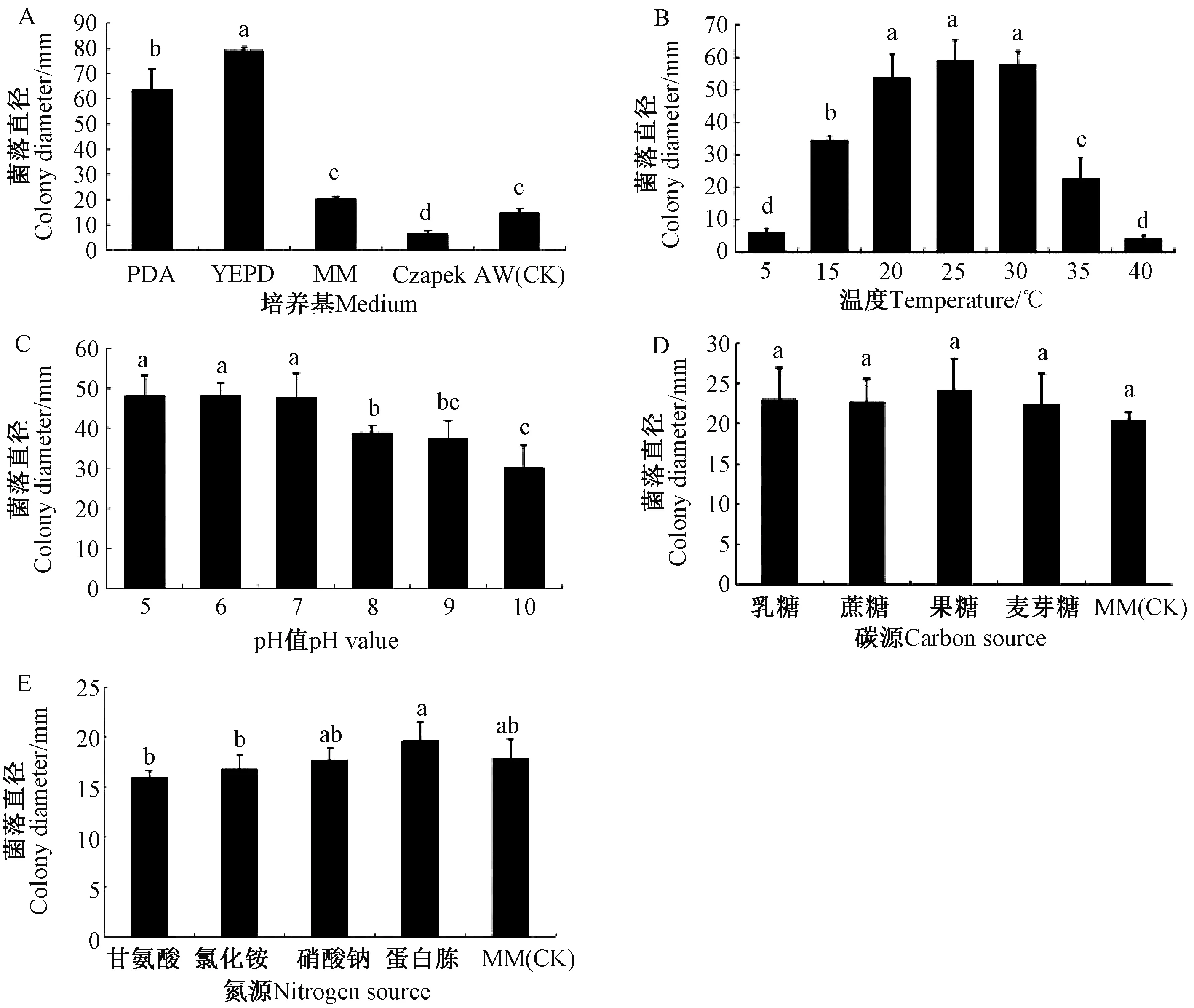
2.5 菊花菌核病病原菌的生物学特性
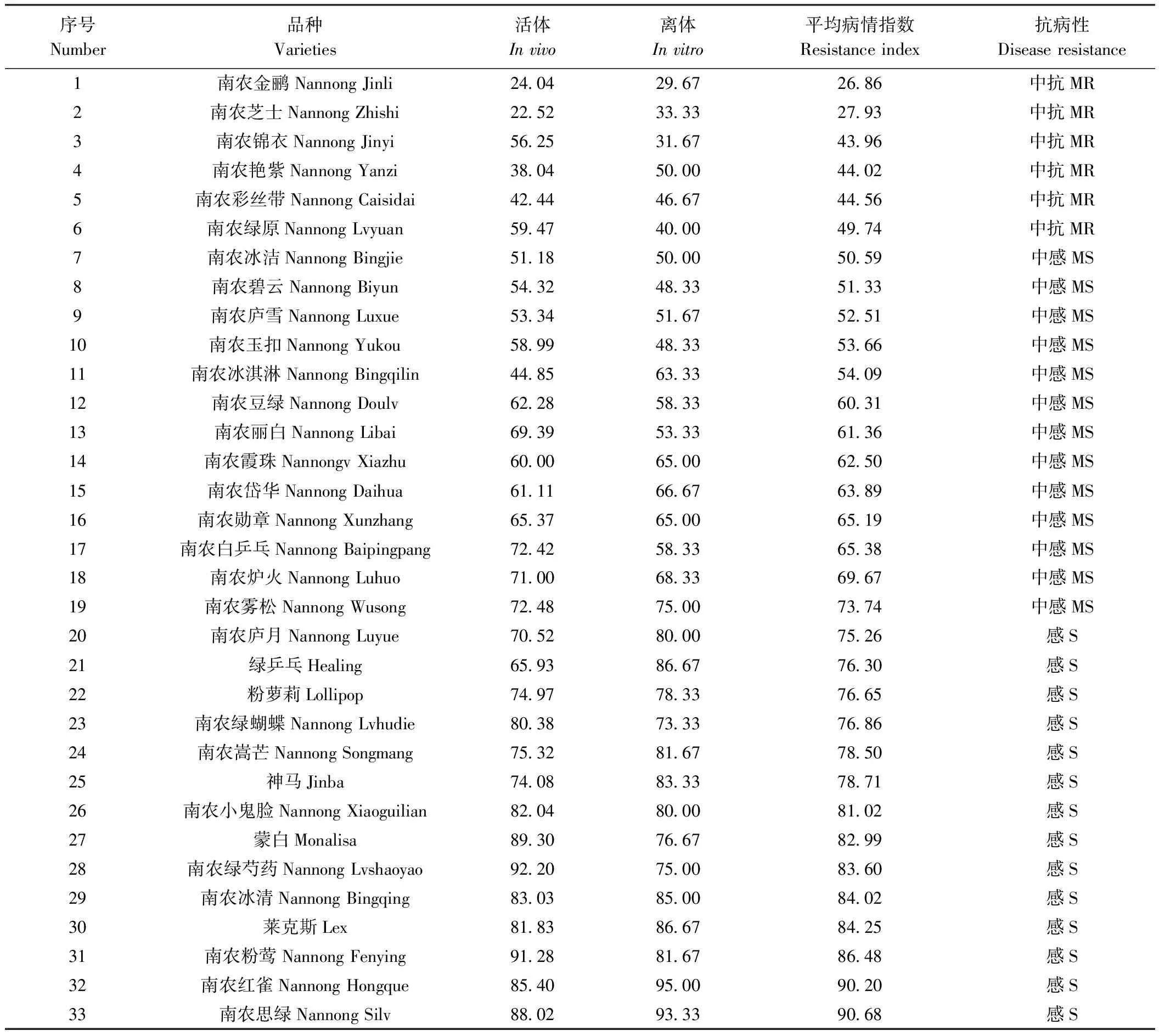
2.6 33份菊花材料的抗性筛选

2.7 不同杀菌剂对核盘菌的毒力测定
2.8 不同杀菌剂对菊花菌核病的防治效果

3 讨论
4 结论
