甘草毛状根总黄酮提取条件优化及3种甘草毛状根提取液成分和活性比较
2022-03-11曲红盼郝晴韩雅蕾刘蕾成志伟
曲红盼 郝晴 韩雅蕾 刘蕾 成志伟
摘要:以乌拉尔甘草毛状根为材料、总黄酮含量為指标,采用超声法提取,分别以提取溶剂、料液比、超声温度、超声时间为单因素,确定影响提取率的因素与水平,通过正交法优化,确定提取工艺的最佳条件。采用比色法测定比较3种甘草毛状根中总黄酮的含量,通过高效液相色谱法分析比较3种甘草毛状根中甘草苷、异甘草苷和光甘草定的含量。通过红细胞溶血和鸡胚绒毛尿囊膜试验、DPPH自由基与ABTS自由基清除试验和酪氨酸酶酶活抑制试验,分别比较3种甘草(乌拉尔甘草、光果甘草和胀果甘草)毛状根提取液的刺激性、体外抗氧化和抑制酪氨酸酶酶活的能力。结果表明,在溶剂为75%丙二醇、料液比1 g ∶15 mL、超声温度50 ℃、超声时间40 min条件下,乌拉尔甘草毛状根总黄酮提取率最高,为1.25%。在3种甘草毛状根中,乌拉尔甘草毛状根中异甘草苷的含量最高,光果甘草毛状根中总黄酮、甘草苷和光甘草定的含量均最高;3种甘草毛状根提取液(浓度≤625 mg/L)对红细胞及鸡胚绒毛尿囊膜均无刺激性;3种甘草毛状根提取液清除DPPH自由基的半抑制浓度(IC50)依次为1 100、570、540 mg/L,清除ABTS自由基的IC50依次为740、230、590 mg/L;3种甘草毛状根提取液(浓度为625 mg/L)对酪氨酸酶活性抑制率依次为(49.5±2.3)%、(76.6±3.5)%、(17.95±4.5)%。在3种甘草毛状根中提取液光果甘草的抗氧化及美白护肤活性最好。
关键词:甘草;毛状根;总黄酮;刺激性;抗氧化;酪氨酸酶
中图分类号:R284 文献标志码: A
文章编号:1002-1302(2022)04-0155-08
收稿日期:2021-10-07
基金项目:北京市教育委员会科技面上项目(编号:SQKM201710011010)。
作者简介:曲红盼(1994—),女,河北武邑人,硕士研究生,主要从事甘草中次生代谢物的合成机制研究。E-mail:13146918700@163.com。
通信作者:成志伟,博士,副教授,主要从事植物次生代谢物的合成机制研究。E-mail:chengzhiwei@btbu.edu.cn。
甘草是豆科甘草属多年生草本植物,收录于2020年版《中国药典》(简称《药典》)的有3个品种:乌拉尔甘草、光果甘草和胀果甘草[1]。甘草中的活性成分主要有黄酮类、三萜类及多酚类等化合物[2],它们被广泛应用在工业产品中。在医药领域,甘草苷具有抗抑郁和降血糖等作用[3],异甘草苷具有促进血管生成的作用[4],光甘草定具有抗肿瘤转移的作用[5]等;在烟草行业中,甘草根提取液可改善烟草的吸味与口感[6-7];在日化领域,甘草提取液及其化合物(光甘草定、甘草酸二钾和甘草亭酸等)[8]具有抑制酪氨酸酶活性[9]、抗菌[10]、抗炎[11]和抗氧化[11]等功效。随着工业(医药、食品和日化)生产对甘草原料需求的增长,野生甘草的过度采挖及其生长环境的恶化,导致野生甘草资源日渐枯竭,已被列为国家Ⅱ级濒危珍稀物种(http://www.iplant.cn/rep/protlist)。通过发根农杆菌诱导甘草产生毛状根[12]是一种解决工业生产对甘草资源需求的有效途径。
目前,对甘草毛状根的研究主要集中在比较其与甘草药材[13-15]中次生代谢物[12,16-17]含量差异等。但是,系统性地比较3种不同品种甘草(乌拉尔甘草、光果甘草和胀果甘草)毛状根的成分差异,以及甘草毛状根提取液对皮肤的潜在护肤活性还未见报道。因此,本研究采用单因素和正交试验对超声法提取甘草毛状根中总黄酮条件进行优化,比较3种甘草毛状根提取液中总黄酮及黄酮类化合物(甘草苷、异甘草苷和光甘草定)的含量差异,并对甘草毛状根提取液的刺激性、抗氧化和抑制酪氨酶酶活能力进行比较,以期为甘草毛状根将来作为原料在工业产品中的运用提供理论支持。
1 材料与方法
1.1 主要材料、试剂与仪器
甘草毛状根材料由笔者所在实验室诱导构建,材料的诱导和品种背景鉴定参考Khazaei等的方法[18-19]。液态条件下培养收获的甘草毛状根材料经真空冷冻干燥后,研磨成粉,100目过筛备用。
乌拉尔甘草与光果甘草药材购置于河北省安国中药材专业市场,甘草品种背景鉴定参考杨瑞等的方法[19],甘草药材研磨成粉,100目过筛备用。
甘草苷、异甘草苷、光甘草定,色谱纯,上海源叶生物科技有限公司;乙腈,色谱纯,天津市永大化学试剂有限公司生产;芸香苷、2,2-二(4-叔辛基苯基)-1-苦肼基自由基(DPPH自由基)、维生素C,梯希爱(上海)化成工业发展有限公司生产;亚硝酸钠、硝酸铝、无水乙醇、氯化钠、氢氧化钠,分析纯,北京化工厂生产;丙二醇、过硫酸钾,分析纯,上海麦克林生化科技有限公司;奎诺二甲基丙烯酸酯(trolox)、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、磷酸氢二钠、磷酸二氢钠、酪氨酸酶、L-酪氨酸,分析纯,上海阿拉丁生化科技股份有限公司生产。
U3000高效液相色谱,赛默飞世尔科技(中国)有限公司生产;Infinite M200 Pro多功能酶标仪,瑞士Tecan公司;CK2000高通量组织研磨仪,北京托摩根生物科技有限公司生产;LGJ-18型真空冷冻干燥机,北京松源华兴科技发展有限公司生产;KQ5200DE型数控超声波清洗器,昆山市超声波仪器有限公司生产;QB-206 多用途旋转摇床,其林贝尔仪器制造有限公司生产;Centrifuge 5424R冷冻离心机,德国Eppendorf生产。
1.2 试验方法
2020年5月至2021年9月,于北京工商大学北京市植物资源研究开发重点实验室开展相关试验。
1.2.1 超声法提取率的影响因素及其水平的确定
取1 g乌拉尔甘草毛状根粉末,在不同提取溶剂、料液比、超声温度和超声时间下进行提取,10 000 g离心10 min,取上清溶液用于总黄酮提取率的测定。根据上述单因素试验结果,用正交试验对其工艺参数进行进一步优化,以明确该提取方法的最佳技术参数。
1.2.2 成分测定
1.2.2.1 总黄酮含量的测定 采用Al(NO3)3-NaNO2法[20]测定甘草毛状根总黄酮含量。精确量取0、25、50、100、150、200 μL芸香苷标准溶液(1 mg/mL)于2 mL 离心管,加入5% NaNO2溶液 50 μL,混匀后静置6 min;加入10% Al(NO3)3溶液 50 μL,混匀后静置6 min;加入5% NaOH溶液 500 μL,混匀后静置15 min;反应体系终体积用75%乙醇溶液定容至1 mL。在510 nm波长下测定溶液的吸光度值。以吸光度值为纵坐标,芸香苷质量浓度为横坐标绘制标准曲线。
取3种甘草毛状根提取液,按照上述步骤操作,在510 nm波长下测定溶液的吸光度。根据标准曲线(回归方程为:y=0.007 6x+0.037 3,r2=0.998 9,表明线性关系良好,线性范围25~200 mg/L)分别计算出3种甘草毛状根提取液中的总黄酮含量。
1.2.2.2 甘草苷、异甘草苷和光甘草定含量的测定 甘草苷、异甘草苷和光甘草定的HPLC检测条件参考周逸芝等的方法[21]。色谱柱:Thermo Hypersil-Keystone C18(250 mm×4.6 mm,5 μm);流动相为乙腈(M)-0.05%磷酸溶液(N),流动相比例0~15 min,20%~25% M;15~30 min,25%~40% M;30~40 min,40%~60% M;40~41 min,65%~95% M;检测波长为276 nm,流速1.0 mL/min,柱温30 ℃。根据标准曲线(甘草苷回归方程为:y=1.914 4x+4.932 9,r2=0.999 8,表明线性关系良好,线性范围 2~20 mg/L;异甘草苷回归方程为:y=1.004 9x-0.140 4,r2=0.999 7,表明线性关系良好,线性范围1~12 mg/L;光甘草定回归方程为:y=0.351 5x-0.137 5,r2=0.998 7,表明线性关系良好,线性范围3~50 mg/L;)分别计算出3种甘草毛状根提取液中的甘草苷、异甘草苷和光甘草定含量。
1.2.3 刺激性评价
1.2.3.1 红细胞溶血试验 红细胞(RBC)溶血试验可替代德莱塞测试(Draize test)眼刺激性试验,用于检测化妆品原料的眼刺激性[22]。检测RBC的完整性样品a1:用PBS(pH值=7.4)配制系列梯度的SDS溶液(0~80 mg/L);检测对RBC刺激性的样品a2:用PBS(pH值=7.4)将待测样品(75%丙二醇和甘草毛状根提取液)稀释系列浓度;阳性对照样品b:蒸馏水(溶血率100%);阴性对照样品c:PBS(溶血率为0)。取上述样品溶液750 μL和质量分数为2%的红细胞悬液250 μL混匀,150 r/min摇床孵育1 h。在波长540 nm下测定溶液吸光度Da1、Da2、Db和Dc,红细胞溶血率计算公式如下[23]:
溶血率=(Dai-Db)/(Db-Dc)×100%(i=)。(1)
1.2.3.2 鸡胚绒毛尿囊膜试验 参考行业标准SNT 2329—2009《化妆品眼刺激性 腐蚀性的鸡胚绒毛尿囊膜试验》[24],采用反应时间法进行试验:随机选取5枚鸡胚,依次将300 μL的3种甘草毛状根提取液、0.9%氯化钠溶液(阴性对照)和0.1 mol/L氢氧化钠溶液(阳性对照)滴加到鸡胚绒毛尿囊膜表面,反应5 min,评估样品刺激性。评分标准采用刺激评分(IS)法:sH(出血时间)即尿囊膜上观察到开始发生出血的时间,s;sL(血管融解时间)即尿囊膜上观察到开始发生血管融解的时间,s;sC(凝血时间)即尿囊膜上观察到开始发生凝血的时间,s。刺激评分公式如下:
IS=[(301-sH)×5+(301-sL)×7+(301-sC)×9]/300。(2)
1.2.4 抗氧化能力评价
1.2.4.1 DPPH自由基清除能力测试 样品组A1:取500 μL甘草毛状根提取液与500 μL DPPH无水乙醇溶液(2×10-4 mol/L)混合均匀;阴性对照A2:取500 μL的75%丙二醇与DPPH溶液混合均匀;样品对照A3:取500 μL甘草毛状根提取液与无水乙醇混合均匀。A1、A2和A3室温避光反应30 min,在517 nm波长下测定溶液的吸光度D1、D2和D3[25]。对DPPH自由基的清除率的计算公式如下:
清除率=(D2+D3-D1)/A2 ×100%。(3)
1.2.4.2 ABTS自由基清除能力测试 量取ABTS儲备液(7.4 mmol/L)与K2S2O8储备液(2.6 mmol/L)各3 mL,混合,避光静置12 h,作为母液备用。用无水乙醇将母液稀释,使其在波长734 nm下的吸光度值在0.7±0.02范围内,即为ABTS自由基工作液。样品组A4:取0.8 mL的ABTS自由基工作液和 0.2 mL 的甘草毛状根提取液,混合均匀;阳性组A5:取 0.8 mL 的ABTS自由基工作液和0.2 mL的Trolox,混合均匀;空白组A0:取0.8 mL的ABTS自由基工作液和0.2 mL的无水乙醇,混合均匀。上述各组溶液室温静置10 min,在734 nm波长下测定吸光度值D4、D5和D0[26]。对ABTS自由基的清除率计算公式如下:
清除率=(D0-Di)/D0 ×100%(i=4,5)。(4)
1.2.5 美白功效评价
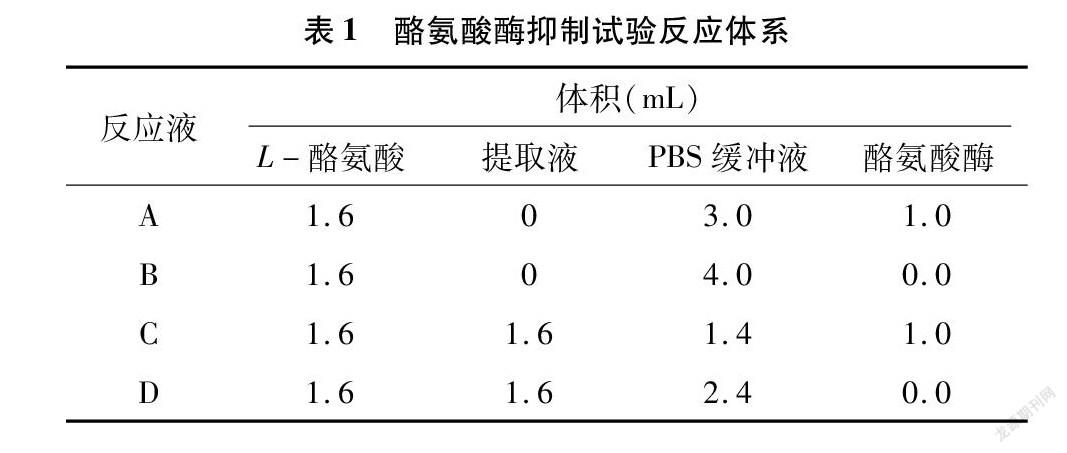
1.2.5.1 体外抑制酪氨酸酶活性试验 参考行业标准T/SHRH 015—2018《化妆品-酪氨酸酶活性抑制实验方法》[27],对3种甘草毛状根提取液的酪氨酶活性抑制率进行测定。采用固定反应时间法,按表1在10 mL离心管中依次加入L-酪氨酸(0.05%)、提取液和PBS缓冲液(pH值6.8),37 ℃孵育10 min;再依次加入酪氨酸酶(200 U/mL),混匀,37 ℃孵育30 min,在475 nm波长下测定吸光度[28]。酪氨酸酶活性抑制率计算公式如下:
抑制率=[1-(DC-DD)/(DA-DB)]×100%。(5)
2 结果与分析
2.1 超声法提取率的影响因素及其水平的确定
选用研磨好的乌拉尔甘草毛状根作为材料,确定超声法中溶剂、料液比、超声温度和超声时间各因素对总黄酮的提取率影响水平,优化总黄酮的提取条件。
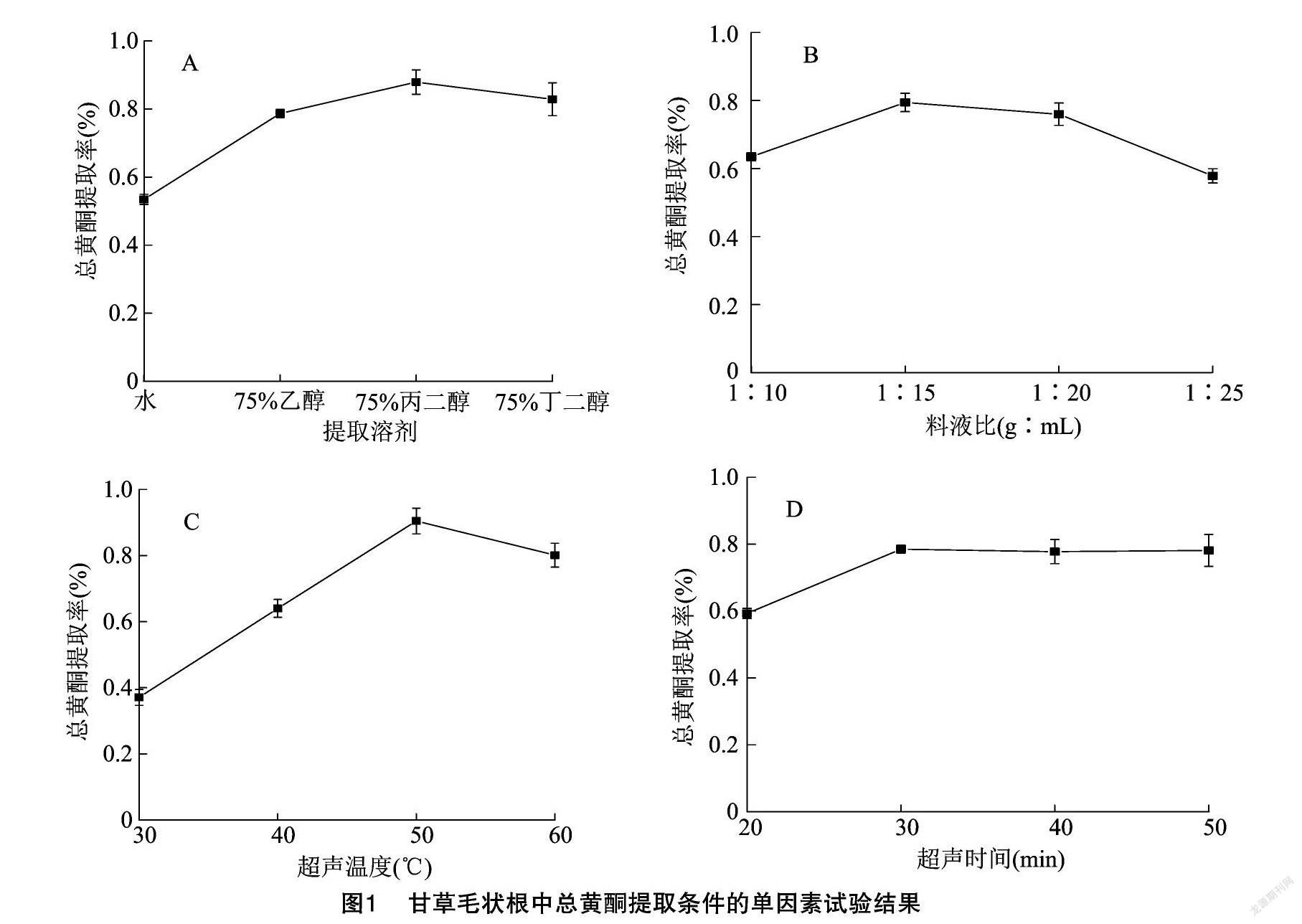
2.1.1 溶剂对提取率的影响 提取溶剂对乌拉尔毛状根中总黄酮提取率的影响见图1-A。在料液比1 g ∶15 mL、超声温度50 ℃、超声时间 30 min 的条件下,不同溶剂对乌拉尔甘草毛状根中总黄酮的提取率差异显著(P<0.05),從高到低依次为75%丙二醇>75%丁二醇>75%乙醇>水。因此,选择75%丁二醇、75%乙醇和75%丙二醇3种溶剂用于后续正交试验。
2.1.2 料液比对提取率的影响 在以75%丙二醇为溶剂、超声温度50 ℃、超声时间30 min的条件下,不同料液比对乌拉尔甘草毛状根中总黄酮的提取率(图1-B)差异显著(P<0.05),随着溶剂的增加,总黄酮提取率呈先升高后降低的趋势,当料液比为1 g ∶15 mL时,总黄酮提取率最高,为0.794%。因此,选择1 g ∶10 mL、1 g ∶15 mL和 1 g ∶20 mL等3个料液比进行后续的正交试验。
2.1.3 超声温度对提取率的影响 在以75%丙二醇为溶剂、料液比1 g ∶15 mL、超声时间30 min的条件下,不同超声温度对乌拉尔甘草毛状根中总黄酮的提取率(图1-C)差异显著(P<0.05),随着超声温度的升高,总黄酮提取率呈先升高后降低的趋势,当超声温度为50 ℃时,总黄酮提取率最高,为0.905%。因此,选择40、50、60 ℃等3个不同温度进行后续正交试验。
2.1.4 超声时间对提取率的影响 在以75%丙二醇为溶剂、料液比1 g ∶15 mL、超声温度50 ℃的条件下,不同超声时间对乌拉尔甘草毛状根中总黄酮的提取率(图1-D)差异显著(P<0.05),随着超声时间的增加,总黄酮提取率呈先升高后降低的趋势,当超声时间为30 min时,总黄酮提取率最高,为0.785%。因此,选择20、30、40 min等3个超声时间进行后续正交试验。
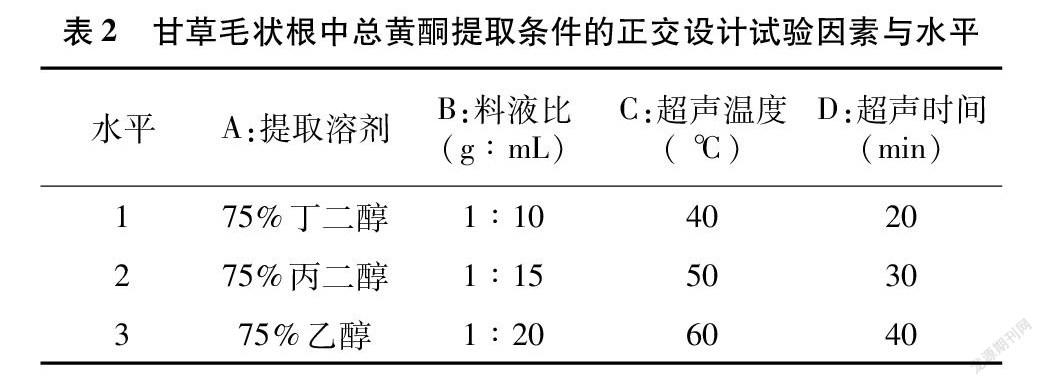
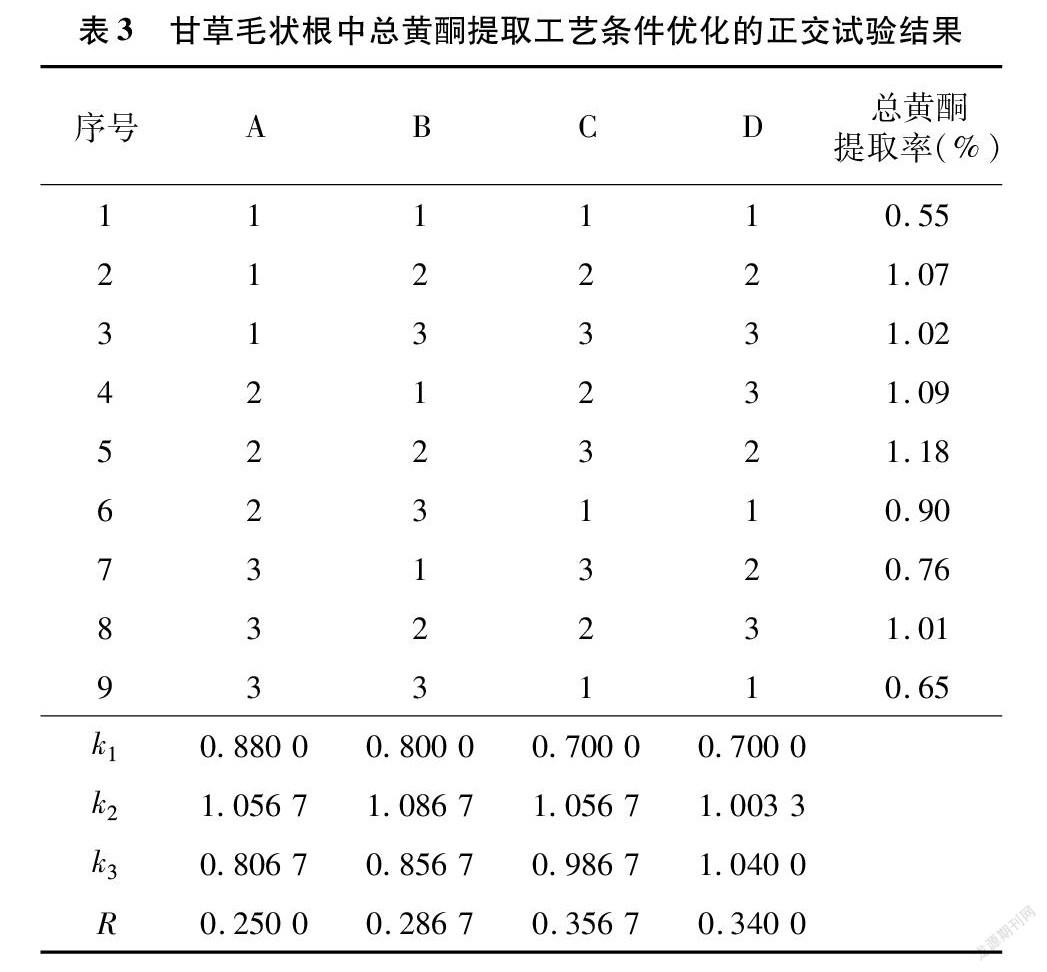
2.1.5 正交优化 根据单因素试验结果可知,因素A(提取溶剂)、B(料液比)、C(超声温度)、D(超声时间)均会影响乌拉尔甘草毛状根中总黄酮的提取率,所以选择以上4种因素进行正交试验(表2),试验结果见表3。不同因素对乌拉尔甘草毛状根中总黄酮提取率的影响主次顺序为C>D>B>A,即对乌拉尔甘草毛状根中总黄酮提取率影响最大的因素为超声温度,其次是超声时间、料液比和提取溶剂。在此基础上,对同一因素的3个水平进行比较,对乌拉尔甘草毛状根中总黄酮提取率的影响依次为A2>A1>A3、B2>B3>B1、C2>C3>C1、D3>D2>D1。综上所述,对乌拉尔甘草毛状根中总黄酮提取率的最佳水平组合为A2B2C2D3,即在超声提取中,溶剂为75%丙二醇,料液比1 g ∶15 mL,超声温度50 ℃,超声时间40 min。
按最佳提取条件进行验证试验,乌拉尔甘草毛状根总黄酮提取率为1.25%,高于正交试验中的9个组合试验结果,表明试验方案可行。
2.2 3种甘草毛状根中成分含量的比较
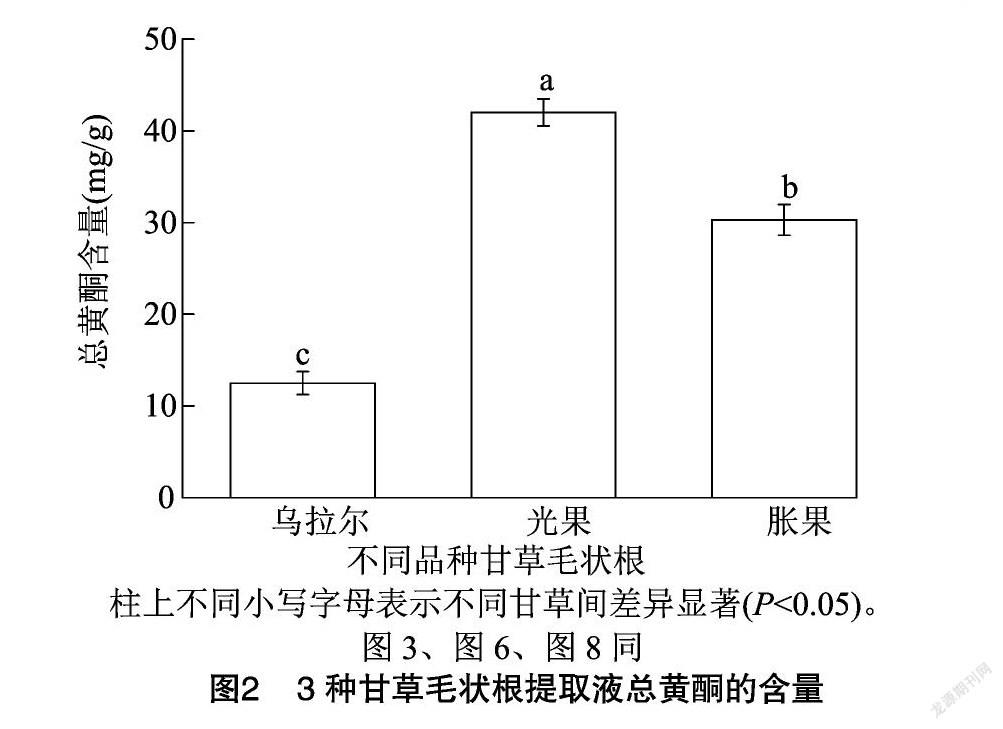
2.2.1 总黄酮含量比较 按照“2.1.5”节正交优化条件,分别对3种甘草毛状根中的总黄酮进行提取,比较提取液中总黄酮的含量,结果见图2。乌拉尔甘草(简称“乌拉尔”)、光果甘草(简称“光果”)和胀果甘草(简称“胀果”)3种甘草毛状根中的总黄酮含量依次为(12.48±1.26)、(42.03±1.47)、(30.32±1.67) mg/g。总黄酮在3种甘草毛状根中的含量存在显著差异(P<0.05),其中光果中的总黄酮含量最高,分别比乌拉尔和胀果中的总黄酮含量高236.78%、38.62%。表明3种甘草毛状根中总黄酮含量从高到低依次为光果>胀果>乌拉尔。
2.2.2 甘草苷、异甘草苷和光甘草定黄酮类成分含量比较 在比较甘草毛状根总黄酮含量的基础上,选取了具有代表性的甘草黄酮类成分进行比较,其中甘草苷[29]和异甘草苷[30]具有良好的抗氧化活性,光甘草定具有抑制酪氨酸酶活性调控黑色素生成的活性[31]。
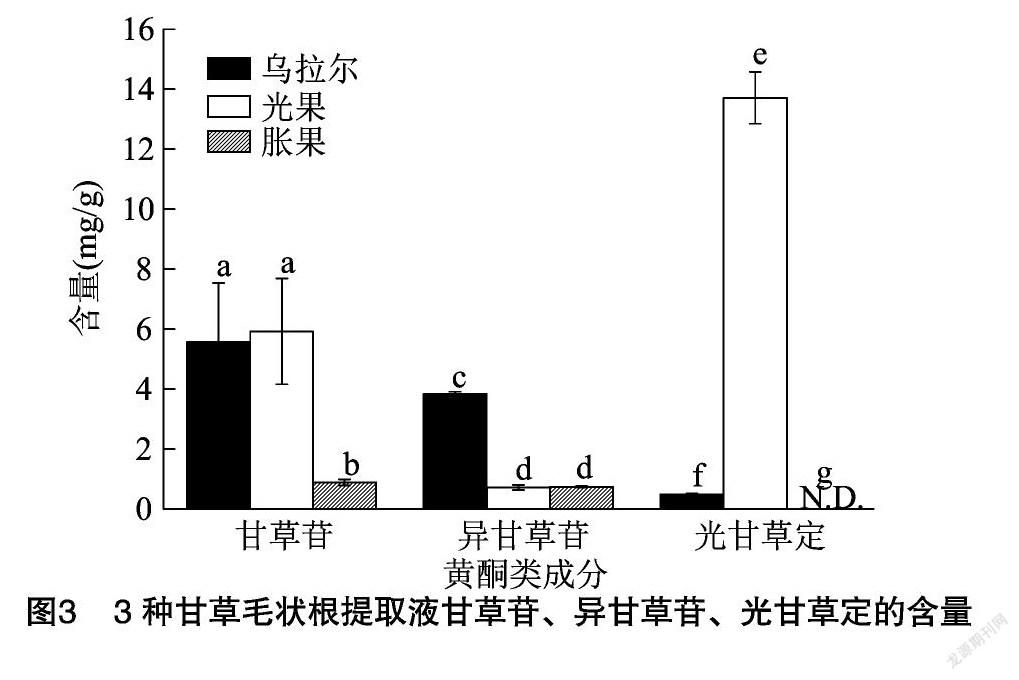
采用HPLC分别测定它们在3种甘草毛状根提取液中的含量,测定结果见图3,甘草苷在3种甘草毛状根中含量依次为(5.57±1.96)、(5.92±1.77)、(0.89±0.10) mg/g,其在3种甘草毛状根中的含量存在显著差异(P<0.05),光果中的甘草苷含量最高,分别比乌拉尔、胀果中甘草苷含量高6.28%、565.17%。异甘草苷在3个甘草毛状根中含量依次为(3.8±0.07)、(0.71±0.09)、(0.73±0.03) mg/g,乌拉尔中的异甘草苷显著高于其他甘草毛状根,分别比光果、胀果中的异甘草苷含量高435.21%、420.55%。光甘草定在3种甘草毛状根中含量依次为(0.49±0.02) mg/g、(13.71±0.86) mg/g、N.D.(未检出),光甘草定在3种甘草毛状根中的含量差异显著(P<0.05),光果中的光甘草定含量最高,比乌拉尔中的光甘草定含量高 2 697.95%,胀果中光甘草定含量低于仪器检出量。
表明3种甘草毛状根中甘草苷含量依次表现为光果≈乌拉尔>胀果;异甘草苷含量依次表现为乌拉尔>光果≈胀果;光甘草定含量依次表现为光果>乌拉尔>胀果。
2.3 甘草毛狀根的刺激性
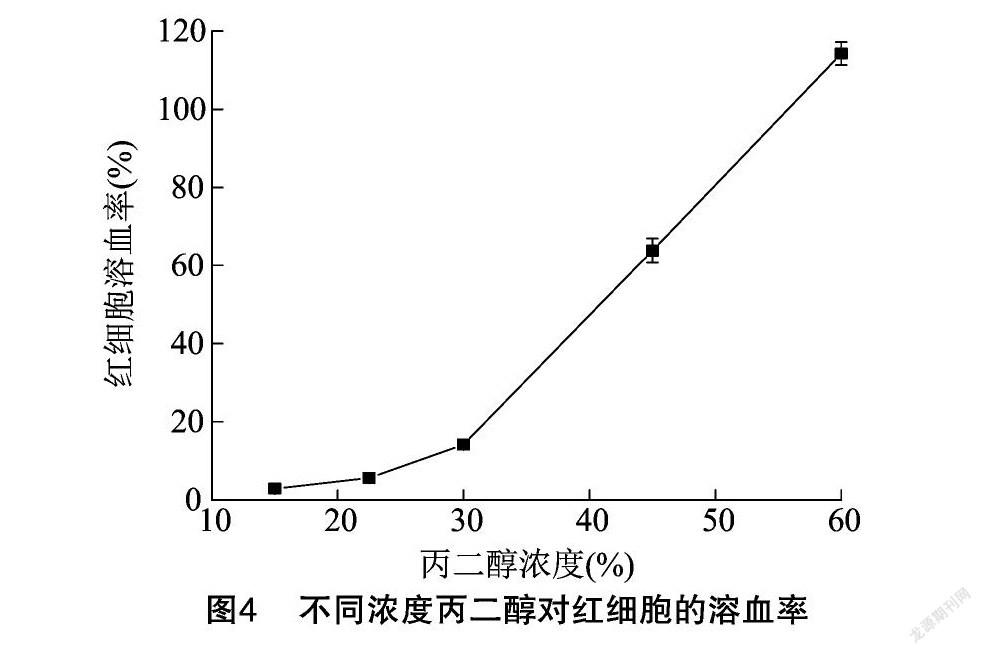
2.3.1 甘草毛状根提取液对红细胞的溶血率 首先采用红细胞溶血试验测定提取溶剂丙二醇的安全浓度,当丙二醇终浓度≤15%时,红细胞溶血率低于5%,无刺激性(图4)。因此,对甘草毛状根提取液进行稀释,即将甘草毛状根提取液稀释后使丙二醇的终浓度≤15%。
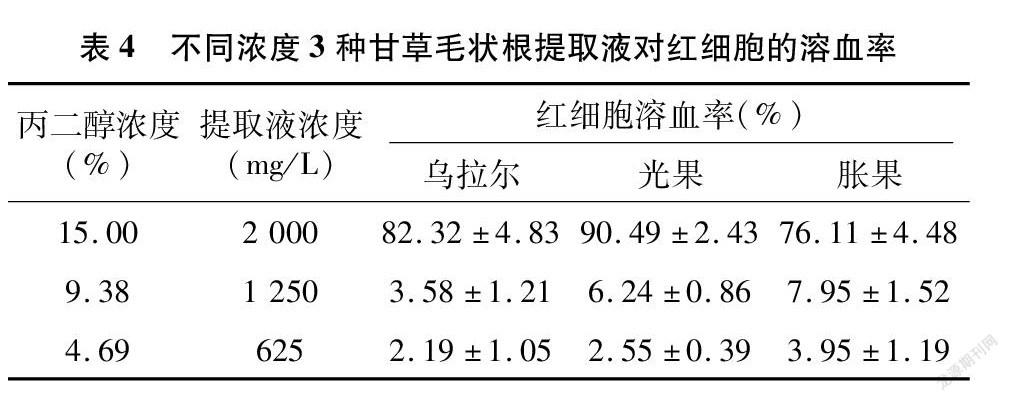
分别对浓度为2 000 mg/L(丙二醇浓度为15%)、1 250 mg/L(丙二醇浓度为9.38%)、625 mg/L(丙二醇浓度为4.69%)的甘草毛状根提取液进行红细胞溶血率测定,试验结果见表4。当甘草毛状根提取液浓度为2 000 mg/L时,乌拉尔、光果和胀果提取液对红细胞的溶血率依次为(82.32±4.83)%、(90.49±2.43)%、(76.11±4.48)%,对红细胞的溶血率均高于5%,有强刺激性;当甘草毛状根提取液浓度为1 250 mg/L时,乌拉尔、光果、胀果提取液对红细胞的溶血率依次为(3.58±1.21)%、(6.24±0.86)%、(7.95±1.52)%,光果、胀果对红细胞的溶血率均高于5%,有刺激性;当甘草毛状根提取液浓度为625 mg/L时,乌拉尔、光果、胀果提取液对红细胞的溶血率依次为(2.19±1.05)%、(2.55±0.39)%、(3.95±1.19)%,对红细胞的溶血率都低于5%,无刺激性。
2.3.2 甘草毛状根提取液对鸡胚绒毛尿囊膜的刺激性
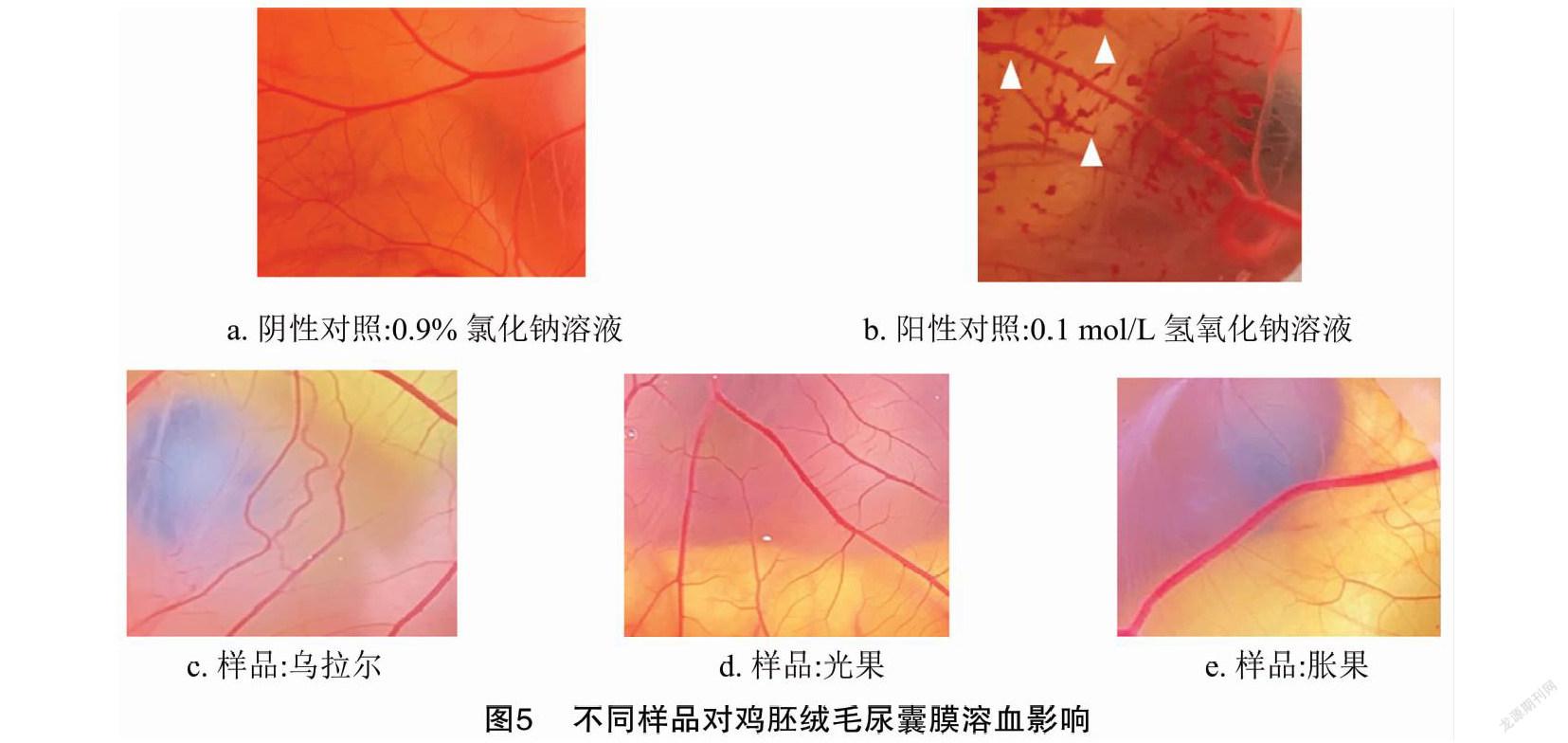
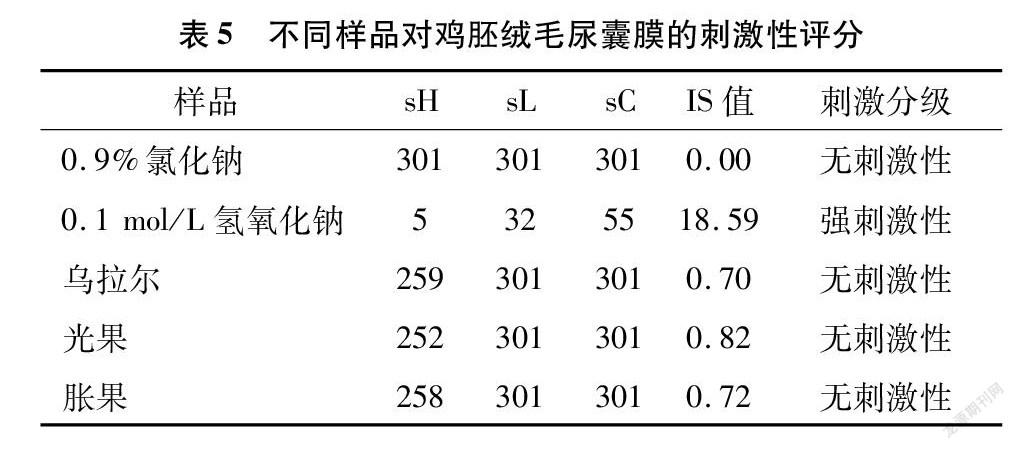
在红细胞溶血试验结果的基础上,评测甘草毛状根提取液(浓度为625 mg/L)对鸡胚绒毛尿囊膜的刺激性,试验结果见图5。供试溶液刺激鸡胚尿囊膜血管5 min后,阳性对照(0.1 mol/L氢氧化钠)出现严重溶血、重度凝血及重度血管溶解现象;而供试样品(浓度为625 mg/L的3种甘草毛状根提取液)与阴性对照(0.9%氯化钠溶液)均无出血、凝血和血管融解现象。根据刺激评分IS数值,IS<1为无刺激性,1≤IS<5为轻刺激性,5≤IS<9为中度刺激性,IS≥10为强刺激性。通过计算,IS计算结果见表5,阴性对照的IS为0,表现为无刺激性;阳性对照的IS为18.59,表现为强刺激性,说明试验结果符合预期是可接受的。3种甘草毛状根提取液的IS值均小于1,说明浓度在625 mg/L,时甘草毛状根提取液对鸡胚绒毛尿囊膜均无刺激性。
2.4 甘草毛状根提取液的抗氧化的能力
为了阐明甘草毛状根提取液的抗氧化护肤功效,采用DPPH自由基和ABTS自由基清除试验对3种甘草毛状根提取液的抗氧化能力进行体外评测。
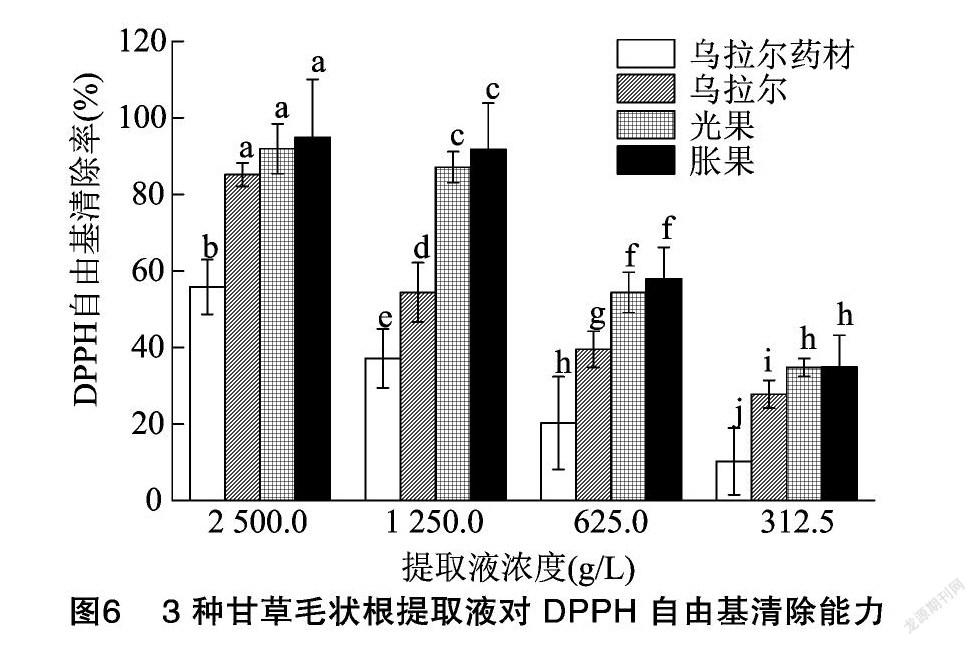
2.4.1 甘草毛状根提取液清除DPPH自由基的能力 3种甘草毛状根提取液对DPPH自由基的清除能力结果见图6,乌拉尔、光果、胀果提取液清除DPPH自由基的IC50依次为1 100、570、540 mg/L,3种甘草毛状根提取液清除DPPH自由基的能力具有显著差异(P<0.05),从高到低依次为胀果>光果>乌拉尔。与同提取条件制备的乌拉尔甘草药材提取液相比较,3种甘草毛状根提取液对DPPH自由基的清除能力均更强(IC50=1 310 mg/L)。
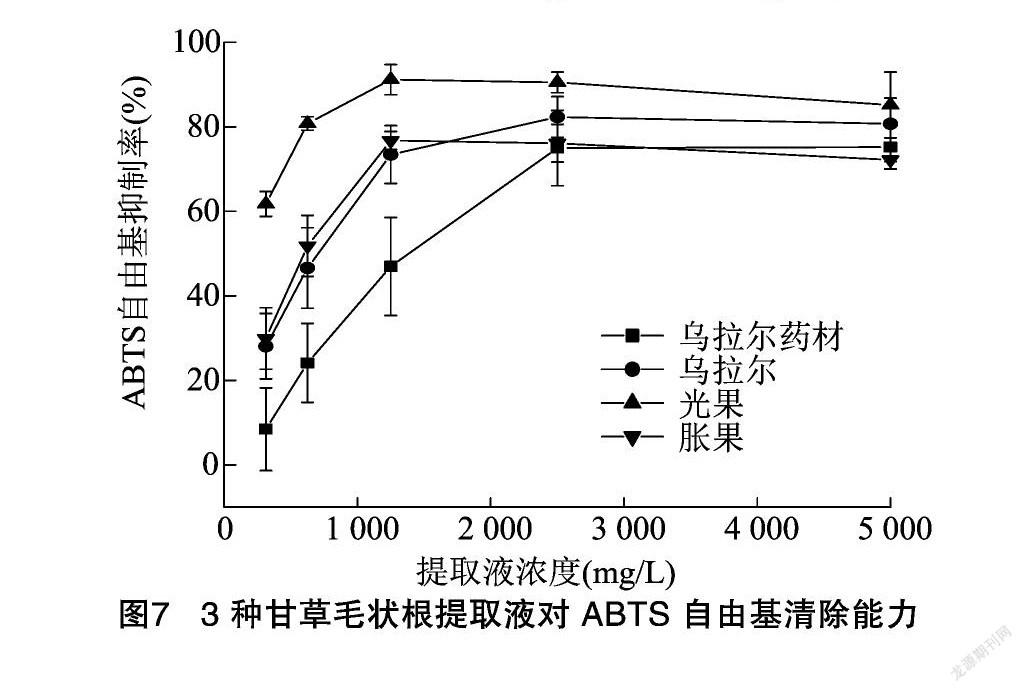
2.4.2 甘草毛状根提取液清除ABTS自由基的能力 3种甘草毛状根提取液对ABTS自由基的清除能力结果见图7,乌拉尔、光果、胀果提取液对清除ABTS自由基的IC50依次为740、230、590 mg/L,3种甘草毛状根提取液对清除ABTS自由基的能力具有显著差异(P<0.05),从高到低依次为光果>胀果>乌拉尔。与同提取条件制备的乌拉尔甘草药材提取液相比较,3种甘草毛状根提取液对ABTS自由基的清除能力均更强(IC50=2 110 mg/L)。
2.5 甘草毛状根提取液抑制酪氨酸酶的能力
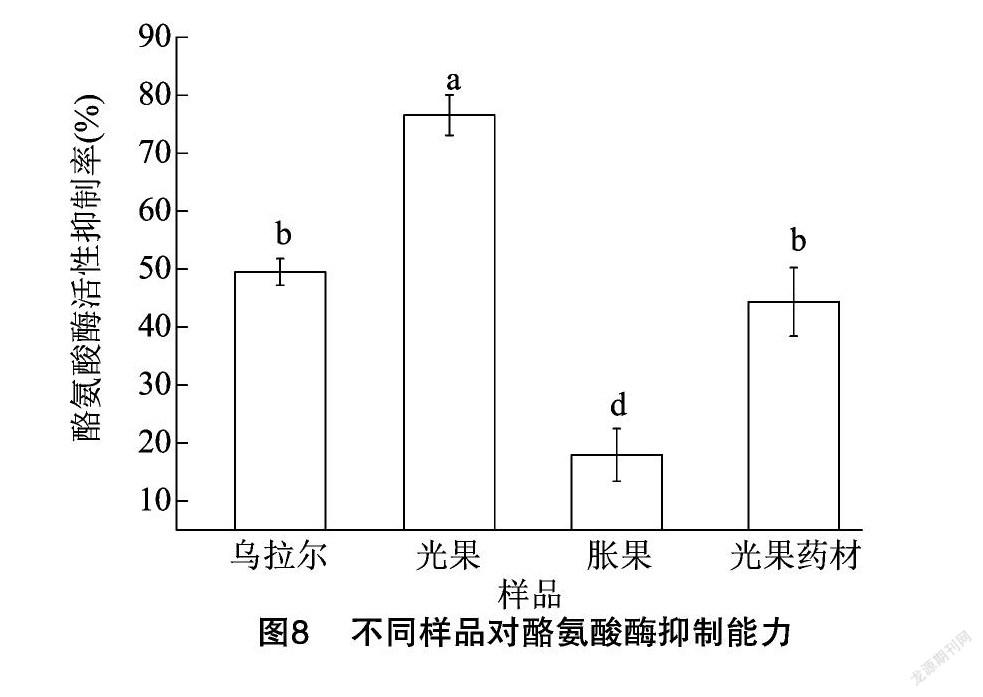
根据“2.3”节筛选出的甘草毛状根提取液安全浓度(625 mg/L)进行抑制酪氨酸酶能力的测定,试验结果见图8。乌拉尔、光果和胀果3种甘草毛状根提取液对酪氨酸酶活性抑制率依次为(49.5±2.3)%、(76.6±3.5)%、(17.95±4.5)%。3种甘草毛状根提取液对酪氨酸酶活性的抑制率具有显著差异(P<0.05),从高到低依次为光果>乌拉尔>胀果。选用已有报道光甘草定含量最高的光果甘草药材作为对照[32],在相同提取条件下制备光果甘草药材提取液,结果见图8,光果提取液浓度为 625 mg/L 的抑制率为(76.6 ± 3.5)%对酪氨酸酶的抑制率显著高于光果甘草药材提取液浓度为 625 mg/L,抑制率为(44.4±5.9)%。表明3种甘草毛状根提取液中光果对酪氨酸酶的抑制能力最强。
3 结论
采用单因素试验和正交试验,确定甘草毛状根的最佳提取条件:提取溶剂为75%丙二醇,料液比为1 g ∶15 mL,超声温度为50 ℃,超声时间为 30 min。3种甘草毛状根中的总黄酮含量存在显著差异(P<0.05),光果中总黄酮含量最高,胀果次之,乌拉尔中含量最低。其次,光果与乌拉尔中的甘草苷含量相当,均高于胀果;胀果与光果中的异甘草苷含量相当,均低于乌拉尔;光果中的光甘草定含量最显著高于乌拉尔和胀果。
3种甘草毛状根提取液浓度不高于625 mg/L时,提取液对红细胞与鸡胚绒毛尿囊膜均无刺激性。3种甘草毛状根提取液对DPPH自由基的清除能力由强到弱依次为胀果、光果、乌拉尔;对ABTS自由基的清除能力由强到弱依次为光果、胀果、乌拉尔,光果和胀果对DPPH和ABTS自由基具有较好的清除能力。3种甘草毛状根提取液抑制酪氨酸酶能力从高到低依次为光果、乌拉尔、胀果,光果对酪氨酸酶的抑制能力优于光果甘草药材,说明光果提取液具有较好的美白护肤功效。
本研究结果显示,3种甘草毛状根提取液中光果在抗氧化及美白护肤活性上均优于乌拉尔和胀果。
参考文献:
[1]国家药典委员会.中华人民共和国药典2015年版[M]. 北京:中国医药科技出版社,2015.
[2]Bao F,Bai H Y,Wu Z R,et al. Phenolic compounds from cultivated Glycyrrhiza uralensis and their PD-1/PD-L1 inhibitory activities[J]. Natural Product Research,2021,35(4):562-569.
[3]刘 鹏,田俊生.甘草苷治疗抑郁症和糖尿病共病的网络药理学作用机制研究[J]. 天然产物研究与开发,2019,31(11):1880-1886,1918.
[4]Liu Y Y,Wu J Q,Fan R Y,et al. Isoliquiritin promote angiogenesis by recruiting macrophages to improve the healing of zebrafish wounds[J]. Fish & Shellfish Immunology,2020,100:238-245.
[5]刘亮亮,陈 姬,张 波,等. 异甘草素与光甘草定抗肿瘤转移作用比较[J]. 中国实验方剂学杂志,2013,19(18):245-250.
[6]卓汉强.一种含有植物精油的烟草加料香精配方:CN110527595A[P]. 2019-12-03.
[7]Palmatier M I,Smith A L,Odineal E M,et al. Nicotine self-administration with tobacco flavor additives in male rats[J]. Nicotine & Tobacco Research,2020,22(2):224-231.
[8]曲红盼,孔德承,成志伟.甘草次生代谢物在化妆品中的功效作用[J]. 中国化妆品,2020(8):109-112.
[9]Chen J M,Yu X J,Huang Y F.Inhibitory mechanisms of glabridin on tyrosinase[J]. Spectrochimica Acta,2016,168:111-117.
[10]Tanaka Y,Kikuzaki H,Fukuda S,et al. Antibacterial compounds of licorice against upper airway respiratory tract pathogens[J]. Journal of Nutritional Science and Vitaminology,2001,47(3):270-273.
[11]Reigada I,Moliner C,Valero M S,et al. Antioxidant and antiaging effects of licorice on the Caenorhabditis elegans model[J]. Journal of Medicinal Food,2020,23(1):72-78.
[12]楊世海,刘晓峰,沈 昕,等. 甘草Ri质粒转化及不同理化因子对甘草毛状根生长的影响[J]. 中国中药杂志,2006,31(11):875-878.
[13]杜 旻,向德军,丁家宜,等. 甘草毛状根培养系统的建立及化学成分分析[J]. 植物资源与环境学报,2001,10(1):7-10.
[14]卢虹玉,刘 义,张海超,等. 甘草毛状根中甘草总黄酮和甘草酸的检测和分析[J]. 中国现代应用药学,2010,27(1):43-46.
[15]王裔惟,丁家宜,周倩耘,等. 光果甘草毛状根培养过程中对活性氧清除能力和总黄酮含量的变化[J]. 植物资源与环境学报,2004,13(2):6-9.
[16]卢虹玉,刘敬梅,张海超,等. 甘草毛状根诱导培养及其黄酮含量检测的研究[J]. 中国药学杂志,2011,46(11):814-818.
[17]姚庆收,陈向明,丁 斐,等. 甘草毛状根遗传转化体系的建立及甘草酸和总黄酮含量的测定[J]. 中药材,2018,41(9):2035-2038.
[18]Khazaei A,Bahramnejad B,Mozafari A A,et al. Hairy root induction and Farnesiferol B production of endemic medicinal plant Ferula pseudalliacea[J]. 3 Biotech,2019,9(11):407.
[19]杨 瑞,李文东,马永生,等. 不同基原甘草的分子鉴定及市售甘草药材的质量评价[J]. 药学学报,2017,52(2):318-326.
[20]苗永美,简 兴,汪 雁,等. 广东石豆兰不同溶剂提取物抗氧化及与总黄酮、总酚含量的关系[J]. 核农学报,2020,34(5):1038-1046.
[21]周逸芝,刘训红,许 虎,等. 高效液相色谱法同时测定龙柴方及其组成药甘草中甘草苷等5种指标成分的含量[J]. 中国药学杂志,2013,48(2):139-142.
[22]Okamoto Y,Ohkoshi K,Itagaki H,et al. Interlaboratory validation of the in vitro eye irritation tests for cosmetic ingredients.(3) Evaluation of the haemolysis test[J]. Toxicology in Vitro,1999,13(1):115-124.
[23]王 东,马金凤,蔡明旭,等. 咖啡酰氨基酸乙酯的合成及其抗氧化活性[J]. 精细化工,2019,36(3):494-498.
[24]国家质量监督检验检疫总局.化妆品眼刺激性/腐蚀性的鸡胚绒毛尿囊试验:SN/T 2329—2009[S]. 北京:中国标准出版社,2009.
[25]贾冬英,曹冬冬,姚 开.荸荠皮提取物对DPPH自由基清除活性[J]. 天然产物研究与开发,2007,19(5):745-747.
[26]Zou J,Huang Y X,Zhu L R,et al. Multi-wavelength spectrophotometric measurement of persulfates using 2,2′-azino-bis (3-ethylbenzothiazoline-6-sulfonate) (ABTS) as indicator[J]. Spectrochimica Acta,2019,216:214-220.
[27]上海日用化学品行业协会. 化妆品-酪氨酸酶活性抑制实验方法:T/SHRH 015—2018[S]. 上海:上海日用化学品行业协会,2018.
[28]Chaves O A,de Oliveira M C C,de Salles C M C,et al. In vitro tyrosinase,acetylcholinesterase,and HSA evaluation of dioxidovanadium (V) complexes:An experimental and theoretical approach[J].Journal of Inorganic Biochemistry,2019,200:110800.
[29]张丽宏,傅 云,廖 建,等. 甘草苷抑制UVB诱导HaCaT细胞凋亡的体外研究[J]. 中药材,2017,40(11):2672-2676.
[30]刘靖丽,权 彦,闫 浩,等. 基于DFT方法研究甘草中黄酮类化合物的抗氧化活性[J]. 当代化工,2020,49(10):2163-2166,2170.
[31]Chen J M,Fang Q Y,Liu S Q,et al. Influences of several factors on the photolysis of glabridin under UV irradiation[J]. Journal of Photochemistry and Photobiology,2017,339:12-18.
[32]張兴琪,何敬愉,龚盛昭,等. 不同种类甘草成分及美白抗敏活性差异研究[J]. 日用化学工业,2021,51(7):648-654.
3644501908244
