外源水杨酸对镉胁迫下藜麦幼苗生长生理的缓解效应
2022-03-11杨张钰朱心雨胡乐佳赵燕昊蒋玉蓉陆国权
杨张钰 朱心雨 胡乐佳 赵燕昊 蒋玉蓉 陆国权




摘要:研究外源水杨酸(SA)对镉胁迫下藜麦幼苗生长发育的影响,为降低藜麦生产中重金属胁迫提供理论依据。以藜麦“Tomico Quinoa”为供试品种,通过施加不同浓度(50、100、150 μmol/L)外源水杨酸处理,探究200 μmol/L镉胁迫下外源水杨酸对藜麦幼苗生长指标和生理指标的影响。结果表明,200 μmol/L镉胁迫处理显著降低了藜麦生长指标,并影响藜麦生理指标。镉胁迫使藜麦幼苗的生物量下降,可溶性蛋白、可溶性糖和叶绿素含量明显降低,超氧化物歧化酶(SOD)活性显著降低,而丙二醛(MDA)含量显著增加。施加不同浓度的外源水杨酸处理使藜麦幼苗的株高、鲜质量、可溶性糖含量和可溶性蛋白含量较镉胁迫下的CK2显著增加,并促进了光合作用。在100 μmol/L浓度的水杨酸处理下,幼苗的株高、鲜质量与无镉胁迫处理的CK1相比无显著差别,而脯氨酸含量在第3、第6天较CK2提高20.25%、18.60%。可溶性糖含量在100 μmol/L水杨酸处理下含量达到最高,显著高于CK1、CK2。施加外源水杨酸使藜麦幼苗的SOD活性和过氧化物酶(POD)活性较CK2显著上升。外源水杨酸处理显著降低了藜麦幼苗MDA的积累。本研究表明,施加不同浓度的外源水杨酸处理能在一定程度上缓解藜麦幼苗的镉胁迫,其中100 μmol/L外源水杨酸缓解镉胁迫毒害效果最好。
关键词:藜麦;镉胁迫;水杨酸;缓解作用;毒性效应;生长指标;生理指标
中图分类号: S519.01文献标志码: A
文章编号:1002-1302(2022)04-0052-06
收稿日期:2021-05-06
基金项目:浙江省自然科学基金(编号:Y21C130006);浙江省重点研发项目(编号:2021C02057);浙江省农业新品种选育重大科技专项子课题(编号:2016C02050-9-9);浙江农林大学大学生科研训练项目(编号:113-2013200131、113-2013200132)。
作者简介:杨张钰(1999—),女,浙江杭州人,从事作物生理生化研究。E-mail:3173008192@qq.com。
通信作者:蒋玉蓉,博士,副教授,从事作物育种和种质创新研究。E-mail:yurongjiang746@126.com。
土壤污染是全世界重点关注的环境污染问题,其中重金属污染是最突出的问题之一[1-3]。镉(Cd)作为一种人体非必需元素,被列入《有毒有害水污染名录(第一批)》[4]。当土壤受到镉污染后,镉被农作物的根系所吸收,并在农作物体内富集[5-6]。镉污染会导致植物的各种毒害效应,如抑制生长发育[5,7-8]、破坏细胞结构[5]、降低光合作用[5-7,9]、干扰矿质元素代谢[5-7]、气孔关闭[6]和诱发氧化损伤[5,7]等。通过食物链,农作物鎘污染会造成动物和人类严重危害[3,10]。因此,解决农作物镉污染问题迫在眉睫。
水杨酸(salicylic acid,简称SA)是一种植物体内普遍存在的小分子酚类物质,参与植物体内各种生理生化活动,激活植物体内相关的抗性代谢,增加其对环境胁迫的抗性[11],缓解胁迫所造成的伤害[12-14]。近年来,关于水杨酸缓解农作物镉胁迫的各种研究取得了一定的进展,如外源水杨酸缓解镉对番茄、烤烟、水稻、小麦、花生和油菜等毒害作用的研究[10,12-17]。
藜麦(Chenopodium quinoa Willd.)原产于南美洲,别称南美藜、印第安麦、奎藜、金谷子等,是一年生双子叶草本植物[18-19]。联合国粮食及农业组织(FAO)认为藜麦是唯一一种单体植物就可以满足人体全部基本物质需求的全营养食品,被誉为“未来的超级谷物”“营养黄金”“有机谷类之王”等[20-22]。藜麦植株的主要特性有抗逆性强、营养价值高、种植范围广、种植方法简单[17],值得大力度、大范围地推广。目前在我国山东省青岛市、山西省、内蒙古自治区、云南省等地区已有规模化种植[17]。然而,我国关于藜麦对重金属胁迫响应机制的报道尚处于空白,对藜麦的抗逆研究和开发利用尚有待深入。本研究以藜麦品种“Tomico Quinoa”为材料,将不同浓度的水杨酸作用于镉胁迫下的藜麦幼苗,分析其生长和生理指标的变化,探讨水杨酸缓解藜麦重金属镉胁迫的效应,以期为揭示藜麦幼苗镉胁迫机制和缓解机制提供理论依据,并为开发这一优良植物资源在国内的推广奠定基础。
1 材料与方法
1.1 试验材料和处理
以藜麦“Tomico Quinoa”为材料,于2020年4—6月在浙江省农产品品质改良技术研究重点实验室进行试验,选用相同培育条件下长势一致的藜麦幼苗在50、100、150、200、250 μmol/L CdCl2溶液胁迫下处理5 d。预备试验结果表明,200 μmol/L为适合的胁迫浓度,它既对藜麦幼苗产生胁迫作用,又不会造成严重的Cd2+毒害。
1.2 试验设计
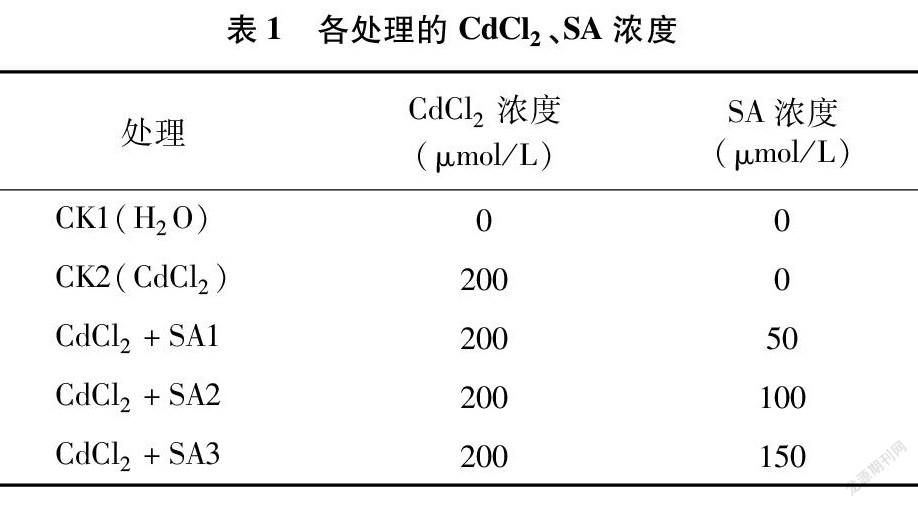
挑选饱满的种子,于28 ℃恒温箱催芽30 h后,播入装有石英砂的穴盘中育苗,给予自然光照。在幼苗第2张真叶展开时,选择每个处理15株长势一致的幼苗,移入20 L塑料周转箱中进行水培,每1 h通气40 min,预培养3 d后用CdCl2(浓度为 200 μmol/L)处理,同时在营养液中加入水杨酸处理,水杨酸浓度设定50、100、150 μmol/L 3个浓度,以单纯CdCl2胁迫和正常营养液植株分别为CK2、CK1,具体处理见表1,每个处理重复3次。分别在处理第3、第6天测量幼苗各项生长指标和生理指标。为了保证处理浓度的稳定性,处理期间每2 d更换1次营养液。
1.3 测定指标与方法
1.3.1 生长指标 用直尺测量幼苗株高、根长,用电子天平测量幼苗鲜质量。
1.3.2 生理指标 采用分光光度计法测定叶绿素含量[23]。采用考马斯亮蓝G-250比色法测定可溶性蛋白质含量[23]。采用蒽酮比色法测定可溶性糖含量[23]。采用茚三酮法测定脯氨酸含量[24]。采用硫代巴比妥酸法测定丙二醛(MDA)含量[24]。采用邻苯三酚自氧化法测定超氧化物歧化酶(SOD)活性[24]。采用愈创木酚法测定过氧化物酶(POD)活性[24]。
1.4 数据处理
采用SPSS 17.0软件进行数据处理,采用WPS软件作图。
2 结果与分析
2.1 外源水杨酸对CdCl2胁迫下幼苗生长的影响
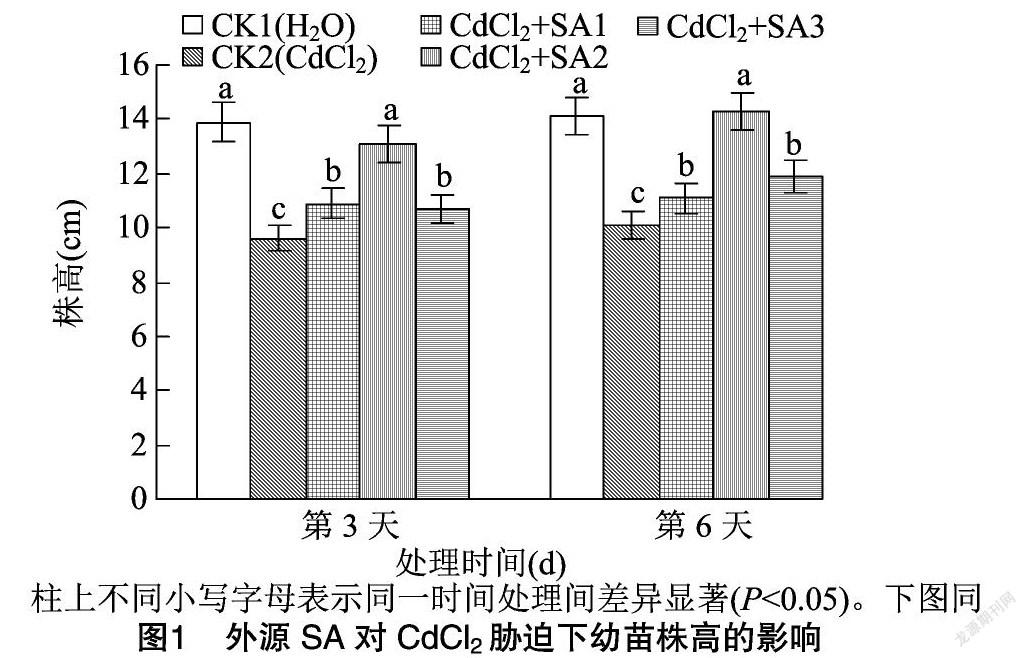
由图1、图2可知,200 μmol/L CdCl2胁迫下藜麦幼苗的株高、鲜质量与CK1相比显著下降,表明200 μmol/L CdCl2处理明显抑制了藜麦幼苗的生长。外施50、100、150 μmol/L水杨酸处理均能够不同程度地缓解CdCl2胁迫处理下对藜麦幼苗生长的抑制。其中100 μmol/L水杨酸处理的缓解效果最好,在该处理下,株高在第3、第6天分别达到13.11、14.30 cm,比CK2分别提高36.46%、41.58%,与CK1相比无显著差异。藜麦在100 μmol/L水杨酸处理下第3、第6天的鲜质量分别比CK2提高了50.57%、74.49%,而与CK1无显著差异。
2.2 外源水杨酸对CdCl2胁迫下叶片光合色素的影响
叶绿素含量是植物光合作用的重要指标[25],光合色素中叶绿素a以及叶绿素b具有吸收和传递光能的作用[26]。由表2可知,CdCl2胁迫第3、第6天,叶片内叶绿素a、叶绿素b、叶绿素a+叶绿素b含量均显著低于CK1。不同浓度外源水杨酸处理使幼苗在第3天的叶绿素a、叶绿素b、叶绿素a+叶绿素b含量均显著高于CK2。其中100 μmol/L水杨酸处理下叶绿素含量增加最显著。幼苗的叶绿素总含量在100 μmol/L浓度的水杨酸处理下在第3、第6天分别较CK2显著提高了21.04%、6.00%。叶绿素a含量在100 μmol/L水杨酸处理下在第3、第6天分别较CK2显著提高12.81%、4.83%,叶绿素b含量则分别提高了32.35%、7.27%。而当水杨酸浓度达到150 μmol/L时,缓解作用减弱。
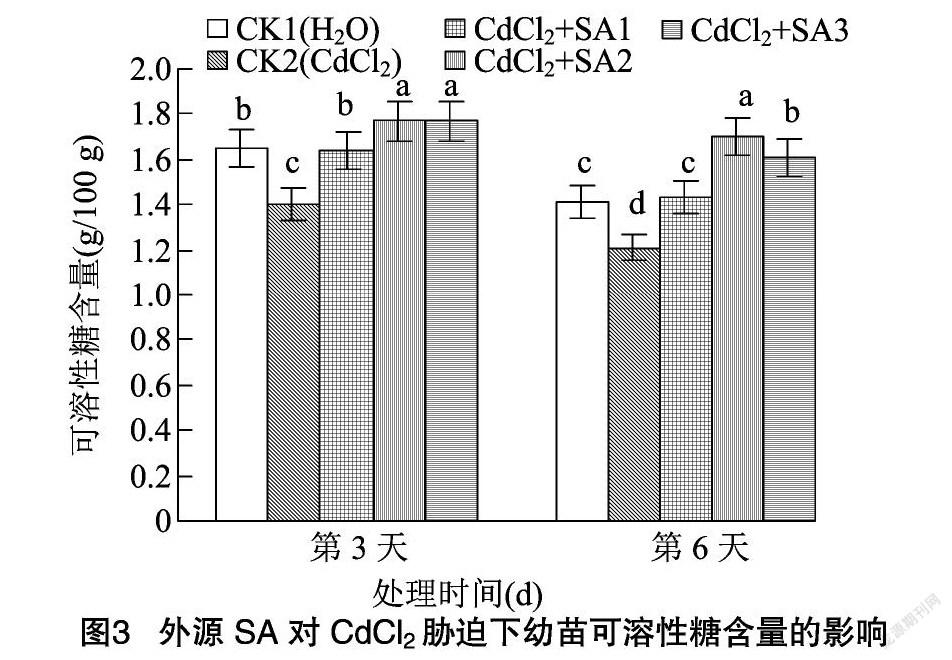
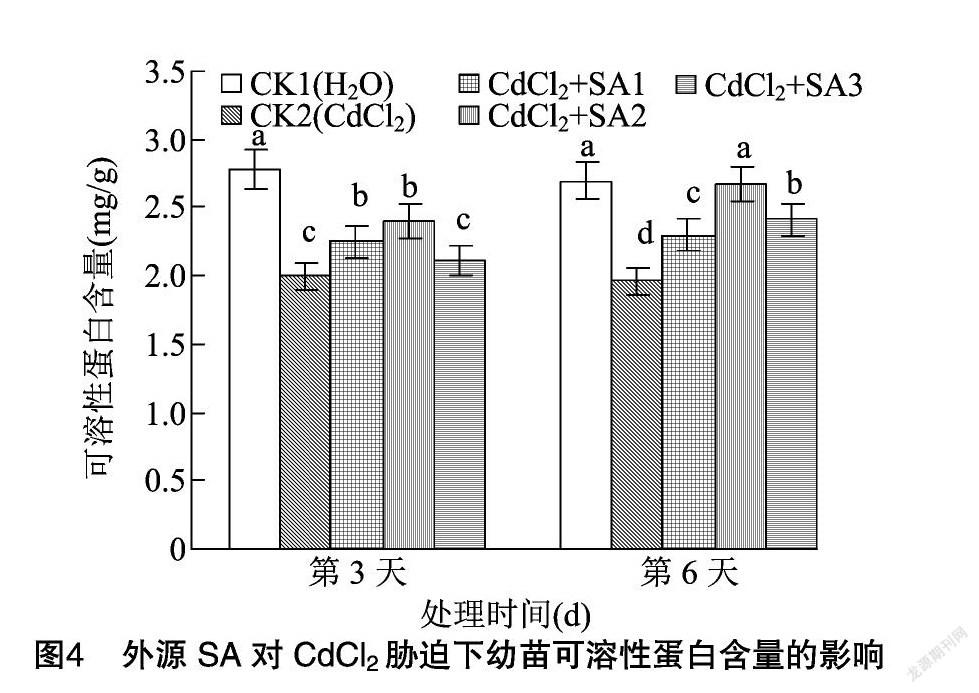
2.3 外源水杨酸对CdCl2胁迫下幼苗渗透调节物质含量的影响
可溶性糖是植物生长发育和基因表达的重要调节因子[27]。可溶性蛋白是植物体内重要的渗透调节物质[28]。由图3、图4可知,CdCl2胁迫下藜麦幼苗可溶性糖含量在第3、第6天分别与CK1相比降低15.15%、14.18%,而可溶性蛋白含量则较CK1分别降低28.06%、27.13%。脯氨酸是蛋白质的重要组成成分之一,亦是植物体内重要的渗透调节物质[29]。由图5可知,CdCl2胁迫下幼苗脯氨酸含量在第3、第6天分别上升23.44%、24.64%。添加外源水杨酸使可溶性糖、可溶性蛋白和脯氨酸含量显著升高。其中100 μmol/L外源水杨酸的处理效果最明显,藜麦幼苗可溶性糖与可溶性蛋白的含量在第6天分別比CK2提高40.50%、36.22%。100 μmol/L外源水杨酸处理下幼苗脯氨酸含量在第3、第6天分别较CK2提高20.25%、18.60%。水杨酸浓度上升到150 μmol/L时对CdCl2胁迫的缓解作用有所减弱。
2.4 外源水杨酸对CdCl2胁迫下幼苗抗氧化系统的影响
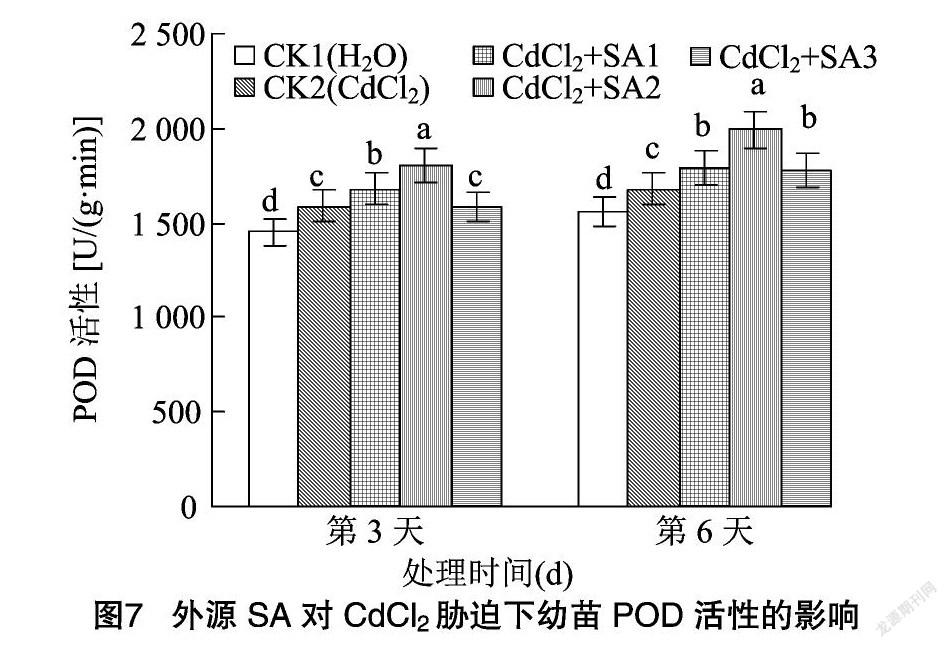
超氧化物歧化酶可以清除机体内有害的自由基,以解除机体损害[26]。过氧化物酶作为活性较高的一种酶,它与呼吸作用、光合作用及生长素的氧化等密切相关[26]。由图6、 图7可知,CdCl2处理和水杨酸处理均显著改变了藜麦幼苗中SOD、POD的活性。CdCl2胁迫使藜麦幼苗SOD活性在第3、第6天分别比CK1降低21.45%、18.08%。施加不同浓度水杨酸均显著提高了幼苗SOD活性,其中 100 μmol/L 外源水杨酸处理下幼苗在第3、第6天的SOD活性较CK2分别提高了21.59%、17.57%。CdCl2胁迫下幼苗的POD活性在第3、第6天分别较CK1提高了9.49%、7.69%,不同浓度水杨酸处理显著提高了POD活性,其中100 μmol/L水杨酸处理效果最好,幼苗POD活性在第3、第6天较CK2分别提高13.51%、18.58%,而较CK1则分别提高了24.29%、27.71%。而当水杨酸处理浓度为 150 μmol/L 时幼苗的SOD、POD活性下降,说明高浓度的水杨酸缓解作用反而减弱。
2.5 外源SA对CdCl2胁迫下幼苗MDA含量的影响
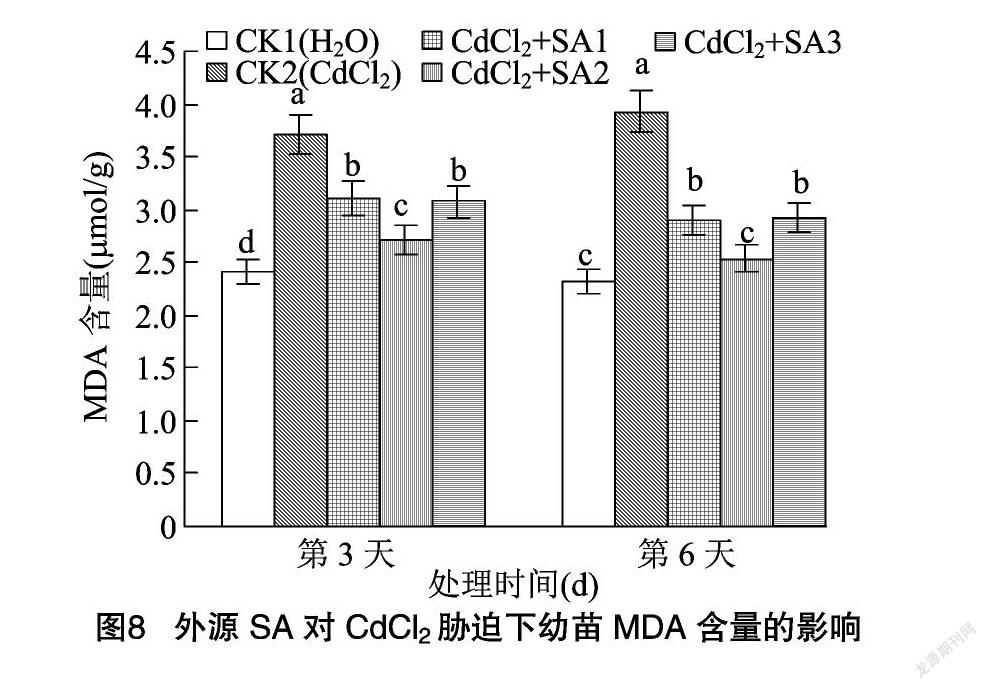
MDA是反映细胞膜过氧化作用强弱的一个指标,MDA含量越高,代表细胞膜脂过氧化作用越强,细胞膜受损伤越大[29-30]。由图8可知,CdCl2胁迫处理后,MDA含量显著增加,在第3、第6天分别比CK1提高53.94%、68.67%,表明细胞已经受到损伤。水杨酸处理可以显著缓解藜麦幼苗MDA的积累,其中施加100 μmol/L水杨酸的缓解作用最明显,MDA含量在第3、第6天分别比CK2处理降低26.68%、35.62%。说明外源SA可以缓解由于CdCl2胁迫造成的膜脂过氧化作用。而当水杨酸浓度为50、150 μmol/L 时,幼苗MDA含量均显著高于 100 μmol/L 水杨酸处理,其缓解作用随着水杨酸浓度的升高呈现先上升后下降的趋势。
3 讨论与结论
镉是我国农产品的主要重金属污染物之一[7]。镉在农作物体内过量积累会影响植株体内的各种生理生化代谢,阻碍农作物的正常生长发育,并且镉通过食物链传递对人类健康造成严重威胁[7]。水杨酸可以缓解逆境对植物的伤害[12],前人的研究中,关于水杨酸缓解作物镉胁迫的生理生化机制主要包括:(1)增加根系木质素合成加固细胞以防镉离子被根系吸收;(2)诱导谷胱甘肽(GSH)和植物螯合肽(PCs)合成,增强对镉离子的螯合作用,阻止镉离子在植物体内的移动;(3)增加光合作用、维持矿质营养平衡,促进植物生长发育;(4)增强抗氧化防御系统,缓解镉离子引起的氧化伤害[7]。藜麦是未来最具潜力的农作物之一[31-33],拥有很好的研究与开发前景,因此研究重金属镉胁迫及外源水杨酸对镉胁迫下藜麦幼苗的缓解作用具有一定的生产意义[7]。
200 μmol/L CdCl2胁迫明显降低了藜麦幼苗的鲜质量和株高,并显著降低了叶片叶绿素含量,这与张永平等的研究结果[34-35]一致。叶绿素含量的降低,或是镉胁迫破坏叶绿体的光系统,同时降低了叶绿体光合磷酸化能力,从而抑制了光合作用能力;或是由于镉胁迫引起活性氧积累导致氧化破坏,光合色素的降解加速,生长受到严重抑制[32,34]。添加适当浓度的SA能显著促进藜麦幼苗生长,并提高叶绿素含量,且以100 μmol/L缓解效果最佳,这与贾茵等对小报春的研究结果[35]基本一致。外源水杨酸对镉胁迫造成的光合色素减少具有明显的缓解作用,可能与其增强叶绿素酸酯氧化还原酶活性、降低叶绿素酶活性有关[7]。此外,水杨酸通过促进叶绿素所需的Fe和Mg的吸收来维持叶绿素的合成,提供光合色素含量,从而缓解镉胁迫对植株光合色素合成的抑制作用[7]。
可溶性蛋白参与植物体内各种代谢,是植物在胁迫中重要的生理指标[25],可溶性糖和脯氨酸是很多植物的主要渗透调节物质。本研究中,施加不同浓度水杨酸处理后,藜麦幼苗体内脯氨酸、可溶性糖和可溶性蛋白含量较镉胁迫处理CK2明显上升,表明SA不仅能促进藜麦渗透调节物质的产生,通过渗透调节缓解镉胁迫带来的伤害,还能通过提高幼苗的代谢活力来增强其对镉胁迫的抵抗力。随着施加水杨酸浓度的增加,可溶性糖含量、可溶性蛋白含量和脯氨酸含量均呈先上升后下降的趋势。脯氨酸含量在施加100 μmol/L SA时达到最大值,在第6天较CK1和CK2分别增加了49.28%和18.60%。脯氨酸不仅可以保护胁迫下的植株,还可以刺激植株提高自身抗氧化活性以清除体内过多的活性氧,进一步缓解植株受伤害[12]。
SOD可以清除机体内有害的自由基,以解除机体损害[26]。POD是活性较高的一种酶,它与呼吸作用、光合作用及生长素的氧化等密切相关[26]。本研究结果得出,不同浓度水杨酸处理均使幼苗的SOD活性和POD活性较CK2显著增加,说明SA处理可以显著提高逆境中植株中抗氧化酶的活性,从而缓解镉脅迫对植株生长的抑制,这与王小红等的研究结果[10,35-37]一致。SOD和POD活性随外源SA浓度的增加呈现先升后降的变化趋势[35],并以 100 μmol/LSA的作用最显著,王小红等在番茄上也得到证实[10]。镉胁迫对作物最明显的毒害作用是活性氧(ROS)过量积累,水杨酸缓解镉毒害的一个重要机制是增强作物体内抗氧化防御系统,有效消除ROS过量积累,减缓镉胁迫对作物造成氧化损伤[7]。丙二醛(MDA)是反映细胞膜过氧化作用强弱的一个指标[29-30]。重金属胁迫会大量增加植物体内活性氧自由基,加剧膜脂质过氧化,产生MDA,损伤细胞膜系统的完整性[35]。本研究表明,CdCl2胁迫后,MDA含量显著增加,表明细胞已经受到损伤。外源水杨酸可以激活植物体内的抗性相关代谢[35,38]。水杨酸处理降低了镉胁迫下藜麦幼苗中的MDA含量,这与赵明香等在植物烤烟和烟草幼苗中所得结果[12,39]一致,表明施加外源水杨酸可以缓解镉胁迫引起的膜脂质过氧化,维持藜麦植株原生质和环境的渗透平衡,从而缓解镉胁迫对植株生长发育的抑制[35]。本研究结果表明,施加 100 μmol/L 水杨酸的缓解作用最明显,而浓度超过100 μmol/L后其缓解作用又有所减弱,呈现一定程度的低促高抑的作用,这与王小红等关于水杨酸缓解镉对番茄毒害作用的试验结果[10]基本一致。本研究结果表明,水杨酸对镉胁迫下藜麦幼苗的毒害存在缓解作用,不同浓度的水杨酸缓解呈现不同的浓度效应。SA可能通过提前刺激植株产生系统抗性,激活植物体内的抗氧化保护酶,从而缓解重金属的毒害作用[7]。王小红等认为不同植物适应SA的量是不同的[10],适量浓度的SA可以诱导植物的抗性,增强植物抵御外界胁迫的能力[35]。水杨酸作用幅度存在一定差异,100 μmol/L SA对藜麦的生长促进作用最为明显,而50、150 μmol/L SA的作用效果较弱。这与马乐元等在小冠花上的研究结果[40]基本一致。但与赵明香等的研究结果[12,35]有一定差异,主要表现在SA最佳浓度有所不同,存在明显的剂量效应,说明SA对于不同作物以及不同逆境胁迫下的调控作用会因浓度的不同而异。植物重金属毒害的机制比较复杂,有关SA诱导藜麦幼苗抗性的具体机制还有待进一步探讨。
参考文献:
[1]张云菲,孜比布拉·司马义,杨胜天,等. 农田土壤重金属污染特征、生态风险评价与来源分析[J]. 江苏农业科学,2020,48(4):266-272.
[2]梁耀杰.我国土壤重金属污染现状及其防治措施探讨[J]. 资源节约与环保,2020(1):98.
[3]Karalija E,Selovic' A,Dahija S,et al. Use of seed priming to improve Cd accumulation and tolerance in Silene sendtneri,novel Cd hyper-accumulator[J]. Ecotoxicology and Environmental Safety,20210:111882.
[4]中华人民共和国生态环境部.关于发布《有毒有害水污染物名录(第一批)》的公告[R/OL]. (2019-07-24)[2021-01-06]. https://www.mee.gov.cn/xxgk2018/xxgk/xxgk01/201907/t20190729_712633.html.
[5]宋雅娟,李师翁. 水杨酸在植物缓解重金属镉胁迫中的作用[J]. 环境科学与技术,2020,43(2):177-186.
[6]Arévalo-Hernández C O,Arévalo-Gardini E,Barraza F,et al. Growth and nutritional responses of wild and domesticated cacao genotypes to soil Cd stress[J]. Science of the Total Environment,2021,763:144021.
[7]潘九月,屠王满措,关美艳,等. 水杨酸缓解农作物镉毒害的作用机制研究进展[J]. 生态学杂志,2020,39(12):4216-4223.
[8]Guo B,Liang Y C,Zhu Y G,et al. Role of salicylic acid in alleviating oxidative damage in rice roots (Oryza sativa) subjected to cadmium stress[J]. Environmental Pollution,2007,147(3):743-749.
[9]Hussain B,Ashraf M N,Shafeeq-Ur-rahman,et al. Cadmium stress in paddy fields:effects of soil conditions and remediation strategies[J]. Science of the Total Environment,2021,754:142188.
[10]王小红,郭军康,贾红磊,等. 外源水杨酸缓解镉对番茄毒害作用的研究[J]. 农业环境科学学报,2019,38(12):2705-2714.
[11]邵小杰,杨洪强,冉 昆,等. 水杨酸对镉胁迫下葡萄根系质膜ATPase和自由基的影响[J]. 中国农业科学,2010,43(7):1441-1447.
[12]赵明香,朱永立,向蓉蓉,等. 外源水杨酸对镉锌胁迫下烤烟生长及抗氧化特性的影响[J]. 西北农林科技大学学报(自然科学版),2020,48(2):34-41.
[13]Chao Y Y,Chen C Y,Huang W D,et al. Salicylic acid-mediated hydrogen peroxide accumulation and protection against Cd toxicity in rice leaves[J]. Plant and Soil,2010,329(1/2):327-337.
[14]王瑞波. 水杨酸对镉胁迫小麦叶绿素荧光参数的影响[J]. 生物技术通报,2017,33(7):96-99.
[15]Dong Y J,Chen W F,Liu F Z,et al. Effects of exogenous salicylic acid and nitric oxide on peanut seedlings growth under iron deficiency[J]. Communications in Soil Science and Plant Analysis,2016,47(22):2490-2505.
[16]Ali E,Maodzeka A,Hussain N,et al. The alleviation of cadmium toxicity in oilseed rape (Brassica napus) by the application of salicylic acid[J]. Plant Growth Regulation,2015,75(3):641-655.
[17]张 晓,张环纬,陈 彪,等. 外源硅及水杨酸对镉胁迫下烟草幼苗生长和生理特性的影响[J]. 中国农业科技导报,2019,21(3):133-140.
[18]高菊霞. 藜麦的发展与应用潜力分析[J]. 农业技术与装备,2020(10):156-157.
[19]白丽丽,史军辉,刘茂秀,等. 藜麦特性研究进展综述[J]. 植物医生,2020,33(5):22-27.
[20]袁俊杰,蒋玉蓉,吕柯兰,等. 不同盐胁迫对藜麦种子发芽和幼苗生长的影响[J]. 种子,2015,34(8):9-13,17.
[21]王倩朝,孔治有,刘俊娜,等. 藜麦籽粒主要营养及抗氧化成分遗传特性分析与评价[J]. 云南农业大学学报(自然科学版),2020,35(6):931-937.
[22]魏振飞,白永新,张润生,等. 藜麦高产栽培技术[J]. 现代农业科技,2020(21):38-39.
[23]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[24]邹 琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2000.
[25]庞亚琴,任彩婷,徐秋曼. 解淀粉芽孢杆菌HM618对镉胁迫下小麦幼苗生长的影响[J]. 天津师范大学学报(自然科学版),2018,38(4):55-59.
[26]王爱云,黄姗姗,钟国锋,等. 铬胁迫对3种草本植物生长及铬积累的影响[J]. 环境科学,2012,33(6):2028-2037.
[27]蔡春婷,汤克丽,许旭萍,等. 镉铅复合胁迫下根表铁锰氧化胶膜厚度对美洲商陆富集镉的影响[J]. 环境科学学报,2017,37(1):298-307.
[28]王丽娜,任翠梅,王明泽,等. 中国藜麦种质资源分布及研究现状[J]. 黑龙江农业科学,2020(12):142-145.
[29]李小宁. 锌胁迫对小麦种子萌发及幼苗生理生化特性的影响[D]. 兰州:西北师范大学,2013.
[30]孙立荣,崔香环,廖立冰,等. 外源水杨酸对Cu2+胁迫下小麦幼苗中活性氧和抗氧化酶的影响[J]. 河南大學学报(自然科学版),2008,38(2):176-180.
[31]Jacobsen S E.The worldwide potential for quinoa (Chenopodium quinoa Willd.)[J]. Food Reviews International,2003,19(1/2):167-177.
[32]Bhargava A,Shukla S,Ohri D. Chenopodium quinoa—An Indian perspective[J]. Industrial Crops and Products,2006,23(1):73-87.
[33]Jacobsen S E,Mujica A,Jensen C R.The resistance of quinoa (Chenopodium quinoa Willd.) to adverse abiotic factors[J]. Food Reviews International,2003,19(1/2):99-109.
[34]张永平,范红伟,杨少军,等. 外源水杨酸对镉胁迫下甜瓜幼苗生长、光合作用和活性氧代谢的缓解效应[J]. 植物生理学报,2014,50(10):1555-1562.
[35]贾 茵,刘才磊,兰晓悦,等. 外源水杨酸对镉胁迫下小报春幼苗生长及生理特性的影响[J]. 草地学报,2020,28(5):1346-1354.
[36]黄玉梅,张杨雪,刘庆林,等. 水杨酸对盐胁迫下百日草种子萌发及幼苗生理特性的影响[J]. 草业学报,2015,24(7):97-105.
[37]王立红,李星星,孙影影,等. 外源水杨酸对NaCl胁迫下棉花幼苗生长生理特性的影响[J]. 西北植物学报,2017,37(1):154-162.
[38]黄 程,文小梅,唐 殷,等. 外源水杨酸对盐胁迫下小白菜幼苗生理的影响[J]. 江苏农业科学,2020,48(7):147-151.
[39]侯 爽,陈锦芬,刘溶荣,等. 外源水杨酸对烟草幼苗低温胁迫的缓解效应[J]. 湖南农业大学学报(自然科学版),2020,46(1):14-20.
[40]马乐元,陈年来,韩国君,等. 外源水杨酸对干旱胁迫下小冠花种子萌发及幼芽生理特性的影响[J]. 应用生态学报,2017,28(10):3274-3280.
3971500338294
