GDNF基因修饰的NSCs联合EPO通过Nrf2-COX2/iNOS保护帕金森小鼠神经功能
2022-03-10王淑华周正丽汤华军李开荣孙国刚胡光强
王淑华,周正丽,汤华军,王 云,李开荣,孙国刚,胡光强,陈 波
西南医科大学:1.口腔医学专业;2.基础医学院人体解剖学教研室(泸州 646000)
帕金森病(Parkinson’s disease,PD)患者一个主要特征是中脑的黑质内大量多巴胺能神经元的缺失和纹状体多巴胺的缺失。目前认为多巴胺与神经元的退化变性与氧化应激、神经炎症、凋亡及衰老等因素有关[1-3]。多巴胺受体激动剂或外源性补充多巴胺目前仍是主要治疗手段,但帕金森病属于一种进展性疾病,药物治疗也只是控制症状,而不能阻止疾病的发展。近年来神经干细胞、诱导多能干细胞、间充质干细胞、胚胎干细胞等干细胞替代治疗在PD治疗中显示出巨大的潜力,可在不同程度上改善PD,但仍存在一些问题,比如遗传和表观遗传异常、多巴胺能神经元的低产量以及细胞治疗的安全性等[4]。
神经胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)主要是多巴胺能神经营养因子,而GDNF 是维持神经元形态和神经化学表型,保护多巴胺(dopamine,DA)神经元免受毒性损伤所必需的生物因子[5]。促红细胞生成素(erythropoietin,EPO)在神经退行性疾病动物模型中已被证明具有抗氧化、抗炎和神经保护作用,也可以促进血管生成[6]。GDNF 和EPO 联合应用可提高移植物疗效,加速功能恢复。目前检索文献未见GDNF基因修饰的NSCs与EPO 联合治疗PD 的报道。在本研究中,我们推测GDNF基因修饰的NSCs 与EPO 的联合将具有协同作用,增强其对PD模型小鼠的神经保护作用。
1 实验材料
1.1 主要试剂
C57BL/6 小鼠神经干细胞(MUBNF-01001)及其完全培养基(MUBNF-90011)均购自Cyagen Biosciences 公司;重组腺病毒pAdTrack CMV-GDNF plasmid 来自西南医科大学基础医学研究中心神经生物研究室;MPTP(M0896,Sigma);EPO(CYT-201,Propsec);组织线粒体分离试剂盒(C3606,Beyotime);线粒体膜电位分析试剂盒JC-1(C2006,Beyotime);Transcriptor First strand cDNA synthesis kit(04896866001,Roche);qPCR SYBR Green Master Mix(Q111-03,Vazyme)。
1.2 实验动物
健康雄性C57BL/6 小鼠120 只,体重22~25 g,购自西南医科大学实验动物中心。饲养房温度24 ℃,自由饮食水。实验动物操作和处理符合西南医科大学实验动物伦理委员会对动物实验的伦理要求(动物实验伦理批准号:SWMU201803147)。
2 实验方法
2.1 重组腺病毒pAdTrack CMV-GDNF转染NSCs
将NSCs接种至6 cm培养皿中,待细胞生长至融合度为90%时,用0.25%胰酶消化收获细胞吹打成单细胞悬液,调整细胞密度1×105/mL,接种于24孔板,每孔接种250 μL。次日每孔加入5 μL pAdTrack CMV-GDNF重组腺病毒质粒(1.2×108TU/mL),混匀后置孵箱,培养4 h 后,各孔再添加250 μL 完全培养基,培养24 h后,撤病毒液更换正常培养基并用嘌呤霉素筛选后扩增备用。
2.2 MPTP诱导PD模型、分组及各组处理
成年C57BL/6 雄性小鼠120只随机分为8组,正常组(Normal)、假手术组(Sham)、模型组(MPTP)、Sham+EPO 组、Sham+GDNF-NSCs 组、MPTP+EPO 组、MPTP+GDNF-NSCs 组和MPTP+GDNF-NSCs+EPO组,每组15 只。MPTP 无菌生理盐水稀释后按照35 mg/kg 腹腔注射,1 次/d,连续7d;动物出现暂时性躯干震颤、竖毛、尾巴过伸等症状,按照震颤麻痹评分表(表1)评估建模是否成功,评分不低于2分者纳入后续实验。MPTP 建模结束后,小鼠麻醉后置于小鼠脑定位仪(51730U,Stoelting 公司)上。参考《小鼠脑立体定向图谱》第二版(澳大利亚George Paxinos 教授和加拿大Keith B.J.Franklin教授合编)确定纹状体移植坐标(前囟后1.0 mm,中线旁开2.0 mm,深度2.5 mm)。用5 μL微量注射器,每只小鼠接受3 μL细胞悬液(2×105),左、右侧纹状体各注射1.5 μL 细胞悬液。注射速度约0.5 μL/min,停针10 min 后缓慢退针,针孔用无菌骨蜡封口。Sham组纹状体注射等体积生理盐水。

表1 震颤麻痹评分Table 1 Paralysis tremor scores
2.3 小鼠行为学评估旋转实验和爬杆实验
建模前及建模后第7、14、28和42 d对各鼠进行行为学检测,旋转实验时所有小鼠在一根直径约3 cm的旋转杆上训练获得统一基线水平后才开始MPTP 注射。旋转杆转速每分钟25 圈,每次杆上维持不超过5 min,间隔5 min,连续3次。正式实验时记录大鼠在180 s内杆上持续时间,间隔5 min旋转3次取平均值。爬杆实验正式实验前也训练至统一基线水平,所有小鼠在一根长30 cm,宽8 mm的竖立的杆上训练。头放置于杆顶部,记录小鼠爬到杆底部的时间。正式实验时,小鼠每次爬杆3次,记录时间取平均值。
2.4 纹状体多巴胺含量测定
行为学评分结束后,迅速断头后取脑,冰上分离纹状体,称重后将纹状体放入1 mL冰冷溶液(含0.1 mol/L高氯酸和0.4 mol/L亚硫酸钠)中,用玻璃匀浆器手动匀浆。离心后取少量匀浆液用BCA 蛋白定量试剂盒测总蛋白。余下组织匀浆液在4 ℃,10 000 r/min离心15 min后取上清液,再用0.45 μm 孔径一次性滤过器过滤,滤液进行高效液相-电化学法测DA 含量。电化学检测器(UltiMate®3000 ECD-3000RS,美国)电压0.7 V,进样量20 μL,流速0.6 mL/min。最后计算纹状体内总DA含量,结果用μg/g 组织总蛋白表示。
2.5 纹状体线粒体提取及膜电位检测
根据组织线粒体分离试剂盒说明分离收集纹状体线粒体沉淀,线粒体膜电位检测参照JC-1试剂盒说明步骤进行。JC-1单体和聚合物激发后分别发绿色和红色荧光,以红、绿荧光的比值代表线粒体的膜电位高低。比值越高,说明线粒体的膜电位越高。
2.6 纹状体组织Nrf2、COX2和iNOS基因检测
纹状体取出后,采用常规Trizol 法提取组织总RNA。使用cDNA 逆转录试剂盒和SYBR Green Master Mix分别进行逆转录和荧光定量PCR。各基因引物合成来自上海生工生物工程股份有限公司(表2)。荧光定量PCR 仪(Bio-Rad CRX96TM,美国)反应条件:预变性95 ℃,5 min;循环反应95 ℃,10 sec、60 ℃,30 sec,39个循环;融解曲线95 ℃,15 sec、60 ℃,60 sec、95 ℃,15 sec。

表2 Nrf、COX2和iNOS基因引物Table 2 Primers of Nrf,COX2 and iNOS
2.7 统计学分析
用SPSS 22.0软件进行数据分析,计量资料均用均数±标准差()表示。以测定时间点为重复测量因素和组内因素,处理方式为组间因素,采用重复测量方差分析时间和组别交互作用是否对测量因素有显著影响,Tukey事后检验分析组间差异,P <0.05为差异具有统计学意义。
3 结果
3.1 行为学
旋转实验分析结果显示组别与时间之间有交互作用(F交互=7.924,P <0.001),不同时间点对杆上持续时间有显著影响(F=2 448.312,P <0.001)。在MPTP 注射后第7 d,模型鼠在180 s 内杆上持续时间较正常组、Sham组、Sham+EPO组和Sham+GDNF-NSCs组明显下降。EPO、GDNF-NSCs 和GDNF-NSCs+EPO 干预后在第14、28 和42 d 杆上持续时间均较第7 d 显著增加(P <0.001)。第28 d 时,MPTP+GDNF-NSCs+EPO 组增加较MPTP+GDNF-NSCs 组(P <0.001)和MPTP +EPO 组(P <0.001)更明显。第48 d,MPTP+EPO 组和MPTP+GDNF-NSCs 组大鼠杆上持续时间下降,但MPTP+GDNF-NSCs+EPO 组大鼠杆上持续时间仍呈上升趋势,且这种上升趋势较单独干预的MPTP+EPO组(P <0.001)和MPTP+GDNF-NSCs 组(P <0.001),差异具有统计学意义(表3)。

表3 MPTP诱导建立小鼠帕金森模型,经EPO、GDNF-NSCs和两者联用干预后评估各组不同时间旋转行为学时间变化(s)Table 3 MPTP-induced Parkinson's mouse model,and the time changes of rotation behavior in each group at different time points were evaluated after EPO,GDNF-NSCs and their combined intervention(s)
爬杆实验分析结果显示组别与时间之间有交互作用(F交互=3.694,P <0.001),对杆上下来时间影响显著,不同时间点之间也存在显著差异(F=232.023,P <0.001)。在MPTP 注射后第7 d,模型鼠从杆上下来时间较正常组和Sham 组明显增加(P <0.001)。EPO、GDNF-NSCs 和GDNF-NSCs+EPO 干预后在第14、28和42 d 从杆上下来时间均较第7 d 显著降低(P <0.001)。第14、28 和42 d 时MPTP+GDNF-NSCs+EPO组(P <0.001)和MPTP+GDNF-NSCs 组(P=0.015)下杆时间均较MPTP+EPO 组下降更显著,但MPTP +EPO 组爬杆时间没有明显变化,联合干预组爬杆时间进一步下降接近正常组(表4)。
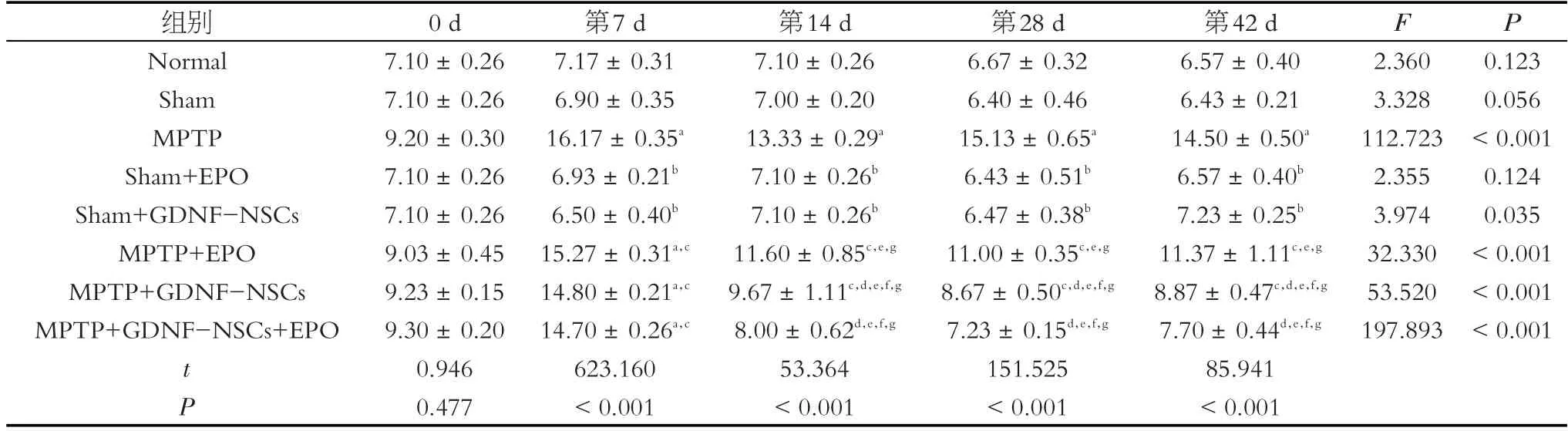
表4 MPTP诱导建立小鼠帕金森模型,经EPO、GDNF-NSCs和两者联用干预后评估各组不同时间爬杆行为学时间变化(s)Table 4 MPTP-induced Parkinson's mouse model,and the time changes of pole climbing behavior in each group at different time points were evaluated after EPO,GDNF-NSCs and their combined intervention(s)
3.2 纹状体多巴胺含量
纹状体多巴胺含量分析结果显示组别与时间之间有交互作用(F交互=6.559,P <0.001),对纹状体多巴胺含量影响显著。不同时间点之间也存在显著差异(F=1 159.502,P <0.001)。MPTP注射第7 d,小鼠纹状体多巴胺含量较正常组明显下降(P <0.001)。GDNF-NSCs、EPO 和联用治疗后,在第14、28 和42 d 纹状体多巴胺含量均较第7 d 显著增加(P <0.001),也均较MPTP 模型组明显增加(P <0.001)。单纯EPO 治疗组随时间延长呈下降趋势,而联用治疗组随时间延长较MPTP+GDNF-NSCs组(P <0.001)和MPTP+EPO组(P <0.001)增加更明显(表5)。
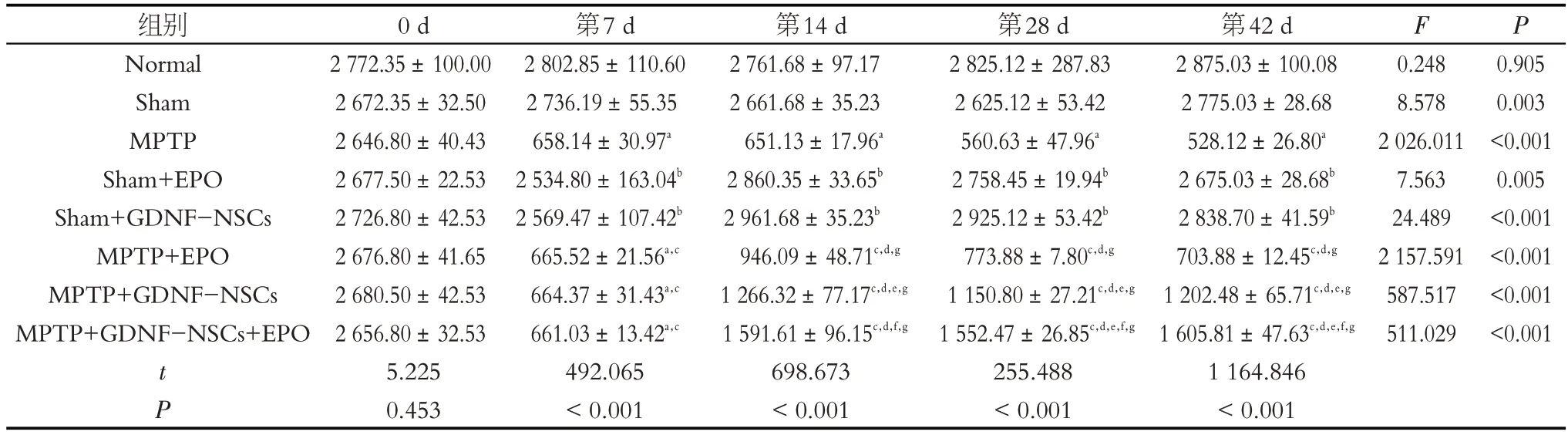
表5 小鼠纹状体多巴胺含量变化(ng/g)Table 5 Changes of dopamine content in striatum of mice(ng/g)
3.3 纹状体线粒体膜电位
纹状体线粒体膜电位分析结果显示组别与时间之间有交互作用(F交互=4.187,P <0.001),对纹状体线粒体膜电位影响显著。不同时间点之间也存在显著差异(F=501.359,P <0.001)。MPTP 注射后第7 d,小鼠纹状体线粒体膜电位较正常组和Sham 组明显下降。GDNF-NSCs、EPO 和联合干预后,在第14、28 和42 d时,三组线粒体膜电位均较第7 d时显著增加。在第14、28 和42 d,GDNF-NSCs 和联合干预组也较MPTP 组线粒体膜电位显著增加。EPO 治疗在第14、28 和42 d 时没有显著差异。联合治疗组在第14、28和42 d时线粒体膜电位也较单纯GDNF-NSCs治疗组显著增加(表6)。

表6 小鼠纹状体线粒体膜电位(红/绿,%)变化Table 6 Changes of mitochondrial membrane potential(red/green,%)in striatum of mice
3.4 纹状体组织抗氧化相关基因表达
荧光定量PCR 检测抗氧化基因Nrf2、COX2和iNOS表达结果分析显示:组别与时间之间有交互作用(Fnrf2交互=2.256,P=0.004;Fcox2交互=4.329,P <0.001;Fi-NOS交互=7.905,P <0.001),均对纹状体抗氧化相关基因影响显著。在不同时间点检测也存在显著差异(Fnrf2=46.569,P <0.001;Fcox2=1 544.488,P <0.001;FiNOS=3 232.150,P <0.001)。MPTP 腹腔连续注射7 d 时MPTP组、MPTP+EPO 组、MPTP+GDNF-NSCs 组和MPTP+GDNF-NSCs+EPO 组 纹 状 体Nrf2、COX2和iNOS的mRNA 水平均较Normal 组和Sham 组显著增加(P <0.001)。在第14、28和42 d 时,GDNF-NSCs 及联合干预后,Nrf2、COX2和iNOS的mRNA水平均较第7 d时显著降低;在第28、42 d 时,EPO 干预组Nrf2、COX2和iNOS的mRNA 水平均较第7、14 d 时显著降低(P <0.001);联合干预组COX2和iNOS的mRNA 水平在第14、28 和42 d 时也较GDNF-NSCs 干预组显著降低(P <0.001)(表7,8,9)。

表7 各组不同时间点小鼠纹状体Nrf2基因表达变化Table 7 Changes of Nrf2 gene expression in striatum of mice at different time points in each group
4 讨论
帕金森病已经成为社会人群中主要的中枢神经退行性疾病之一,研究资料提示,遗传因素为PD 的主要根源,环境因素是诱导因素,氧化应激、免疫异常等是发病表现。目前左旋多巴仍为治疗PD 的一线临床药物,是PD 患者因多巴胺分泌不足采用的替代疗法,治标不治本。因此,需要寻找新的治疗方法,本文利用GDNF基因修饰的NSCs 联合EPO 治疗帕金森小鼠,显示两者联用在针对多巴胺含量、线粒体膜电位、抗氧化相关基因的表达方面,较单一治疗有明显优势,且两者联用治疗效果能持续到建模后42 d;联用组行为学检测旋转实验和爬杆实验也显示相似的趋势,提示两者联用使帕金森小鼠的神经功能得到明显改善。PD最主要病理改变是中脑黑质多巴胺能神经元的变性死亡而引起纹状体DA 含量的显著性减少。有文献报道在MPTP 诱导的大鼠[7]和非人灵长类动物[8]帕金森疾病模型中,GDNF均显示对黑质纹状体神经元的保护作用。由于GDNF 不能透过血脑屏障,并且脑室内给药有强烈的副作用[9],因此目前主要通过构建过表达GDNF基因的各类病毒载体,如腺病毒[10]、腺相关病毒[11]等病毒载体或者构建过表达GDNF基因干细胞,如间充质干细胞[12]、神经干细胞[13]等干细胞,经静脉或脑内定向注射给药。本文用GDNF基因修饰的神经干细胞治疗帕金森小鼠也显示出治疗有效性,和文献报道是一致的。
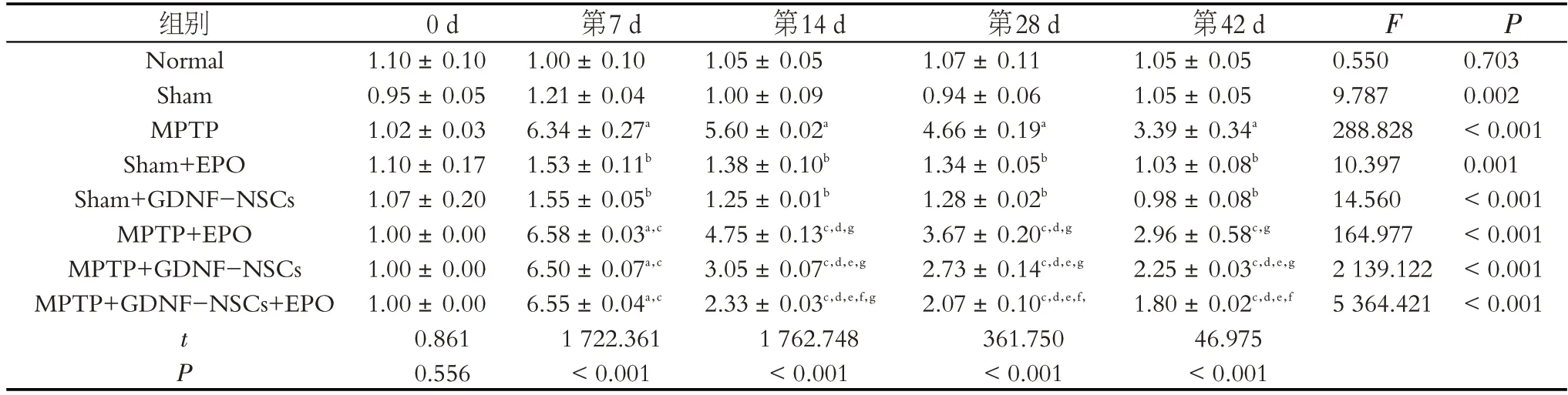
表8 各组不同时间点小鼠纹状体COX2基因表达变化Table 8 Changes of COX2 gene expression in striatum of mice at different time points in each group

表9 各组不同时间点小鼠纹状体iNOS基因表达变化Table 9 Changes of iNOS gene expression in striatum of mice at different time points in each group
氧化应激和神经炎性是帕金森疾病多巴胺能神经退变的早期事件,也是帕金森疾病的成因之一。脑富含线粒体,而线粒体是细胞内活性氧的主要来源,其膜电位的下降是细胞早期凋亡的一个标志性事件。研究结果显示GDNF-NSCs 能在较长时间内持续增加线粒体膜电位,在联用EPO 后,这种改变更显著。EPO 是由肾小管周围间质细胞和肝脏分泌的一种激素样物质,能够增强机体对氧的结合、运输和供应能力,一方面有利于纹状体内移植的神经干细胞存活,另一方面,可缓解脑内多巴胺能神经元凋亡[14]。已有文献报道,在帕金森疾病模型中,EPO 发挥神经保护作用依赖于PI3K/Akt/FoxO3a 信号通路的激活,减少纹状体神经元凋亡,显著改善帕金森疾病模型的功能评分[15]。本文利用GDNF-NSCs 和EPO 联用显示出治疗帕金森疾病的协同效应,提示治疗帕金森疾病多巴胺能神经元早期凋亡程度有所减轻。
Nrf2是目前已知的内源性抗氧化应激关键蛋白之一,对外源性氧化刺激敏感,激活后从细胞骨架解离进入核内,和抗氧化反应元件结合,启动下游数百种抗氧化、抗炎及抗凋亡相关基因的表达[16]。已有文献报道Nrf2/ARE信号在电针治疗帕金森疾病中发挥抗氧化作用[17]。在帕金森疾病模型中纹状体COX2基因表达增加使运动功能障碍更甚[18]。iNOS可存在于内皮细胞、巨噬细胞、神经吞噬细胞及神经细胞中,在不同脑区呈选择性分布,在帕金森患者脑内,iNOS 表达增加[18]。在啮齿类动物研究中也显示iNOS 表达增加在慢性炎症过程及其他一些疾病中可能起有害作用,抑制iNOS表达能减轻帕金森疾病运动功能障碍并阻止COX2表达增加[19]。所以,抗炎和抗氧化应激在帕金森疾病治疗中有重要价值。研究结果显示,治疗组纹状体Nrf2基因表达均较帕金森模型组增加,且GDNF-NSCs组显著增加;COX2基因和iNOS基因表达均较模型组减少,且GDNF-NSCs 组下降更显著,提示GDNF-NSCs 治疗帕金森疾病的可能机制是通过增加Nrf2基因表达、下调iNOS和COX2 基因表达达到抗氧化应激和抗炎等作用。但同时也发现,即使使用GDNF-NSCs 和EPO 联合治疗帕金森模型小鼠,小鼠的行为学功能也不能恢复到正常水平,由于帕金森疾病病因仍不清楚,该治疗方法仍有局限性,有待进一步深入研究,寻找更好的治疗方法。
5 结论
GDNF基因修饰的NSCs联合EPO可能通过增加氧化应激抵抗发挥帕金森小鼠神经保护作用。基于GDNF基因修饰的神经干细胞联合EPO治疗帕金森病有一定的应用价值。
(利益冲突:无)
