大豆籽粒大小遗传调控研究现状
2022-03-10余晗张红香袁珊
余晗,张红香,袁珊
(1.中国科学院 东北地理与农业生态研究所,吉林 长春 130102;2.中国科学院大学,北京 100049;3.中国农业科学院 作物科学研究所 农业农村部北京大豆生物学重点实验室,北京 100081)
0 引 言
随着国民经济的发展和人民生活水平的提高,我国对于植物油及饲用蛋白的需求量持续增加。大豆(Glycinemax(L.)Merr.)是世界重要的高蛋白粮油兼用作物,为人类食物和动物饲料提供60%左右的蛋白质,为全球提供约30%的脂肪[1]。我国虽然是大豆的原产地,但大豆生产发展缓慢,单产水平较低,对国际大豆的依赖性很强,进口量达总需求量的80%,占全球贸易量的65%以上[2]。因此,亟需培育高产品种,以满足大豆产业发展需求[3]。
提高大豆单产是我国现阶段育种工作的关键目标。大豆单产由单位面积株数、单株粒数和百粒重共同决定。过去多年大豆审定品种的各项农艺指标对产量的贡献分析表明,单产增加的主要驱动因素是单株粒数的增多,籽粒大小并不是育种选择的首要性状[4-5]。并非籽粒大小不重要,主要是植物自身通常会对籽粒的大小和数量进行权衡,故传统育种手段难以选择两者兼顾的优良材料[6]。但近年来有研究表明,籽粒大小和数量控制基因是存在独立进化的,籽粒大小也受到定向选择,因此,籽粒大小仍然是一个重要且有效的选择性状,有待深入挖掘[7-9]。大豆籽粒大小不仅是产量的主要构成因素[10],也是重要的外观商品性状[11-12]。参照国家标准,小粒大豆百粒重一般为5~10 g[13],可用于制作发酵大豆(纳豆)和豆芽;大粒大豆一般大于25 g[13],可用于菜用(毛豆)、制油以及大豆食品(豆浆、豆腐等)加工[14]。较大的籽粒不仅能为种子萌发代谢过程提供充足的能量,还可保障其在幼苗生长过程中的竞争力[15]。
植物种子(籽粒)通常是由二倍体胚、三倍体胚乳和种皮3部分组成,它们共同协调发育控制,最终决定种子的大小[16]。在拟南芥(Arabidopsisthaliana)和大豆(图1)等双子叶植物发育后期,胚消耗掉胚乳发育成成熟种子的主体,母本珠被发育成种皮,包被着胚和胚乳[17]。尽管胚乳细胞在成熟种子中只剩下一层,但胚乳的细胞分裂同种子的大小却是直接相关的[18]。植物中调控籽粒大小的信号通路主要包括:泛素-蛋白酶途径、丝裂原活化蛋白激酶(MAPK)信号途径、转录调控、G蛋白信号途径、IKU通路和植物激素等[7,19-20]。其中,多个信号通路通过母本的种皮来控制籽粒大小,胚和胚乳的变化主要受到IKU通路和部分植物激素的调节影响,表观遗传修饰也起到一定作用[21]。籽粒大小作为典型的数量性状,其遗传特征和分子机制是复杂的。但在模式作物中,调节籽粒大小的多个因子功能保守,且随着技术的发展,科学家们发现分子标记辅助选择(Marker-assisted selection,MAS)、基因组选择(Genomic selection,GS)、转基因技术和基因组编辑技术等先进的分子育种方法和技术具有打破大豆传统育种壁垒,突破作物产量的潜力[22]。因此,籽粒大小性状调控研究的应用前景广阔。
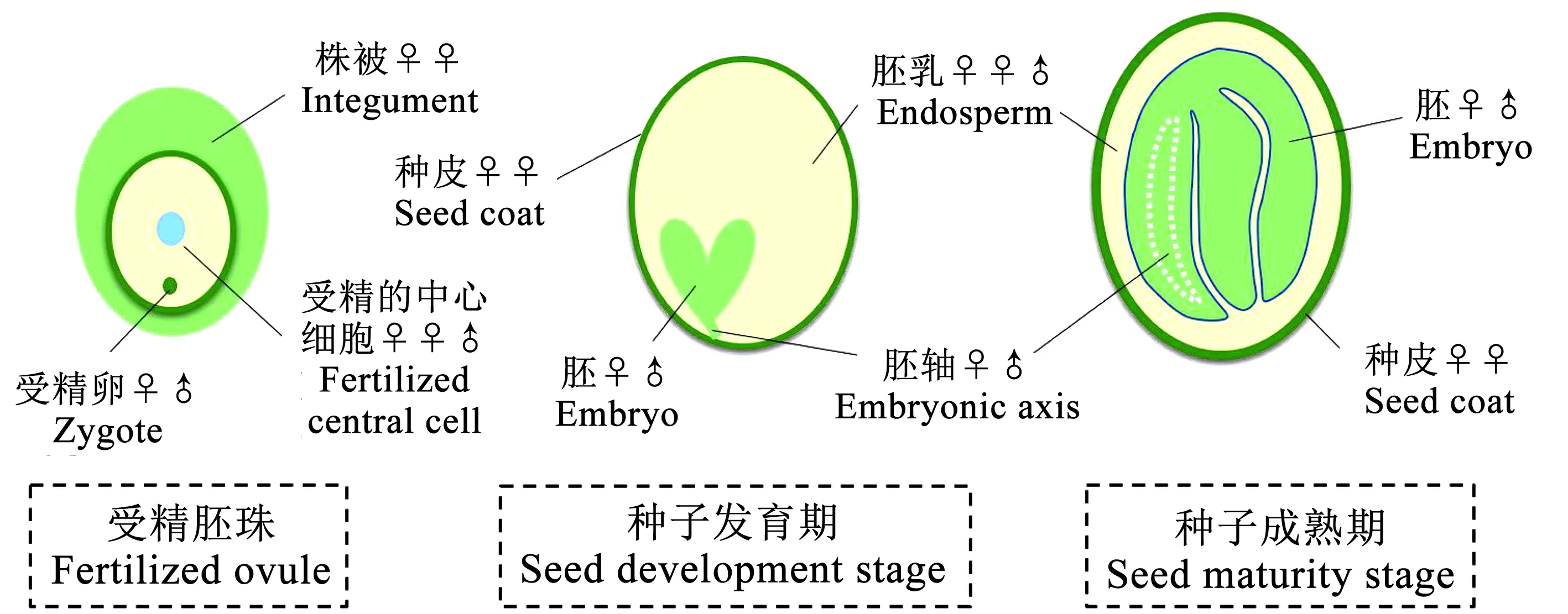
图1 大豆籽粒发育阶段示意图(改编自Sundaresan等[23])Fig.1 Schematic diagram of developmental stages of soybean seeds(revised from Sundaresan et al[23])
本文从定位调控籽粒大小基因的技术方法和籽粒大小调控分子机制两方面综述了近年来有关大豆籽粒大小性状调控的研究进展,以期为未来大豆籽粒大小分子育种研究提供理论参考。
1 定位与克隆调控大豆籽粒大小基因的技术方法
在过去的20多年里,随着全基因组关联分析(Genome-wide association,GWAS)、分子遗传标记和数量性状位点(Quantitative trait loci,QTL)连锁分析(Linkage analysis)、转基因工程和基因编辑技术创制突变体材料等多种技术的兴起,国内外研究者借助上述方法逐步解码大豆种子发育的分子调控机制。其中,大豆遗传图谱的建立和分子标记技术的应用促进了对大豆群体中重要数量性状QTL的鉴定。通过遗传图谱的构建和QTL定位分析方法,使研究人员能够鉴定大豆中与籽粒大小相关的调控遗传变异QTL数量[24],对于大豆高产和优质育种具有重要的指导意义。
目前已报道与大豆籽粒重相关的QTL位点309个(www.soybase.org),但大多数位点未得到功能验证。利用大豆双亲后代分离群体进行的QTL定位方法中,低密度标记的数量通常足以覆盖不同定位群体,从而鉴定出大量与目标性状关联的QTL。其中,将连锁分析和全基因组关联分析两种强大的工具联合共同研究籽粒大小表型差异和潜在QTL位点的关系是现阶段卓有成效的研究方式(表1)。
1.1 连锁分析
连锁分析是以遗传连锁图谱为基础,以往的研究多采用籽粒大和籽粒小的亲本组合创建高代群体,后代产生籽粒大小性状的分离,一般采用单区间作图法(Interval mapping,IM)、复合区间作图法(Composite interval mapping,CIM)和完备区间作图法(Inclusive composite interval mapping,ICIM)等进行数量性状的表型值与分子标记间的连锁分析。若研究具有足够的样本大小,结果通常具有较高的精度,目前已通过连锁分析方法鉴定出大量大豆籽粒大小/重量相关的QTL[25-36](表1)。
早在1996年,Mian等[25]就利用两对亲本组合Young(高产品种)×PI416937(抗旱品种)和COKER23(大籽粒)×PI9710(小籽粒)分别杂交形成的120个F4群体和111个F2群体对大豆粒重进行QTL分析,分别发现了7个和9个QTL与大豆粒重相关,然而,并未检测到这些F4群体和F2群体有交集的QTL。在众多的研究中,Kato等[26]采用的亲本品种中的籽粒百粒重最大(百粒重35.6 g),实验以来自美国和日本的大豆品种Ohsuzu(百粒重32.7 g)×Athow(百粒重19.2 g)和Stressland(百粒重16.3 g)×Tachingagaha(百粒重35.6 g)分别杂交获得重组自交系,确定了2个群体内11条染色体上共15个与百粒重显著相关的QTL,其中17号染色体中的qSw17-1在两个群体以及多个环境下均被检测到对百粒重有显著影响,此位点可用于分子标记辅助选择,并可作为未来候选基因鉴定的靶向QTL。而Karikari等[27]采用的亲本品种中的籽粒百粒重最小(1.33 g),此研究以大豆品种南农493-1(百粒重17.4 g)和野生大豆品系PI 342618B(百粒重1.3 g)为材料,通过单粒亲本(SSD)法获得了一个由161个亲本组成的种间RIL群体,通过高密度种间连锁图谱,在4个环境中检测到8个多环境下稳定的百粒重QTLs。其中qSW-17-1和qSW-17-4为主效QTL(R2>10%),并预测5个稳定QTL内的29个基因可能是调控大豆粒重/粒大小的候选基因。在鉴定的QTL数量上,Liu等[28]以Zhongpin03-5373和中黄13杂交的F8重组自交系群体(RIL)鉴定出最多的相关QTL(18个)。
以往对大豆籽粒大小连锁分析鉴定出的QTL数量并未与其子代群体大小成正比,这可能与每个研究采用的亲本组合、群体代数和分析方法有关。在不同的遗传背景和环境下,前期的研究主要集中在对大豆籽粒大小/重量主效QTL的鉴定上。然而,很多研究并未找到主效QTL且在理解复杂的遗传相互作用效应(如上位性和环境效应)方面仍需要深入的探究。
1.2 关联分析
除了利用连锁分析对大豆粒大小/粒重进行QTL定位之外,全基因关联分析也被应用到相关基因的定位挖掘之中。关联分析是以自然群体或种质资源为研究对象,以连锁不平衡为基础,应用数百万计SNP分子遗传标记,对目标性状的遗传因素进行相关性分析。相比于连锁分析,关联分析具有快速、高通量、高分辨率的优点,在大豆种质资源选择群体中鉴定出对种子质量有显著影响的QTL[37-42](表1),这些位点和候选基因为进一步研究大豆籽粒大小相关性状的调控机制奠定了基础。

表1 大豆籽粒大小/重量相关数量性状基因座Table 1 The quantitative trait loci of soybean seed size or weight
关联分析不需要构建专门的作图群体,以往研究多采用一般线性模型(General linear model,GLM)和混合线性模型(Mixed linear model,MLM)方法。Copley等[37]采用的大豆引种株系数量最少(86个),此研究利用基因分型测序和微阵列方法,发现31 283个连锁不平衡SNPs,GWAS分析检测到5个与百粒重相关的基因位点。而Zhang等[38]采用的大豆种质资源材料数量最多(309份),此研究利用31 045个SNPs进行全基因组关联分析,结果表明与粒重相关的位点有22个,其中在Chr4和Chr19上呈现热点,且这些位点的混合模型解释了83.4%的表型变异。在鉴定出的QTL数量上,Li等[39]通过对133个大豆地方品种的82187个SNPs连续两年的数据进行了全基因组关联分析,检测到最多的百粒重相关位点(63个)。此外,Li等[40]的研究除了鉴定出了21个与种子大小性状相关的位点之外,又在第9染色体上发现了一个新的基因座SW9-1,该基因座解释了10.05%~10.93%的种子重量变异与种子大小性状的显著相关。
大豆籽粒大小属于典型的数量性状,受不同的遗传因素控制,存在多个主效QTL位点。以往的研究结果为大豆籽粒大小相关基因精细定位、编辑和分子机制研究奠定了基础。虽然定位到大量籽粒大小和百粒重的QTLs,然而现阶段却很少在大豆育种项目中直接应用,究其原因可能是:其一,对已筛选出的众多基因具体功能了解不明确,仍需深入研究;其二,很多的QTL定位区间并没有精细化,其位点对应的主效基因及基因效应在很大程度上仍然未知;其三,因籽粒大小与籽粒数量存在权衡关系,作用于大豆籽粒大小上的基因可能并未对大豆育种工作提供产量和品质整体上的改进。因此,对这些基因进行更明确的功能研究,更完善的效率评估和进一步工程化利用将会是未来的研究重点。
2 大豆籽粒大小调控分子机制研究进展
目前大豆有多个基因被鉴定参与籽粒大小和粒重的调控过程(表2)。其中,鉴定出的部分基因与种皮、胚和胚乳发育相关,而部分基因与植物激素相关,都在大豆籽粒大小调控中发挥重要作用(图2),这些研究确定了多个可以提高大豆籽粒大小/重量的优良等位基因,未来或许可以通过引入该类等位基因改善大豆作物的产量,而部分基因的分子作用机理及调控部位仍需更多的探索。

表2 大豆籽粒大小/重量发育相关的基因Table 2 Genes associated with the development of soybean seed size/weight
2.1 大豆种皮发育调控
大豆中已被鉴定出许多基因通过调控种皮的发育过程来影响其籽粒大小。KLUH/CYP78A编码蛋白细胞色素P450(CYP450),通过控制珠被发育过程的细胞增殖,从而决定种皮的生长潜力,正向调控种子大小[43-46]。大豆中含有2个CYP78A10同源基因(GmCYP78A10a和GmCYP78A10b),分别存在于野生大豆和栽培大豆中,其中GmCYP78A10b与大豆粒重和形状更为相关[47]。此外,CYP78A5在大豆中的同源基因GmCYP78A57、GmCYP78A70、GmCYP78A72[48-49]和GmCYP78A5[50]能够正向调控籽粒大小/粒重。GmCYP78A72在绿色豆荚和子房中表达,且过表达后籽粒大小明显增加,但敲除该基因后籽粒并没有变小。进一步研究发现,GmCYP78A57、GmCYP78A70和GmCYP78A72三者在籽粒大小发育中共同作用且功能可能存在冗余[48]。对大豆GmCYP78A5过表达发现,其转基因植株籽粒大小显著增大[50]。此外,宿洋等[51]发现4个与大豆籽粒大小/粒重相关基因,其中Glyma.13G261700含有P450蛋白结构域,通过参与次生代谢物的生理过程影响大豆籽粒大小/粒重。以上结果表明,KLUH/CYP78A信号通路在植物个体发育过程中对种子大小的调节发挥关键作用,同时也为植物进化中种子大小的调节提供了可能的靶点,在作物改良方面具有很大的潜力。然而,CYP78A亚家族基因的调控通路和作用机理仍需更多的研究。
以往研究发现,泛素蛋白受体DA1能够通过调控母本种皮内细胞的增殖负调控种子的大小。泛素特异性蛋白酶15(UBP15)是一种去泛素化酶,作为下游靶点与DA1作用发生裂解从而促进细胞增殖和种子生长,ubp15/sod2突变体由于细胞增殖减少而产生小的种子和器官[52],进一步验证了UBP15对种子大小的正向调控作用。大豆基因Glyma.13G259700为拟南芥UBP15/SOD2基因的同源基因,编码泛素水解酶,参与无机离子的转运与代谢等生理活动,正向调控大豆籽粒大小/粒重[51]。
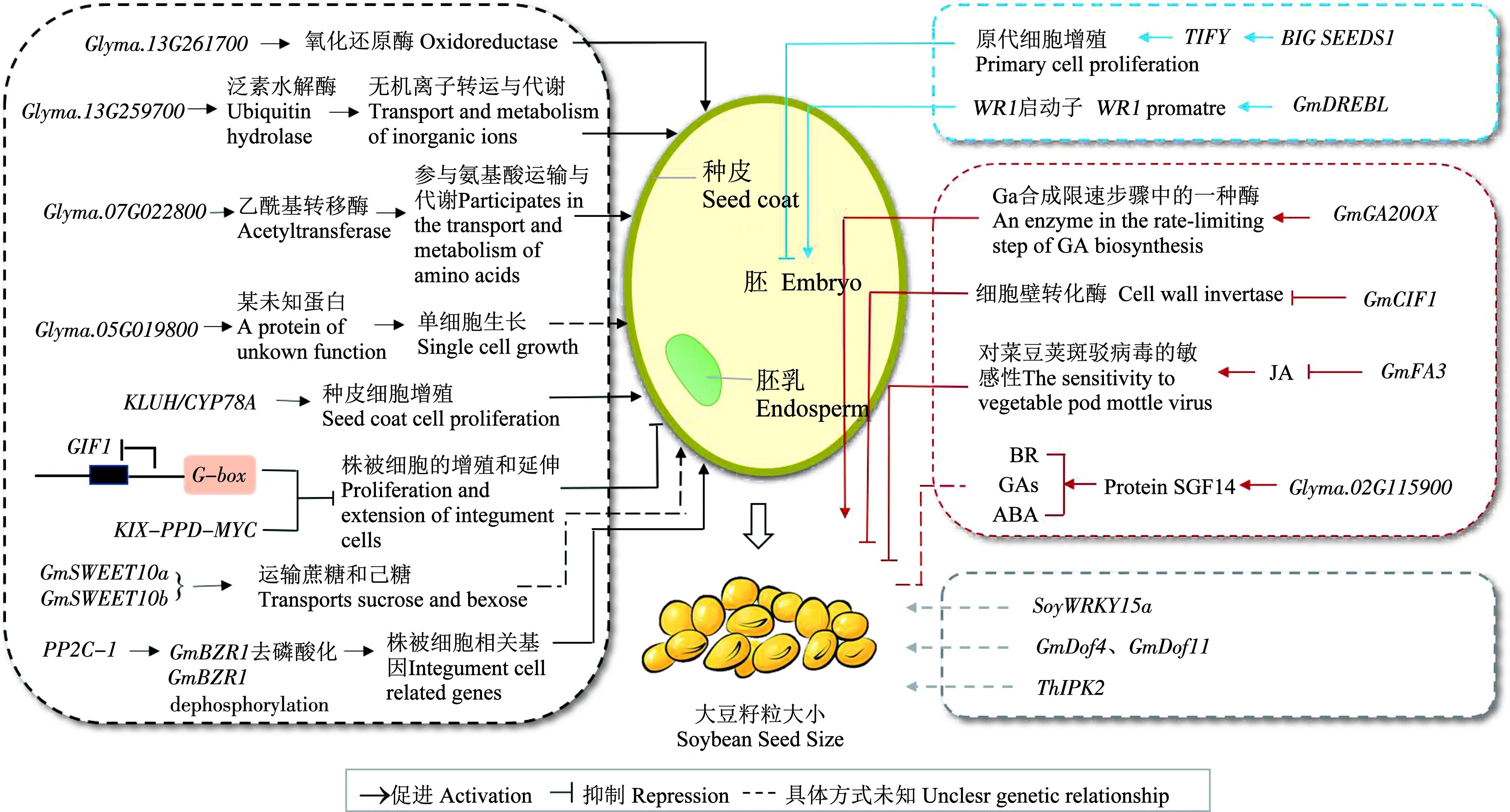
注:黑色箭头代表种皮发育调控过程,蓝色箭头代表胚/胚乳发育调控过程,红色箭头代表植物激素相关调控过程,灰色箭头代表未知位置的调控过程。BR代表油菜素内酯,GAs代表赤霉素,ABA代表脱落酸。Note:The black arrow represents the process of seed coat development;the blue arrow represents the process of embryo/endosperm development;the red arrow represents the process of plant hormone related regulation;and the gray arrow represents the process of unknown location regulation.BR means brassinosteroid,GAs means gibberellin,ABA means abscisic acid.图2 大豆籽粒大小/重量调控网络Fig.2 Soybean seed size/weight regulation network
栽培大豆在驯化过程中可能会失去一些有用的基因位点。通过对栽培大豆品种的分析发现,40%的栽培大豆品种不存在PP2C-1等位基因,而PP2C-1(Glyma.17g33690)被证实有助于大豆籽粒大小/重量的增加[53],其与油菜素内酯(BR)信号转导的关键转录因子GmBZR1关联,并促进GmBZR1去磷酸化的积累,增强珠被细胞大小和激活种子性状相关基因。转基因PP2C-1显著增加大豆籽粒大小和粒重[53]。这说明该等位基因的引入可以对一些品种进行改良。通过分子辅助育种应用该等位基因可能会增加大豆和其他豆类作物的产量。
前期研究发现,粒长相关调控基因GL7/GW7/SLG7控制水稻粒级方面的转录调控,可使启动子突变或拷贝数增加,调控母本组织产生细长籽粒,正向调控粒级,并且在长粒品种中拥有更高的表达量[54]。大豆基因Glyma.05G019800作为GW7的同源基因能够编码某未知功能蛋白,在单细胞生长调节过程中发挥作用,影响大豆百粒重[51]。粒重相关调控基因GW6a也参与了水稻粒大小基因的转录调控,GW6a通过编码组蛋白H4乙酰转移酶(OsglHAT1),正向调控籽粒大小[55]。提高GW6a的表达量,小穗壳细胞分裂增加,籽粒灌浆速度增强,进一步增加了粒重和产量[55]。在大豆中发现GW6a的同源基因Glyma.07G022800,此基因能够编码乙酰基转移酶,参与氨基酸的运输和代谢等生理活动,从而对大豆籽粒大小发挥正向调控作用[51]。
蔗糖的运输是通过韧皮部传递到种子,是种子发育碳能量的主要来源,在许多物种的种子发育中起着关键作用[56]。已有研究表明,SWEET蛋白在光合作用合成的糖从叶肉细胞向种子的转运中发挥重要作用,从而影响种子的结实率、灌浆率和组成[57-58]。GmSWEET10a和GmSWEET10b具有调控籽粒大小、含油量和蛋白质含量的功能[59],同时敲除GmSWEET15a和GmSWEET15b会导致极高的种子败育率[59],但在调控大豆籽粒大小发育方面可能存在功能冗余。GmSWEET10a和GmSWEET10b基因能够在种皮中特异性表达[60],将蔗糖和己糖从种皮组织运输到胚胎引起胚胎细胞分裂和扩张,从而产生更大的种子,进入胚胎的糖运输增加导致脂质合成所需碳资源的增加。
上述基因在种皮发育调控过程中均具有正向调控作用,但还有一些基因发挥负向调控籽粒大小的作用。在研究KIX-PPD-MYC-GIF1信号通路的过程中发现了可调控种子大小和重量的新机制,研究揭示了KIX8/9、PPD1/2、MYC3/4和GIF1在控制种子大小的共同途径中发挥的重要作用[61]。调节因子GRF-INTERACTING FACTORs(GIF1/2/3)是一组转录共激活因子,与生长调节因子相互作用,GIF1通过调节细胞增殖和生长来控制器官的发育[62-63]。PEAPODs(PPD1/2)属于TIFY II类蛋白家族,控制叶片发育、种子生长和萌发等[64]。KIX-PPD-MYC复合物与GIF1启动子中典型的G-box序列相结合并抑制其表达,影响珠被内细胞的增殖和延伸,负向调控种子大小[61]。同时该研究发现,豆科植物大豆和紫花苜蓿中PPD同源基因的功能丧失增加了种子的大小和重量以及叶片的大小[65]。这些研究表明:KIX-PPD-MYC-GIF1信号通路可在大豆中进行进一步研究,并且未来有望应用这些基因提高作物产量。
2.2 大豆胚或胚乳发育调控
一些转录调控因子可通过调控胚的发育过程控制籽粒大小,如BIGSEEDS1(BS1)在豆类植物种子大小发育过程中起着重要作用,BS1可编码一种植物特异性转录调控因子—TIFY,进而控制植物器官如豆荚、叶片和种子的大小。当大豆BS1同源基因被抑制时,会使种子大小增加[65]。在mtbs1-1突变体中,生长互作因子GIF、调节因子GRF和核心细胞周期基因的表达都得到增强,胚的大小显著增加[65]。以上结果表明:BS1是与胚胎细胞增殖相关的负调控因子。
此外,有研究发现DREB型转录因子基因GmDREBL在种子积累油脂过程中起重要作用[66]。GmDREBL定位于细胞核,具有转录激活能力,可以结合到WR1的启动子区域激活其表达。在拟南芥过表达GmDREBL后,发现其在拟南芥雄蕊、胚和子叶器官中特异性表达,种子大小明显增加。且DREBL在栽培大豆中的平均表达水平高于野生大豆,这表明DREBL的启动子可能在大豆驯化过程中被特异性选择。
2.3 植物激素调控相关基因挖掘
部分基因通过调控植物激素的合成和代谢影响籽粒发育。例如,GmGA20OX基因编码赤霉素氧化酶GA-20 oxidase,位于大豆籽粒重量位点QTL-seed weight10-11,与籽粒百粒重呈显著相关[67],拟南芥AtGA20OX与其同源。作为一种多功能酶,GA20OX具有调节赤霉素(GA)合成和代谢的作用,在植物发育和生理过程中起着重要的调控作用。过表达GmGA20OX基因后发现籽粒大小和粒重增加,说明GmGA20OX具有正向调控籽粒大小的作用[67]。
大豆Glyma.02G115900基因能够编码14-3-3蛋白,该蛋白具有调控赤霉素(GAs)、脱落酸(ABA)和油菜素内酯(BR)生物合成的作用,参与调控植物信号途径,影响籽粒发育。比如,14-3-3蛋白可以负调控转录激活因子RSG,后者通过控制前者胞内定位,参与调节内源性赤霉素(GAs)的数量[68];14-3-3结合体可以有效抑制磷酸化BR转录因子BZR1和BZR2,进而调节BR的基因表达[69];14-3-3蛋白质与ABA响应元件(ABRE)结合因子HvABF1/2/3相互作用,也与ABA响应激酶PKABA1相互作用,进而影响ABA和GA的信号转导,调控ABA和GA之间的平衡[70]。然而,Glyma.02G115900通过影响14-3-3进而调控植物激素的多种作用通路比较复杂,仍需进一步的探索研究。
细胞壁转化酶(CWI)和液泡转化酶(VI)被认为是糖代谢和糖信号转导的重要参与者,影响植物对环境变化的反应。其中细胞壁转化酶(CWI)在植物中发挥多种信号和代谢功能。抑制两种转化酶抑制剂GmCIF1和GmC/VIF2,将会导致种子产量增加[71]。Tang等[72]也报道了两种转化酶抑制剂GmCIF1和GmC/VIF2在大豆中通过异源表达在体外具有抑制活性。转录分析显示,它们主要在发育中的种子和ABA的响应中表达。沉默GmCIF1后,成熟种子的CWI通过微调蔗糖代谢和库强度的过程活性显著提高,种子重量增加,并增加了己糖、淀粉和蛋白质的积累[72],表明GmCIF1在大豆籽粒重量方面具有负向调控的作用。
大豆当中还有一些基因可以通过调控其他代谢产物从而影响大豆种子大小,如大豆GmFAD3基因,Ω-3脂肪酸去饱和酶(FAD3)参与茉莉酸(JA)脂肪酸和的生物合成。大豆gmfad3沉默的植物会积累更高水平的JA,从而提高了大豆对菜豆荚斑驳病毒(BPMV)的敏感性,产出更大、更重的种子[73]。
2.4 其它基因调控
栽培大豆是由野生大豆不断驯化而来,一般具有更大的籽粒。了解栽培大豆和野生大豆性状分化背后的基因组差异有助于大豆的栽培和遗传改良。对不同大豆群体WRKY的表现进行了比较,发现SoyWRKY15a在野生大豆群体中的表达量与籽粒大小呈正相关[74]。GmWRKY15a(栽培大豆)和GsWRKY15a(野生大豆)在编码区的序列完全相同,而在5′非翻译区(5′UTR)CT的重复数目不同,且籽粒中前者表达量更高,通过表达量差异调控不同单倍型变异,从而影响籽粒大小[74]。WRKY家族的WRKYTF基因TRANSPARENT TESTA GLABRA 2(TTG2)和MINISEED 3(MINI3)已经被证实在拟南芥中具有调节种子大小的功能[16,75]。在ttg2突变体植株中,TTG2的功能缺失导致表皮细胞伸长受到限制,影响胚乳和种子的生长[16]。MINI3则被证实能够与细胞分裂素氧化酶2(CKX2)启动子结合,激活CKX2的表达,调节胚乳的生长[75]。然而对SoyWRKY15a在大豆中的表达位置和具体调控通路仍需要更多的研究。
在对大豆籽粒大小研究的过程中,转基因技术的作用不可或缺。目前,我国已成为除美国之外最大的转基因产品研发国家,创造并取得了耐除草剂大豆、抗虫大豆等优异功能性品种的安全证书[76],这些进步势必会为大豆品种产业化应用提供强大支撑。Liu等把一种来自嗜盐菌的肌醇多磷酸激酶基因-ThIPK2通过农杆菌介导的转化转移到大豆中,转化大豆植株显著提高了种子大小和抗逆性等[77]。Wang等[78]研究发现,与Col-0(野生型)大豆相比,转基因GmDof4和转基因GmDof11的种子大小和重量略大,这表明GmDof4和GmDof11两个基因与大豆籽粒重量密切相关,并具有潜在的应用价值。
3 研究展望
大豆是古四倍体演变而来的二倍体作物,基因组的复杂性给大豆分子设计育种带来了极大的挑战。大豆全基因组测序的完成和生物学信息库的完善,将积极助力大豆重要农艺性状的分子设计育种工作。目前大豆籽粒大小分子调控研究已经取得了一定的进展,但仍有较大扩展空间,以下几个方面是亟待解决的问题:
3.1 挖掘籽粒大小相关基因及其功能验证
随着分子生物学技术与数量遗传学的发展,定位方法逐渐精细准确,大豆籽粒发育相关QTL数量不断增加,但由于多基因控制性状在遗传上的复杂性及与环境的互作关系,相关QTL定位成果仍较难直接用于指导分子标记辅助选择育种。目前已经得到验证的可调控大豆籽粒大小/重量的基因与QTL粒重位点相重合的仅有GmGA20OX,未来需要在模式作物籽粒大小相关研究的基础上,增加大豆品种和环境检测的数量,以获得稳定遗传的QTL位点,挖掘及克隆更多区间内可控性状的单个候选基因,将为大豆籽粒大小调控研究提供更重要的基因资源。
3.2 解析大豆籽粒大小分子调控网络
当前研究中,对大豆籽粒大小的调控途径研究尚未形成系统的分子调控网络。采用反向遗传学方法发现的很多基因在调控机制方面研究的不够深入,如基因GmDof4、GmDof11、ThIPK2等,这些已经被证明和籽粒大小相关,但未来还需要深入解析这些基因的生物学功能。某些具有负向调控作用的基因如BIGSEEDS1和GmCIF1,可采用基因敲除的方法解析发育调控机制。在不影响籽粒品质的前提下,解析出的基因将会对大豆高产设计育种提供重要的分子靶点。未来借助基因组学、转基因和基因编辑技术研究基因的作用机理,确定关键节点的调控因子,理清各基因与籽粒大小的互作网络,将会对大豆高产设计育种提供重要的分子靶点。
3.3 分子设计育种定向培育适宜籽粒大小新种质
籽粒大小性状受多位点调控,是大豆单产的重要组成部分。国内目前已有多个高产大粒栽培大豆品种如绥农49(百粒重29.1 g,平均产量3 046 kg·hm-2)、中黄37(百粒重27.3 g,平均产量3 222 kg·hm-2)、嫩丰16号(百粒重25~27 g,平均产量2 600~3 000 kg·hm-2)等。在植物当中,种子大小和数量存在一定权衡[6],在特定的资源下,小种子型植株倾向于产生更多的数量[79-80]。小粒大豆相对于大粒大豆产量偏低[81],但小粒大豆能够保持野生大豆(Glycinesoja)的某些优良品质,更容易出苗保苗,灌浆速度更快,受天气等不利影响小,耐密植,稳产性强。如小粒品种吉育105(百粒重9.2 g,平均产量2 360 kg·hm-2),吉育108(百粒重9.2 g,平均产量2 142 kg·hm-2),吉林小粒6号(百粒重9.0 g,平均产量2 228 kg·hm-2)等都具有稳产高抗的特点。因此,研究籽粒大小大豆的发育调控机制,对不同用途大豆的育种工作具有重要意义。利用全基因组选择技术、基因组编辑技术、人工智能和生物合成等前沿技术,对目标基因进行定向改造,培育出具有特定功能、品质和产量与籽粒大小相适宜的新种质,将会是未来大豆育种实践过程中的重要目标。
