经颅直流电刺激联合集体运动疗法治疗慢性腰痛的疗效
2022-03-10冷波
冷波
(重庆龙湖医院骨科,重庆 401120)
近年来,随着生活、工作方式改变,慢性非特异性下腰痛(nonspecific chronic low back pain,NSCLBP)发病率呈逐渐升高趋势,给患者和家庭带来沉重的经济负担[1]。目前NSCLBP尚缺乏特异性治疗方法,多数指南建议采用多学科综合治疗方法[2]。经颅直流电刺激(transcranial direct current stimulation,tDCS)是治疗纤维肌痛或脊髓损伤相关中枢性疼痛的有效技术,应用于运动皮层的tDCS可降低疼痛的强度和持续时间,调控参与疼痛调节大脑区域的活动[3]。研究显示,tDCS与康复技术相结合治疗纤维肌痛可提高疗效[4],但用于NSCLBP的疗效尚不明确。本研究旨在探讨tDCS联合集体运动疗法治疗NSCLBP的临床效果,现报告如下。
1 资料与方法
1.1 一般资料
选择2018年8月~2019年12月在本院就诊的NSCLBP患者作为研究对象。纳入标准:①腰骶部疼痛,病程≥3个月,经影像学检查排除可能导致腰骶部疼痛的器质性疾病,符合NSCLBP的诊断标准;②年龄20~60岁,性别不限;③入组前2周内未应用药物治疗;④患者意识清晰,有初中以上文化程度,可正常交流,依从性良好,签署知情同意书。排除标准:①有心理疾病或认知功能障碍,无法完成研究内容者;②合并先天性脊柱畸形或运动功能障碍者;③既往有腰椎手术史者;④骨折、腰椎结核、腰部退行性病变、内脏脏器等导致的腰部疼痛者;⑤妊娠期或哺乳期女性,不能正确理解研究内容者;⑥有tDCS治疗禁忌者。共纳入患者74例,采用随机数字表法分为对照组和观察组各37例。对照组中,男12例,女25例;年龄26~59岁,平均(40.17±12.08)岁;病程5~29个月,平均(13.08±5.48)个月。观察组中,男14例,女23例;年龄25~59岁,平均(40.48±11.47)岁;病程4~33个月,平均(13.87±6.08)个月。两组患者性别、年龄、病程等基线资料比较,差异均无统计学意义(P>0.05),有可比性。
1.2 研究方法
两组患者均给予集体运动疗法,以小组方式开展,每个小组包括10~12名患者,每周干预2次,每次由物理治疗师指导患者完成1 h左右的躯干稳定训练,4周为1个疗程,共干预2个疗程。观察组在集体运动疗法开始前给予持续5 d的tDCS治疗,阳极置于腰背/躯干在大脑运动皮质对应区,阴极置于右背侧前额叶皮质对应区,持续刺激20 min,强度为2 mA。对照组刺激在30 s后关闭,患者仅感觉到最初的瘙痒感,后续刺激过程中不通电流。
1.3 观察指标
在tDCS干预前(T0)、tDCS干预后(T1)、运动干预后(T2)和运动干预后1个月随访(T3)时,观察患者的疼痛程度、腰部功能障碍、生活质量、抑郁严重程度和心理健康程度,疼痛程度采用VAS评分评估;腰部功能采用罗兰莫里斯残疾问卷(roland morris disability questionnaire, RMDQ)评估,得分越高说明患者的功能障碍越严重;生活质量采用欧洲五维健康量表(EuroQol five dimensional,EQ-5D)评估,包括健康描述系统和EQ-VAS2个部分,通过效率换算表计算出EQ-5D指数得分。心理健康程度采用健康问卷-9(patient health questionnaire 9, PHQ-9)评估,得分越高说明心理健康程度越差。观察患者tDCS过程中的不良反应。
1.4 统计学方法
采用SPSS23.0软件进行数据分析,计量资料采用均数±标准差表示,组内比较采用重复测量数据方差分析,组间比较采用独立样本t检验;计数资料采用率或百分比表示,采用x2检验,最小理论频数<1时用Fisher精确检验。P<0.05为差异有统计学意义。
2 结果
T0时,两组患者VAS、RMDQ、EQ-5D和PHQ-9评分差异均无统计学意义(P>0.05);T1~T3时,两组患者VAS、RMDQ和PHQ-9评分较T0时均显著降低(P<0.05),EQ-5D评分较T0时均显著升高(P<0.05);观察组T1~T3时的VAS、RMDQ和PHQ-9评分均显著低于对照组,EQ-5D评分显著高于对照组(P<0.05),上述差异均有统计学意义,见表1。
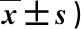
表1 两组患者不同时间的疗效指标分析(分,
不良反应方面,两组患者皮肤发红、刺痛、头痛、嗜睡、头晕、情绪波动等发生率差异均无统计学意义(P>0.05),见表2。
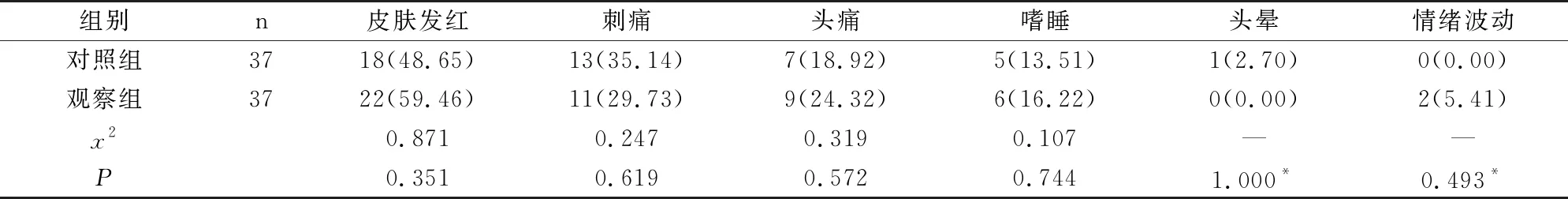
表2 两组患者tDCS治疗期间的不良反应发生率比较[n(%)]
3 讨论
刺激初级运动皮质区(primary motor cortex,M1区)已被证明是治疗慢性神经病理性疼痛的有效方法,早期神经调节缓解慢性疼痛的研究显示,外科手术植入大脑表面的直接电刺激对减轻疼痛有益,但因其侵袭性、并发症及费用昂贵等原因,并未能在临床推广[5]。tDCS是有应用前景的无创性脑刺激技术,不直接激活皮层神经元,具有极性刺激的特点,阳性刺激可提高皮质的兴奋性,而阴极则降低皮质兴奋性[6]。对M1区运动皮质的阳性tDCS研究显示,M1区运动皮层阳性刺激可缓解盆腔痛、癌性疼痛等临床症状[7]。基础研究显示,tDCS可减轻慢性应激引起的机械痛觉过敏,其机制可能与其调节突触传递、分子生物合成、神经元形态和神经递质等多方面相关[8-9]。荟萃分析显示,tDCS可缓解脊髓损伤导致的神病理性疼痛,但其镇痛效果与治疗时间、协同治疗方式和患者的基线治疗状况相关[10]。
本研究显示,tDCS联合集体运动疗法可改善患者的疼痛症状和心理健康,在干预1个月后仍可持续观察到这种效果。本研究对照组在T1时也观察到疼痛强度的明显降低,考虑可能源于刺激结束后的安慰剂暗示效应通过中枢神经系统产生了临床结果变化。疼痛本身可能对情绪和认知功能产生负面影响,并与负面情绪和心理困扰相关。本研究中,观察组患者T1、T2、T3时的PHQ-9评分显著低于对照组、EQ-5D评分显著高于对照组,结果提示,tDCS联合集体运动治疗可减轻患者的不良情绪,改善患者的生活质量。这些结果表明,tDCS可提高集体运动治疗NSCLBP的临床效果。
既往一项关于纤维肌痛的研究显示,在多学科康复治疗中加用tDCS可改善患者的生活质量,但未能降低其疼痛评分[11],但该研究的tDCS未连续刺激,而是采用1次/周的方式进行。目前已知内源性阿片系统是调节疼痛伤害性信号的重要介质,tDCS过程中M1皮层刺激增加了同侧M1和丘脑的功能耦合,可介导内源性阿片能效应,但单次tDCS治疗的阿片能效应是亚临床性,不能有效改善疼痛,需重复治疗才能改变慢性疼痛患者的神经可塑性和促进疼痛改善。一项关于慢性腰痛患者的大样本研究显示,在认知行为管理中加用tDCS不会对患者疼痛和功能障碍产生明显改善[12],该研究选择与tDCS与认知疗法共同干预,但认知疗法涉及的神经区域和tDCS刺激区域不同,可能影响研究效果。目前的多项研究显示,在行为干预之前给予tDCS可获得最佳效果,产生协同作用的主要原因来自tDCS对神经元阈值的调节[13-14]。因此,tDCS联合其他方式治疗CNSLBP的过程中,联合疗法的选择可能会影响最终结果,提示tDCS治疗CNSLBP的联合效果需要选择适当神经区域进行刺激,并选择适合的多学科治疗方法和正确的序贯顺序。
本研究的局限性在于:①患者数量较少,研究结论尚需要大样本、多中心研究进一步论证;②本研究通过随机对照的方式观察了tDCS和安慰治疗对集体运动治疗的改善效果,鉴于tDCS的治疗与刺激时间存在相关性,tDCS与集体运动治疗联合的最佳刺激强度尚需要进一步研究探讨。
