TRAIL治疗肿瘤的耐药机制及增敏方法的研究进展
2022-03-09苗丽陈瑶瑶刘拥军刘广洋
苗丽,陈瑶瑶,刘拥军,刘广洋
癌症是危害人类健康最严重的疾病之一,多年来尽管癌症相关研究取得了很大的进展,但手术切除、放疗和化疗仍是癌症治疗的主要方法。许多化疗药物通过诱导 DNA 损伤和细胞应激,阻断 DNA 复制和肿瘤细胞分裂,从而触发癌细胞死亡。然而,这些传统疗法往往会引起全身毒性,并最终导致反复治疗后的肿瘤耐药,因此癌症替代疗法的研究受到了广泛关注。
TRAIL 是 TNF 细胞因子超家族成员之一,能够结合肿瘤细胞表达的 TRAIL 凋亡受体(DR4 和 DR5);同时还可结合正常细胞表面的两种受体 TRAIL-R3 和TRAIL-R4,两种受体也分别称为诱饵受体 1(DcR1)和诱饵受体 2(DcR2)。研究发现 DR4 和 DR5 通过其保守的死亡域(DD)基序发出凋亡信号,而 DcR1/2 已被证明对TRAIL 诱导的细胞凋亡具有负向调节作用[1];因此 TRAIL诱导的凋亡信号具有选择性,即可诱导肿瘤细胞凋亡而对正常细胞没有毒性;因此 TRAIL 被认为是具有临床开发前景的抗肿瘤药物[2-3]。
1 TRAIL 诱导的凋亡机制
TRAIL 是一种 II 型跨膜蛋白,其胞外结构域可以从细胞表面脱落,并作为自组装非共价三聚体的形式而具有活性,无论是可溶性 TRAIL 还是膜结合 TRAIL 均可与其受体 DR4、DR5、DcR1、DcR2 和 OPG结合[4]。DR4 和 DR5是 I 型膜蛋白,细胞外有 2 ~ 4 个类似富含半胱氨酸的结构域,细胞质约有 80 个氨基酸的死亡结构域,因而能够与TRAIL 结合诱导细胞凋亡[5]。TRAIL 与 DR4 和 DR5 结合后,招募与 Caspase 酶结合且具有死亡结构域(FADD)的细胞内衔接分子 FAS 相关蛋白。FADD 募集 Caspase 8和 Caspase 10 且与之相互作用产生 TRAIL 死亡诱导信号复合物(DISC)[6]。DISC 一方面可激活下游效应 Caspase 3、Caspase 6 和 Caspase 7,形成信号级联反应引发外源性凋亡通路;另外可诱导内源性凋亡通路,这两种途径是 TRAIL诱导肿瘤细胞发生凋亡的主要途径[7],而两种凋亡信号通路间又形成了一个复杂的平衡系统[8]。另外,TRAIL 还可以通过 NF-κB、ERK、p38、p53 以及 JNK等信号因子诱导促生存和促凋亡之间的反应,进而诱导细胞凋亡的级联反应[9](图1)。
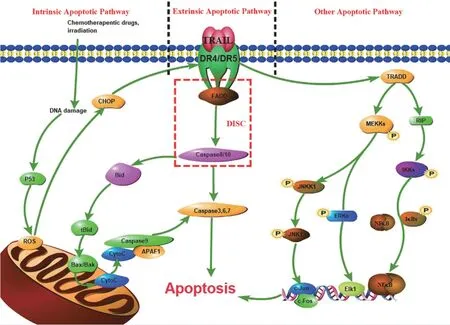
图1 TRAIL 诱导的凋亡机制[TRAIL 与其受体 DR4/5 结合 FADD 并招募 Procaspase 8 和 10,形成 DISC 复合物,介导级联反应引发外源性凋亡(中间信号通路);同时 Caspase 8 还可激活 tBid 引发线粒体介导的内源性凋亡反应(左边信号通路);两种通路间存在复杂的相互作用。此外,NF-κB、ERK、JNK、p38 等细胞通路也能够促进 TRAIL 诱导的凋亡反应的发生(右边信号通路)]
2 TRAIL 诱导的细胞凋亡的耐药机制
TRAIL 蛋白及其死亡受体 DR4 和 DR5 的发现为癌症的研究提供了全新的视野。然而,由于多数的癌细胞对TRAIL 具有一定的耐药性[10],限制了其进一步的开发,因此 TRAIL 耐药机制的研究对开发肿瘤治疗药物具有重要的价值。目前相关研究表明包括 TRAIL 受体的表达、缺陷及核定位、凋亡抑制分子 c-FLIP、抗凋亡蛋白 Bcl-2、Bcl-xL 和 Mcl-1 等多种细胞通路及表观遗传调控等因素,可通过调节 TRAIL 促凋亡或抗凋亡的信号从而影响癌症对 TRAIL 的耐药性。
凋亡受体 DR4/5 是 TRAIL 诱导外源性凋亡通路的两个主要组成部分,DR4/5 在肿瘤细胞膜上的定位及表达差异性决定了癌细胞的敏感性差异[11]。诱饵受体 DcR1/2也具有与 TRAIL 结合的能力,但由于其不传递凋亡信号并通过与 DR4/5 的竞争而对 TRAIL 诱导的凋亡具有抑制作用[12]。另外,DR4/5 的细胞定位对 TRAIL 的耐药具有重要影响,研究表明无 DR5 核定位的癌细胞对 TRAIL 高度敏感,而 DR5 核定位高的癌细胞对 TRAIL 具有抗性,通过功能性核定位信号的突变或 improtion β1 的敲除可以阻断 DR5 的核定位,上调细胞表面 DR5 的表达从而增加TRAIL 的敏感性[13]。由 Dyn1 调控的网格蛋白介导的内吞作用(CME)的上调会触发 DR4/5 的内化,从而导致膜表面死亡受体的丧失和凋亡信号的减少[14](图2)。

图2 TRAIL诱导的细胞凋亡的耐药机制(外源性凋亡的耐药机制主要是由于 c-FLIP 使癌细胞对 TRAIL 诱导的凋亡产生抗性;内源性凋亡的耐药机制则由抗凋亡蛋白 Bcl-2、Bcl-xL、Mcl-1 和 IAP 通过不同的功能机制诱导癌细胞对 TRAIL 的耐药性。而细胞通路、表观遗传修饰及基因调控等在癌细胞对 TRAIL 耐药机制中发挥重要作用)
2.1 外源性凋亡的耐药机制
研究表明 TRAIL 诱导的凋亡主要通过 Caspase 酶激活介导促凋亡信号[15],而 Caspase 信号由 Caspase抑制剂(c-FLIP 和 c-IAPs)、Caspase 基因组改变、泛素化及磷酸化等机制调控[16]。c-FLIP 是抗细胞凋亡功能的关键调节因子,与 Caspase 同源,但缺乏凋亡诱导的蛋白酶活性,c-FLIP通过占据 FADD 上 Caspase 8 结合位点从而在受体水平上阻断死亡信号的传递,阻断 Caspase 级联反应的激活[17]。c-IAPs 则是另一个细胞凋亡抑制蛋白家族成员,可通过阻断 Caspase 受体下游的 Caspase 3、Caspase 7 和 Caspase 9的激活从而降低肿瘤细胞对 TRAIL 的敏感性[18];而通过自噬介导的 c-FLIP(L)和 c-IAP 降解则可显著增强 TRAIL的抗癌活性[19]。
研究发现,Gli2 通过调控序列激活 c-FLIP 启动子区域的转录,从而对激活 c-FLIP 发挥重要作用,而Gli2 基因沉默可增强 TRAIL 诱导的肝癌小鼠肿瘤凋亡作用,而Gli2 过表达的肿瘤细胞则通过抑制半胱天冬酶活性减弱了TRAIL 诱导的细胞凋亡[20]。另有研究表明 Caspase 基因组的改变能够抑制 TRAIL 通路的激活,在神经母细胞瘤中,DNA 甲基化引起 Caspase 沉默导致肿瘤对 TRAIL 治疗产生耐药性[21]。Caspase 8 泛素化调控 TRAIL 在癌细胞中的敏感性,Caspase 8 的多聚泛素化抑制了 TRAIL 对胃癌细胞的凋亡作用[22]。
2.2 内源性凋亡的耐药机制
线粒体途径在 TRAIL 诱导的凋亡中也发挥着重要的作用,而线粒体凋亡通路的失调是癌症治疗的主要障碍之一。线粒体凋亡受抗凋亡蛋白 Bcl-2、Bcl-xL 和 Mcl-1、促凋亡多结构域蛋白 Bax 和 Bak 等控制[23],因此 TRAIL的敏感性和耐药性依赖于 Bcl-2、Bcl-xL 等蛋白的表达水平。研究表明激活 tBid 并结合 Bax 可诱导内源性凋亡,而 Bcl-xL 可以通过与 Bax 竞争结合 tBid 抑制凋亡激活,Bcl-2 则抑制 tBid 转位到线粒体膜外从而抑制凋亡途径[24]。另有报道表明 Mcl-1 可通过阻断细胞色素 c 的释放,并选择性地与 Noxa 和 Bak相互作用,从而阻断凋亡通路[25]。在功能性凋亡程序中,IAP 家族蛋白可通过调节内外通路防止不必要的细胞凋亡通路的激活,研究表明X-连锁凋亡抑制蛋白(XIAP)与 Caspase 3、Caspase 7 和Caspase 9 结合并有效地抑制其活性,而 cIAP-1/2 则可以通过聚泛素化 Caspase 来抑制凋亡级联反应[15]。另一项研究表明细胞质 PARP 能够调控 TRAIL 诱导的细胞凋亡反应,其通过抑制细胞质中 PARP 的表达可提高胰腺癌对TRAIL 的敏感性[26]。
2.3 细胞通路及其他相关耐药机制
TRAIL 耐药性除受外源性和内源性凋亡因素调控外,还受细胞信号通路(PI3K/AKT、JNK 及 STAT3 等)、miRNA、肿瘤相关转录因子以及表观修饰等调控。PI3K/AKT通路在驱动癌细胞的凋亡耐药过程中发挥关键作用[15]。研究表明 PI3K/AKT 通路通过激活下游 mTPO 信号驱动细胞保护性自噬的激活,通过将 DR4/5 隔离在自噬体,阻止其在细胞表面的表达而促进 TRAIL 耐药性[27]。而 JNK信号通路参与 DR4 介导的 HepG2-TR 细胞自噬反应,从而促进 HepG2 细胞对 TRAIL 的耐药性[28]。不同细胞株的 TRAIL 敏感性也受 STAT3 活性的调节,STAT3 的失活能够提高 TRAIL 诱导的凋亡的敏感性[29]。miRNA 及转录因子也对 TRAIL 的耐药性具有一定的调控作用。miR429/PD-L1 轴通过调节 EGFR 通路的激活以促进TRAIL 耐药性[30]。miR221/222 的上调与 TRAIL 衍生的耐药性相关,且原发性肝癌细胞 TRAIL 敏感性与 miR221的表达呈负相关性[31]。转录因子 Six1、c-Met 等则是 TRAIL诱导的癌细胞凋亡的有效负调控因子,通过敲除 c-Met 可中断 c-Met 与 DR5 之间的相互作用,使脑肿瘤细胞对TRAIL 介导的凋亡敏感[32]。另外,许多癌症相关基质细胞、异常蛋白的合成、蛋白错误折叠及代谢途径等也均对癌细胞的 TRAIL 耐药性机制起到一定的调控作用。
3 TRAIL 诱导的细胞凋亡的增敏方法
基于目前对 TRAIL 耐药机制的深入研究,可通过不同的方法提高肿瘤细胞对 TRAIL 的敏感性。常见的策略主要包括激活或上调 TRAIL 死亡受体 DR4/5、下调 DcR1/2、抑制抗凋亡蛋白表达、激活 TRAIL 诱导的外源性凋亡及内源性凋亡通路,以此增强 TRAIL 介导的细胞凋亡反应,为TRAIL 在癌症治疗中的应用提供最佳组合(图3)。

图3 癌症细胞对 TRAIL 的增敏方法
3.1 激活或上调 DR4/5 的 TRAIL 增敏方法
如前所述,在 TRAIL 凋亡机制过程中,DR4 和 DR5结构域充当衔接蛋白 FADD 的对接位点,然后募集Caspase-8/10,由此产生的蛋白质组装包括死亡诱导信号复合物(DISC)。因此通过调控 TRAIL 相关凋亡受体 DR4/5及 Caspase 的持续激活从而增加 TRAIL 的敏感性。研究发现,TRAIL 与抗癌药物具有良好的协同效应效果,众多抗癌药物可上调 DR4/5 的膜表达水平。阿霉素、硼替佐米可显著增强 DR4/5 的膜表面表达,从而降低 TRAIL 耐药、增强 A549 和 HT-29 细胞的杀伤效果[33]。低剂量的 5-FU通过上调 DR5 的表达及下调诱饵受体 DcR2 的表达增强耐药 AGS 细胞的 TRAIL 敏感性[34]。而蛋白酶抑制剂CPT-11 通过上调 DR5 mRNA 的表达并增加 Bax 和Caspase 9 蛋白表达,从而增强 TRAIL 对耐药 HT-29 细胞的凋亡作用[35]。黄酮类化合物 5-MF 可通过上调 DR5 的表达,激活 Caspase 3、Caspase 8 刺激外源性凋亡。同时裂解 Bid、激活 Bax 导致线粒体跨膜点位降低,进而增强癌细胞对 TRAIL 的敏感性[36]。天然提取物莪术醇可阻断NQO2 的活性位点 Phe178,抑制 NQO2 的活性,引起ROS 的生成从而启动 ER/CHOP/DR5 信号,致使 NSCLC对 TRAIL 诱导的凋亡敏感[37]。此外,BCL2L2 和 SOD1 基因的沉默可通过激活 Caspase 3 活性来增强 TRAIL 介导的 MDA-231 细胞的凋亡,靶向 BCL2L2 的 siRNA 可协同 TRAIL 增加乳腺癌细胞的凋亡反应[38]。
另外,针对 DR4 或 DR5 的激动剂单克隆抗体(mAb)也是常用的激活 DR4/5 的方法,与 TRAIL 配体相比,激动剂抗体在体内一般具有较长的血清半衰期。其中一些已经在人体临床试验中进行了研究,包括 mapatumumab(HGS-ETR1)、lexatumumab(HGS-ETR2)、drozitumab(PRO95780)、conatumumab(AMG-655)、tigatuzumab(CS-1008) 等。HGS-ETR1 是第一个针对 DR4 的完全人源化的单克隆抗体,可与 DR4 受体特异性结合[39]。研究发现 HGS-ETR1 可降低多种类型肿瘤细胞在体外的存活能力,并诱导了 Caspase 8、Bid等的活化和 PARP 的裂解,表明仅 DR4 的活化就足以诱导外源性和内在凋亡途径,而在异种移植肺癌动物模型中,HGS-ETR1 的体内给药导致肿瘤快速消退并抑制非小细胞肺癌的生长[40]。Conatumumab(AMG-655)由 Amgen Inc 和武田生物共同开发,可特异激活 DR5 受体。体外和体内研究表明,conatumumab 诱导来自结肠癌和胰腺癌的细胞系以及携带异种移植肿瘤的小鼠的细胞凋亡,并可增强伊立替康和吉西他滨等药物的抗肿瘤活性[41];Ib 期临床试验的结果已经证明了 conatumumab作为单药治疗的安全性,以及与其他抗体疗法或标准化疗方案联合使用的安全性[42]。
3.2 通过抗凋亡蛋白抑制调控的TRAIL增敏方法
抗凋亡蛋白 c-IAP、XIAP、Mcl-1、Bcl-2、Bcl-xL、Survivin 等多种蛋白质参与癌细胞对 TRAIL 的抗性,因此可以通过下调细胞内抗凋亡蛋白来克服癌细胞对 TRAIL的耐药性。研究表明抗癌药物紫杉醇可通过 c-IAP 和Mcl-1 的下调显著增强 TRAIL 诱导的耐药癌细胞凋亡,同时抑制 MAPK 通路、恢复 TRAIL 敏感性[43]。而化疗药丝裂霉素通过下调 Mcl-1、Bcl-2、Bcl-xL 和上调促凋亡蛋白Bax、Bim 及 DR4/5的表达以增强 TRAIL 诱导的凋亡效果[44]。小分子抑制剂对膀胱癌 T24 细胞 TRAIL 敏感性的调节与 XIAP小干扰 RNA 介导的 XIAP 表达抑制相关,这表明 XIAP 对癌细胞的耐药性具有一定的作用[45]。而组蛋白去乙酰化酶抑制剂丙戊酸(VPA)通过作用于内、外凋亡途径增加细胞凋亡的敏感性。研究表明 VPA 可通过下调Bcl-2、Bcl-xL 促进 Caspase 3 活性,从而使抗 TRAIL 的癌细胞变得敏感[46]。另外,线粒体呼吸抑制剂鱼藤酮触发ROS 的生成导致 Bcl-xL 的下调,并上调由 p53 介导的Puma 的表达水平,进而增加了 NSCLC 细胞的 TRAIL 敏感性[47]。研究显示天然化合物帕西林可显著下调 c-FLIP 和Survivin 的蛋白水平以有效地使胶质瘤细胞对 TRAIL 介导的凋亡敏感[48],而雷公藤三萜化合物可抑制 IAP-1、XIAP、Bcl-2、Bcl-xL 和 Survivin的表达从而上调 Bax,并通过 ROS 介导的 CHOP 通路来诱导 DR4/5 的表达,敏化 TRAIL 诱导的凋亡作用[49]。除此之外,有研究证明通过 RNA 干扰下调 GRP78 诱导的内质网应激来下调c-FLIP 和 Mcl-1 的表达水平来促进 TRAIL 诱导的细胞凋亡的增敏作用[50]。
4 展望
TRAIL 由于其肿瘤杀伤的特异性和安全性成为具有临床前景的肿瘤治疗方法。然而,癌症细胞广泛的耐药性对基于 TRAIL 治疗的临床研究造成了重大的障碍。基于以上原因,本篇文章检索并归纳分析了近年来 TRAIL 相关的研究,综述了 TRAIL 诱导的细胞凋亡机制、癌症对 TRAIL诱导的细胞凋亡的耐药机制以及 TRAIL 增敏方法,并阐述克服癌症细胞 TRAIL 耐药性的问题。随着对 TRAIL 凋亡机制、耐药机制的深入研究以及 TRAIL 增敏剂的不断发现,为 TRAIL 在临床前和临床阶段的抗癌治疗奠定坚实的基础。
包括放疗、化疗药物、小分子抑制剂等联合使用可以通过激活凋亡通路并抑制抗凋亡蛋白而增强 TRAIL的敏感性,然而这些研究都还处于基础研究阶段,对恶性肿瘤的治疗效果还需临床研究进一步验证。针对 TRAIL 的凋亡受体DR4/DR5 的单抗激动剂,虽然在临床前研究表现出了较好的抗肿瘤活性,然而这些单克隆抗体在探索性临床研究中尚未在患者中显示出显著的抗肿瘤反应率,因此其抗肿瘤效果仍需要 III 期临床试验进一步验证。除此之外,目前新开发的包括 CAR-T 在内的肿瘤免疫疗法与 TRAIL 的应用,可能为癌症的有效治疗提供一种新的治疗手段。
综上所述,随着研究的深入,克服肿瘤细胞对 TRAIL耐药性的方法也与日俱增,在未来针对 TRAIL 抗癌治疗需要着重研究 TRAIL 与不同癌细胞特性相关的信号通路之间的关系,并结合最新的肿瘤治疗手段,开发基于 TRAIL及其他药物联合治疗的抗癌新方法。
