唾液皮质醇水平在患儿医源性戒断反应评估中的临床意义
2022-03-09鲍仕慧郑映陈丽佳陈彬武林凌洁
鲍仕慧 郑映 陈丽佳 陈彬武 林凌洁
[摘要] 目的 探討唾液皮质醇水平在儿童重症监护室(PICU)患儿医源性戒断反应(IWS)评估中的临床意义。 方法 选取温州医科大学附属第二医院育英儿童医院2018年10月至2020年10月收治的40例接受芬太尼连续使用天数≥10 d的PICU患儿作为研究对象,根据索菲亚戒断症状量表(SOS)评分分为有IWS组(SOS≥4)14例与无IWS组(SOS≤3)26例,检测两组患儿停药前后的唾液皮质醇水平,比较两组唾液皮质醇变化水平。 结果 有IWS 组在停药后3 d 8~10点唾液皮质醇浓度均值为(4.18±1.53)ng/ml,高于无IWS组停药后3 d 8~10点唾液皮质醇浓度均值(3.89±0.90)ng/ml,差异有统计学意义(P<0.05),其他时间段比较,差异均无统计学意义(P>0.05)。结论 有IWS组患儿停药后唾液皮质醇浓度高于无IWS组,运用唾液皮质醇水平来评估IWS可能存在一定的临床意义,有待以后更大样本量的进一步研究。
[关键词] 儿童重症监护室;医源性戒断反应;索菲亚戒断症状量表;唾液皮质醇
[中图分类号] R749.4 [文献标识码] B [文章编号] 1673-9701(2022)02-0096-04
Clinical significance of salivary cortisol levels in the assessment of iatrogenic withdrawal responses in children
BAO Shihui1 ZHENG Ying1 CHEN Lijia1 CHEN Binwu1 LIN Lingjie2
1.Department of Pharmacy, the 2nd Affiliated Hospital and Yuying Children′s Hospital of WMU, Wenzhou 325000, China; 2.Pediatric Intensive Care Unit, the 2nd Affiliated Hospital and Yuying Children′s Hospital of WMU, Wenzhou 325000, China
[Abstract] Objective To explore the clinical significance of salivary cortisol levels in the assessment of iatrogenic withdrawal symptoms (IWS) in children in the pediatric intensive care unit (PICU). Methods A total of 40 children in PICU admitted to the 2nd Affiliated Hospital and Yuying Children′s Hospital of WMU from October 2018 to October 2020 who received fentanyl for≥10 d of continuous use were selected as the study subjects. According to the score of the Sophia Observation withdrawal Symptoms scale (SOS), they were divided into the group with IWS group (SOS≥4, n=14) and the group without IWS group (SOS≤3, n=26). The salivary cortisol levels of children in the two groups were measured before and after drug withdrawal, and the changes in salivary cortisol levels in the two groups were compared. Results The average salivary cortisol concentration in the with IWS group was (4.18±1.53) ng/ml, higher than that in without IWS group (3.89±0.90)ng/ml at 8: 00-10: 00 p.m. three days after drug withdrawal, with statistically significant difference(P<0.05). However, there were no statistically significant differences in the other times results(P>0.05). Conclusion The salivary cortisol concentration in the children with IWS group is higher than that in the children without IWS group after drug withdrawal. The application of salivary cortisol level to assess IWS may have some clinical significance, but it needs to be confirmed by further studies with larger sample size in the future.
[Key words] Pediatric intensive care unit; Iatrogenic withdrawal responses; Sophia observation withdrawal symptoms scale; Salivary cortisol
镇痛和镇静治疗是儿童重症监护室(pediatric intensive care unit,PICU)重症患儿综合治疗的重要组成部分[1],研究显示[2],94%的PICU存在应用镇痛镇静药物患儿出现医源性戒断反应(iatrogenic withdrawal symptoms,IWS)的问题。重症患儿存在医源性镇痛镇静药物戒断反应的风险,IWS的发生,增加患儿导管异位等不良事件发生的风险、增加患儿痛苦、延长机械通气、住院时间及增加医疗成本等[2-7]。现阶段国外对儿童戒断症状的大部分研究仍集中于描述症状、发展评估工具、评价治疗效果等方面,对以可信的评估工具识别诊断儿童戒断症状的研究很少。目前,Dina[8]将戒断反应和唾液皮质醇联系起来并做相关研究,发现戒断前后,唾液皮质醇的浓度有所差异,对唾液皮质醇水平可以用于判断新生儿阿片类戒断反应这个问题也进行讨论,然而,国内几乎没有这方面的研究。本研究希望基于课题组前期基础[9-10],结合索菲亚戒断症状观察量表(sophia observation withdrawal symptoms scale,SOS)评分[11]探讨重症患儿唾液皮质醇水平在医源性戒断反应中的临床意义,进一步为临床提供理论参考依据,现报道如下。
1 资料与方法
1.1 一般资料
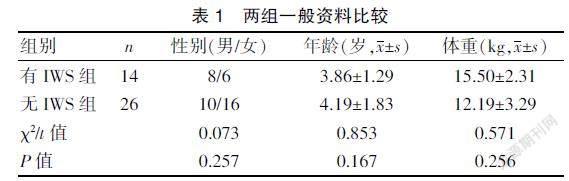
病例来源于温州医科大学附属第二医院2018年10月至2020年10月PICU收治的重症患儿。纳入标准为应用芬太尼药物连续使用时间≥10 d。排除标准:①有可能影响镇静水平评估的严重神经损伤或中枢神经系统损伤;②未完成评估前死亡、自动出院或转院的。本研究共收集40例芬太尼组患儿,其中男18例,女22例,年龄29 d~12岁。根据患儿是否发生戒断反应分为有IWS组(SOS≥4)和无IWS组(SOS≤3)。两组患儿性别、年龄、体重等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究获得医院医学伦理委员会批准,且患者知情同意。见表1。
1.2 方法
1.2.1 采用SOS量表[11]对PICU患儿镇痛和镇静药物戒断症状进行评估 共涵盖15项镇痛镇静药物戒断症状和体征评分项目,主要分为包括自主神经功能障碍、中枢神经系统功能障碍、胃肠功能障碍。其中自主神经功能障碍共4项,即心动过速、呼吸急促、发烧和出汗;中枢神经系统障碍共9项,即躁动、焦虑、震颤、运动障碍、肌张力增加、痛哭流泪、怪相、失眠和幻觉;胃肠功能障碍共2项,即呕吐和腹泻,以上15个项目,每个项目计1分。如果在过去8 h之内任意时刻符合症状或体征,就将其勾选,总分最大为15分,停药后每隔8 h评估1次,取当日最高分纳入研究样本,SOS评分一次或多次≥4组,即判断为阿片类戒断发生。
1.2.2 采用超高效液相-串联质谱方法,检测患儿唾液中皮质醇含量
1.2.2.1 色谱条件 色谱柱:Agilent ZORBAX Eclipse Plus C18 column(1.8 μm,2.1×50 mm,Agilent公司);流动相:采用梯度洗脱,包含A流动相(0.1%甲酸水)和B流动相(乙腈),各时间段比例变化如下:35%~95% B(0~1.5 min),95%~95% B(1.5~2.5 min)。流速为0.4 ml/min,进样体积为1 μl。
1.2.2.2 质谱条件 采用Agilent 1290系列高效液相系统串联6420系列电喷雾离子源(ESI)三重四极质谱仪用于质谱检测(Agilent公司)。掃描范围100~1500 m/z,毛细管电压为1.6 kV,离子源温度为150℃,脱溶剂气温度为500℃,锥孔气流量为50 L/h,脱溶剂气流量为800 L/h,氩气流量为0.15 ml/min。皮质醇的定量离子为363.2 m/z→120.9 m/z,碰撞电压140 V,碰撞能33 eV。
1.3 观察指标
记录研究对象的年龄、性别、体重、镇静镇痛药品种类、用药起始时间、暴露天数等,对患儿进行芬太尼药物停药后的SOS戒断症状进行评分。评分至停药后3 d(至72 h为止)。并于停药前1 d和停药后连续3 d上午8~10点和下午14~16点收集患儿唾液2 ml,然后用超高效液相-串联质谱检测,记录数据。
1.4 统计学处理
采用SPSS 18.0统计学软件对数据进行处理。计量资料用(x±s)表示,采用t检验,计数资料用[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
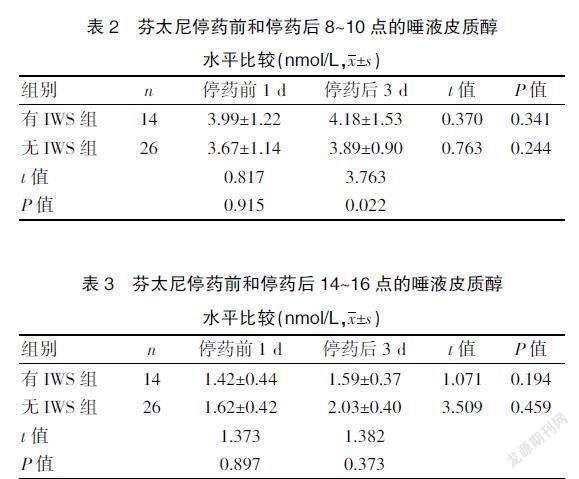
两组患儿停药前和停药后连续3 d 8~10点和14~16点的唾液皮质醇水平检测,其中有IWS组和无IWS组在停药后3 d 8~10点的唾液皮质醇浓度比较,差异有统计学意义(P<0.05),其他时间段比较,差异均无统计学意义(P>0.05)。见表2~3。
3 讨论
3.1 重症患儿存在医源性镇痛镇静药物戒断反应的风险
随着我国PICU开展舒适医疗,以及儿童镇痛镇静专家共识不断更新,阿片类(如芬太尼)药物已成为PICU应用最广泛的镇痛镇静药物[1]。阿片类药物一般持续使用数天到数周,大剂量或长时间应用易出现药物生理性依赖,撤药时易出现医源性戒断反应,表现为神经系统过度紧张、自主神经系统失调及胃肠道功能障碍。文献报道PICU镇痛镇静药物戒断症状的发生率为5%~87%[11-17],发生率差异很大。
3.2 缺乏医源性戒断症状识别手段
戒断反应无特征性的临床表现,易与其他疾病症状混淆,难以识别。这使得臨床诊断不明确,增加患儿其他不必要的检查及治疗。医源性戒断反应成为PICU面临的棘手问题,迫切需要去解决。
国外大部分研究侧重于描述重症患儿戒断的症状特征[6],索菲亚戒断症状观察量表(sophia observation withdrawal symptoms scale,SOS)是国际上推荐用于PICU判断戒断症状的一个量化表,被认为在PICU中识别戒断症状的有效可靠工具[18],SOS量表特异度为0.93,敏感度为0.83,Co-hen's Kappa在0.73~1.00之间,组内相关系数0.97,SOS量表具有较高的评估者间信度,但是SOS表的主观判断及低龄患儿无法表达等局限性,SOS一些评估项目很难用于低龄儿童中枢神经系统(躁动、焦虑、震颤、运动障碍、肌张力增加、痛哭流泪、怪相、失眠、幻觉)评估。我国尚无有效的评价系统对重症患儿的戒断症状进行评价[1],也无重症患儿戒断症状识别和管理的指南,更别提有关明确指标来识别戒断症状的研究报道。
3.3 唾液皮质醇有望成为戒断反应的识别手段
本研究描述了一种新的方法来检测唾液皮质醇水平作为医源性戒断反应的生物标志物。直观有效的指标更有利于临床诊断,避免与自身疾病症状混淆。研究发现,急性乙醇戒断会激活HPA,血浆皮质醇水平增加[19-20]。皮质醇是机体认知、行为、代谢及免疫活动等不可或缺的糖皮质激素,其分泌受下丘脑-垂体-肾上腺轴(HPA)调控。当机体受到应激,包括突然戒烟戒酒及撤药减药(长期使用阿片类),HPA 轴被激活,下丘脑释放促肾上腺皮质激素→激活垂体释放促肾上腺皮质激素→肾上腺皮质分泌皮质醇入血[21]。血浆中游离的皮质醇可以快速进入唾液,并在这两者间迅速达到平衡。唾液几乎包含所有血液的生化指标,可以反映血液中的同一时间水平。唾液游离态皮质醇浓度接近血液游离态皮质醇浓度,且唾液样本的采集简便,作为一种非侵入性的采集方法有效地避免因采血对受试者造成的疼痛、恐惧、紧张等应激反应。唾液样本容易采集,常作为无创检测的重要标本来源[23]。唾液皮质醇在室温下也相对稳定,不受皮质类固醇结合球蛋白和唾液流量的影响。因此用唾液皮质醇代替血液皮质醇是一种更方便、更快捷的选择。
2020年,Rodriguez等[23]在《儿科研究》杂志上提出了将唾液皮质醇作为判断产妇产前接触阿片类药物致新生儿戒断严重程度的生物标志物,并发现戒断症状严重的新生儿唾液皮质醇水平比较高。Dina[8]对唾液皮质醇可以用于判断新生儿阿片类戒断反应严重程度的这个问题也进行了讨论,这表示阿片类药物戒断反应在低年龄患儿中得到重视,同时也说明用唾液皮质醇来判断戒断反应的严重程度是可行的。
本研究纳入的40例患儿中,其中14例患儿有IWS,总体发生率为35%,笔者对患儿唾液皮质醇水平分别在上午8~10点和下午14~16点检测,主要是考虑患儿本身体内皮质醇生理时相的改变,正常情况下,唾液皮质醇的代谢具有一定的生理规律,下午及夜间睡眠时浓度较低,清晨醒来后早上浓度高,检测2个时间段更有利于对数据的分析。本研究选取停药前和停药后的唾液样本进行检测,主要目的区分芬太尼停药前后结合SOS评分来关联唾液皮质醇水平的变化。本研究结果显示,有IWS组在停药后3 d的唾液皮质醇8~10点的浓度高于无IWS组停药后3 d的水平,差异有统计学意义(P=0.022<0.05),这也提示IWS发生与唾液皮质醇水平升高可能存在临床意义。研究结果显示,有IWS组在停药后3 d的唾液皮质醇8~10点和14~16点的浓度均值皆高于停药前1 d的水平,但差异无统计学意义(P>0.05),此结果提示不同于理论推测及文献报道[23],这可能与IWS患儿中长期接受慢性应激刺激有关,对外界压力的反应能力和通过HPA轴维持体内平衡的能力不能较好的自我调节从而导致唾液皮质醇的浓度降低。
3.4 局限性
本研究由于样本量较小,不足以充分地反映SOS评分与重症患儿唾液皮质醇浓度的密切联系,对于相关性的探讨存在局限。其次,本研究对象主要是重症患儿,一些不可避免的并发症等也是干扰因素。唾液皮质醇是否是戒断反应的临床生物标志物还需要大样本前瞻性研究进一步阐明。
综上所述,PICU患儿存在医源性戒断反应的风险,未来的研究应集中在直观有效的指标以准确辨识高危患儿,做出合理的防治护理,唾液皮质醇水平在IWS评估中值得进一步去研究。本研究样本量较少,方法较为单一,可能对相关数据的准确性存在一定影响,尚需进一步研究。
[参考文献]
[1] 中华医学会儿科学分会急救学组,中华医学会急诊医学分会儿科学组,中国医师协会儿童重症医师分会.中国儿童重症监护病房镇痛和镇静治疗专家共识(2018版)[J].中华儿科杂志,2019,57(5):324.
[2] 春晓,马敬香,杨红梅,等.PICU儿童医源性戒断综合征的研究进展[J].广东医学,2019,15:2258-2261.
[3] Hanna J,Swetter S.A case of delirium and rhabdomyolysis in severe iatrogenic opioid withdrawal[J].Psychosomatics,2018,59(4):405-407.
[4] Tanaka.Risk factor of withdrawal syndrome in the pediatric ICU[J].Critical Care,2014,18(Suppl 1):421.
[5] 高嘉颖,钱娟,王筱金,等.儿童重症监护病房镇痛镇静治疗撤药模式对戒断综合征的影响[J].中华儿科杂志,2020(4):284-289.
[6] Chiu AW,Contreras S,Mehta S. Iatrogenic opioid withdrawal in critically Ⅲ patients:A review of assessment tools and management[J]. Annals of Pharmacotherapy,2017, 51(12):1099-1111.
[7] Best KM,Wypij D,ASARO LA,et al. Patient,process,and system predictors of iatrogenic withdrawal syndrome in critically ill children[J]. Crit Care Med,2017,45(1):e7.
[8] Dina E. El-Metwally.Commentary on salivary cortisol levels as a biomarker for severity of withdrawal in opioid-exposed newborns[J].Pediatr Res,2020,87(6):982-983.
[9] 鲍仕慧,陈丽佳,郑映,等.医源性阿片类药物戒断在儿童ICU中的评估研究[J].中国现代应用药学,2017(10):1459.
[10] 鲍仕慧,郑映,娄鹏程,等.重症患儿医源性阿片类戒断的风险因素研究[J].中国现代应用药学,2020,37(3):339.
[11] Ista E,De HM,Tibboel D,et al.Psychometric evaluation of the sophia observation withdrawal symptoms scale in critically ill children[J].Pediatr Crit Care Med,2013,14(8):761-769.
[12] Vipond JM,Heiberger AL,Thompson PA,et al.Shortened taper duration after implementation of a standardized protocol for iatrogenic benzodiazepine and opioid withdrawal in pediatric patients:Results of a cohort study[J].Pediatr Qual Saf,2018,3(3):e079.
[13] Curley MA,Wypij D,Watson RS,et al.Protocolized sedation vs usual care in pediatric patients mechanically ventilated for acute respiratory failure:A randomized clinical trial[J]. JAMA,2015,313(4):379-389.
[14] Fernández-Carrión F,Gaboli M,González-Celador R,et al.Withdrawal syndrome in the pediatric intensive care unit Incidence and risk factors[J].Med Intensiva,2013,37(2):67-74.
[15] Best KM,Boullata JI,Curley MAQ.Risk factors associated with iatrogenic opioid and benzodiazepine withdrawal in critically ill pediatric patients:A systematic review and conceptual model[J].Pediatr Crit Care Med,2015,16(2):175-183.
[16] Fisher D,Grap MJ,Younger JB,et al.Opioid withdrawal signs and symptoms in children:Frequency and determinants[J].Heart Lung,2013,42(6):407-413.
[17] 亓秀梅,王芹,杨雪,等.机械通气患儿镇痛镇静管理方案的制订及实施效果[J]. 中国实用护理杂志,2018, 34:2675-2682.
[18] Motta E,Luglio M,Delgado AF,et al.Importance of the use of protocols for the management of analgesia and sedation in pediatric intensive care unit[J]. Rev Assoc Med Bras,2016,62(6):602-609.
[19] Blaine SK,Sinha R.Alcohol,stress,and glucocorticoids:From risk to dependence and relapse in alcohol use disorders[J].Neuropharmacology,2012,122:136-147.
[20] Edwards S,Little HJ,Richardson HN,et al.Divergent regulation of distinct glucocorticoid systems in alcohol dependence[J].Alcohol,2015,49(8):811-816.
[21] Hyun DG,Huh JW,Hong SB,et al.Iatrogenic opioid withdrawal syndrome in critically ill patients:A retrospective cohort study[J].J Korean Med Sci,2020,35(15):e106.
[22] 倪新強,张晓丽,李利民,等.唾液检测在儿科疾病诊疗中的应用进展[J].临床儿科杂志,2017(5):394-399.
[23] Rodriguez N,Vining M,Bloch-Salisbury E.Salivary cortisol levels as a biomarker for severity of withdrawal in opioid-exposed newborns[J].Pediatr Res,2020,87(6):1033-1038.
(收稿日期:2021-02-02)
3595501908225
