预防性肝动脉灌注化疗对胰腺癌术后长期生存的影响
2022-03-09陶玉龙冯文明黄三雄
陶玉龙 冯文明 黄三雄
[摘要] 目的 探讨预防性肝动脉灌注化疗(HAIC)对胰腺癌(PC)术后长期生存的影响。 方法 收集2010年6月至2015年5月间在湖州师范学院附属第一医院接受手术切除的87例PC患者资料。根据术后辅助化疗模式,将患者分为HAIC组(n=43)和对照组(n=44)。HAIC组术后接受2个周期HAIC和4个周期静脉化疗,对照组接受6个疗程静脉化疗。观察两组长期生存情况及化疗毒性。 结果 HAIC组5年总生存率为25.58%,对照组为18.18%,HAIC组显著高于对照组(P<0.05)。两组的毒副作用比较,差异无统计学意义(P>0.05),无化疗相关死亡发生。 结论 预防性肝动脉灌注化疗可显著改善胰腺癌术后患者长期生存,且安全性好。
[关键词] 胰腺癌;肝动脉灌注化疗;静脉化疗;长期生存
[中图分类号] R735.9 [文献标识码] B [文章编号] 1673-9701(2022)02-0053-04
Effect of preventive hepatic arterial infusion chemotherapy on long-term survival after pancreatic cancer surgery
TAO Yulong FENG Wenming HUANG Sanxiong
Department of Surgery, the First Affiliated Hospital of Huzhou Teachers College, Huzhou 313000, China
[Abstract] Objective To investigate the effect of preventive hepatic arterial infusion chemotherapy (HAIC) on long-term survival after pancreatic cancer (PC) surgery. Methods The data of 87 PC patients who underwent surgical resection in the First Affiliated Hospital of Huzhou Teachers College from June 2010 to May 2015 were collected. They were divided into the HAIC group (43 patients) and the control group (44 patients), according to the mode of postoperative adjuvant chemotherapy. The HAIC group were given 2 courses of HAIC and 4 courses of intravenous chemotherapy after surgery, and the control group were given 6 courses of intravenous chemotherapy. The long-term survival and chemotherapy toxicity were observed and compared between the two groups. Results The 5-year overall survival rate of the HAIC group was 25.58%, which was significantly higher than that of the control group as 18.18%(P<0.05). There were no significant differences in toxicity and side effects between the two groups(P>0.05). There were no chemotherapy-related deaths occurred. Conclusion Preventive hepatic artery infusion chemotherapy can significantly improve the long-term survival of patients with pancreatic cancer after surgery, with good safety.
[Key words] Pancreatic cancer; Hepatic arterial infusion chemotherapy; Intravenous chemotherapy; Long-term survival
胰腺癌(pancreatic cancer, PC)目前仍然是致死率極高的恶性消化道肿瘤,即使在接受根治性胰腺切除术后5年总体生存率仍低于10%[1-2]。胰腺癌术后复发率居高不下,中位生存期仅接近1年,这表明单纯手术是不够的[3-4]。因此术后复发是胰腺癌根治性切除后治疗失败的常见原因[5]。化疗是胰腺癌根治性切除后最重要的治疗策略之一,但目前常用的化疗仍不能达到满意的临床疗效,且不良反应严重[6-8]。因此,开发一种新的治疗模式具有重要的价值。先前的研究显示,肝动脉灌注化疗(hepatic arterial infusion chemo-therapy,HAIC)可显著预防结直肠癌术后异时性肝转移,改善预后。因此,本回顾性研究旨在探讨HAIC是否具有改善胰腺根治性切除术后患者长期生存的潜力,现报道如下。
1 资料与方法
1.1 一般资料
收集2010年6月至2015年5月间在湖州师范学院附属第一医院接受胰腺癌根治手术的87例胰腺癌患者的医疗档案。纳入标准[9]:①病理证实为胰腺导管腺癌者;②既往未接受抗肿瘤治疗者;③KPS评分(KPS)≥70分者;④切除后生存时间>6个月者;⑤Child-Pugh分级为A~B级者;⑥骨髓和肾功能正常者;⑦年龄18~75岁。排除标准[9]:①不可切除的胰腺癌者;②术后生存期<6个月,无法耐受化疗者。
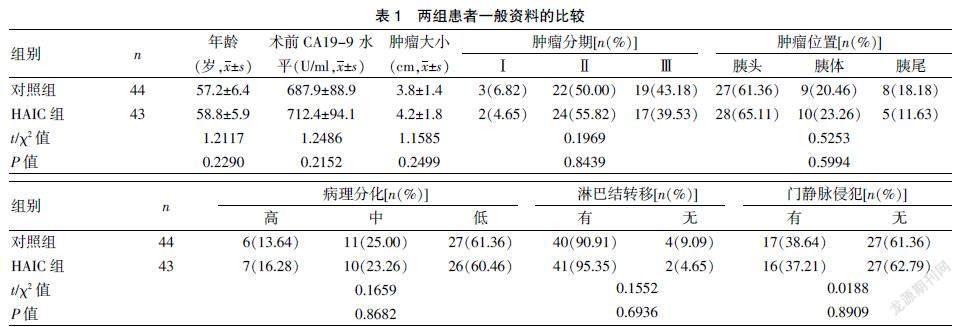
根据术后辅助化疗模式,将患者分为HAIC组(n=43)和对照组(n=44)。HAIC组术后接受2疗程HAIC和4疗程静脉化疗,本研究经医院医学伦理委员会批准执行,且患者对本研究知情同意。对照组接受6疗程静脉化疗。两组患者在性别、年龄、术前CA19-9 水平、肿瘤位置、肿瘤分期、病理分化、淋巴结转移和门静脉侵犯情况等方面比较,差异无统计学意义(P>0.05),具有可比性。见表1。
1.2 方法
术后28 d内开始化疗,每4周进行一次。其中43例患者术后接受2个疗程HAIC序贯4个疗程全身化疗(HAIC组),44例患者接受6个疗程全身化疗(对照组)。HAIC和全身化疗方案均包括5-FU(1000 mg/m2,d1)(上海旭东海普药业有限公司,国药准字H31020593,规格:0.25 g/支)和吉西他滨(800 mg/m2,分别于第1天和第8天给药)(江苏豪森药业集团有限公司,国药准字 H20030104,规格:0.2 g/支)。HAIC组化疗药物通过导管灌注,采用Seldinger技术将导管一端插入肝总动脉或肝固有动脉,另一端连接输液泵,注射结束后,拔除管路。对照组化疗药物通过中心静脉给药。
1.3 观察指标
对这些患者的病历资料进行回顾性分析。收集并比较两组患者基线特征、并发症、毒性和长期生存率。化疗中止的标准为出现危及生命的并发症或者患者要求停止化疗。
所有患者术后1年内每月随访一次,术后每3个月随访一次。随访包括体格检查、生化检查、肿瘤标记物检测、胸腹CT检查。复发或转移需通过影像学检查,必要时进行活檢。一旦诊断出复发或转移,就给予相同方案的重复化疗,如果疾病没有得到控制,则采用二线化疗方案。
1.4 统计学方法
采用SPSS 18.0 统计学软件对数据进行分析,计量资料以均数±标准差(x±s)表示,采用t检验进行比较。计数资料采用χ2检验进行比较。采用Kaplan-Meier法绘制生存曲线,并采用Log-rank检验进行比较,以P<0.05为差异有统计学意义。
2 结果
2.1 两组5年生存率的比较
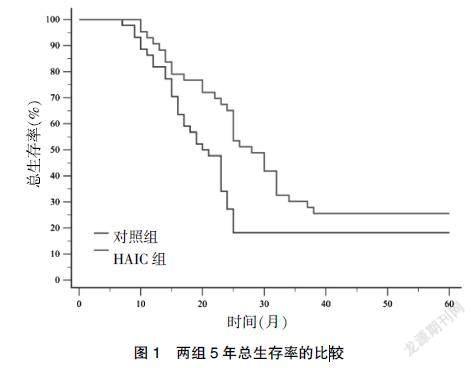
术后5年内,HAIC组和对照组分别死亡32例和36例,HAIC组5年总生存率为25.58%,对照组5年总生存率为18.18%。HAIC组5年总生存率显著高于对照组(P<0.05)。见图1。
2.2 两组化疗毒副反应的比较
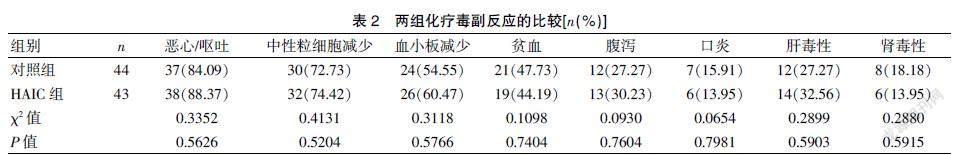
两组患者在恶心/呕吐、中性粒细胞减少、血小板减少、贫血、腹泻、腹泻、口炎、肝毒性和肾毒性等化疗相关毒副作用无显著性差异。两组均未发现化疗相关死亡及危及生命的毒性或并发症。所有患者完成了6个疗程的化疗。所有不良反应及并发症均经对症治疗得到改善。HAIC术后有3例患者股动脉穿刺部位出现血肿,经采用压力绷带进行控制后好转。见表2。
3 讨论
胰腺腺癌仍然是现代医学的难题,手术切除仍是唯一根治术手段,但是80%~90%的患者在确诊时已失去根治性手术的机会[10-11]。为了提高胰腺癌患者的长期生存率,外科医生通常进行根治性胰腺切除术,包括广泛清扫淋巴结,完整切除肠系膜上动脉或腹腔干周围胰周神经丛[12-15]。然而,即使是接受了根治性切除的患者,切除后的复发率仍然很高,有研究显示胰腺癌术后复发率为60%~80%,5年生存率仅为8%~26%[16-18]。术后辅助化疗是可切除胰腺腺癌治疗的关键部分,能显著降低术后复发率,并增加5年生存率[19-21]。近年来,对胰腺癌的治疗方面取得了巨大的进展,尤其是特异性肿瘤分子标记研究使得分子靶向、免疫治疗均取得了显著的效果[22-24]。然而,对胰腺癌的治疗及预后仍有很大的改进空间。
虽然术后辅助治疗的生存获益已被证实,但是对治疗模式仍存在争议。争议主要是围绕着是否化疗单独使用还是使用多模式治疗联合。肝转移是胰腺根治性切除术后最常见的远处转移方式。肝动脉灌注化疗是一种公认的治疗和预防结直肠癌肝转移的手段[25]。有研究表明,肝动脉灌注化疗对不可切除的胰腺癌和肝切除后的肝转移带来生存获益,并有助于预防肝癌切除后的肝癌复发[9,26]。因此,肝动脉灌注化疗可能是预防胰腺癌术后肝转移的有效治疗手段,因为化疗药物通过肝动脉循环灌注可以达到高局部浓度和最小的全身副作用。
吉西他滨和5-FU的动脉灌注化疗最近被报道用于局部晚期胰腺癌和胰腺癌的肝转移[27]。此外,在一些I期研究中,肝动脉灌注化疗使用吉西他滨化疗在注入1000 mg/m2时耐受良好。根据吉西他滨的药代动力学,当通过静脉输注1000 mg/m2吉西他滨超过30 min,15 min平均最大血浆浓度达到(21.865±4.165)ng/ml。据报道,肝固有动脉的血流量约为330 ml/min。当800毫克的吉西他滨在30 min内注入到肝固有动脉, 肝脏局部的血浆药物浓度可达到大约80 000 ng/ml。研究显示肝动脉灌注化疗时吉西他滨的最大耐受剂量是1400 mg/m2。另一方面,有研究者[28]在5 h将100~1500 mg的5-FU注入肝动脉,血浆中最大浓度平均为0.48 μg/ml,而且没有出现3级不良反应。
研究表明,与单用吉西他滨相比,吉西他滨联合氟尿嘧啶药物可显著提高胰腺癌患者的总生存期,提高1年生存机率和客观应答率,因此,吉西他滨联合氟尿嘧啶药物可能被认为是胰腺癌患者可接受的替代治疗[29]。本研究中,肝动脉灌注化疗和全身化疗方案均包括5-氟尿嘧啶和吉西他滨。本研究中,肝动脉灌注化疗组患者的总生存率明显高于对照组,此生存获益可能是由于减少了肝脏复发率。同时,本研究也证实肝动脉灌注化疗的安全性。肝动脉灌注化疗组的毒性和并发症与对照组相似。两组患者的症状均未出现危及生命的并发症,且所有并发症及副反应均通过保守治疗加以控制。
綜上所述,肝动脉灌注化疗具有提高胰腺根治性切除术后胰腺癌患者长期生存几率的潜力。由于本研究具有回顾性和样本量小的特点,需要进一步进行更大样本量的前瞻性研究来证实本文的研究结果。
[参考文献]
[1] Audrey V,Joseph H,Rich S,et al. Pancreatic cancer[J].Lancet,2011,378(9791):607-620.
[2] 王成锋. 基于胰腺癌防治现状的思考[J].中华胰腺病杂志,2020,20(5):353-355.
[3] Torphy RJ,Fujiwara Y,Schulick RD. Pancreatic cancer treatment:Better,but a long way to go[J]. Surgery Today,2020,50(10): 1117-1125.
[4] Hosein AN,Brekken RA,Maitra A. Pancreatic cancer stroma: An update on therapeutic targeting strategies[J].Nature reviews Gastroenterology & hepatology,2020,17(8):487-505.
[5] 齐建军.联合门静脉/肠系膜上静脉切除重建的胰十二指肠切除术治疗胰腺癌的临床探讨[J].当代医学,2021,27(1):79-81.
[6] 徐刚,李宇,王春,等.术后辅助化疗对胰腺癌根治术后患者生存期的影响[J]. 中国肿瘤临床与康复,2018,25(6):651-653.
[7] 张晓萌,麻宁一,祝鸿程,等. 胰腺癌术后辅助性放化疗的效果及预后因素分析[J].中国癌症杂志,2020,30(7):519-524.
[8] Springfeld C,Jager D,Buchler MW,et al. Chemotherapy for pancreatic cancer[J]. Presse Med,2019,48(3):e159-e174.
[9] Wang Y,Xu Y,Zheng Y,et al. Postoperative hepatic arterial infusion chemotherapy improved survival of pancreatic cancer after radical pancreatectomy:A retrospective study[J]. OncoTargets and Therapy,2018,11(1):903-907.
[10] Mc GA,Kelly P,Turkington RC,et al. Pancreatic cancer:A review of clinical diagnosis,epidemiology,treatment and outcomes[J]. World Journal of Gastroenterology,2018,24(43):4846-4861.
[11] Chu LC,Goggins MG,Fishman EK. Diagnosis and detection of pancreatic cancer[J]. Cancer J,2017,23(6):333-342.
[12] Neoptolemos JP,Kleeff J,Michl P,et al.Therapeutic developments in pancreatic cancer:Current and future perspectives[J].Nature Reviews Gastroenterology & Hepatology,2018,15(6):333-348.
[13] Strobel O,Neoptolemos J,Jager D,et al. Optimizing the outcomes of pancreatic cancer surgery[J]. Nature Reviews Clinical Oncology,2019,16(1):11-26.
[14] Schneider M,Strobel O,Hackert T,et al.Pancreatic resection for cancer-the heidelberg technique[J].Langenbeck's Archives of Surgery,2019,404(8):1017-1022.
[15] Acher AW,Bleicher J,Cannon A,et al. Advances in surgery for pancreatic cancer[J].Journal of Gastrointestinal Oncology,2018,9(6):1037-1043.
[16] Barhli A,Cros J,Bartholin L,et al.Prognostic stratification of resected pancreatic ductal adenocarcinoma:Past,present,and future[J].Digestive and Liver Disease:Official Journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver,2018,50(10):979-990.
[17] Feng Q,Li C,Zhang S,et al. Recurrence and survival after surgery for pancreatic cancer with or without acute pancreatitis[J]. World Journal of Gastroenterology,2019, 25(39):6006-6015.
[18] Kovac JD,Mayer P,Hackert T,et al. The time to and type of pancreatic cancer recurrence after surgical resection:Is prediction possible?[J].Academic Radiology,2019, 26(6):775-781.
[19] Altman AM,Wirth K,Marmor S,et al. Completion of adjuvant chemotherapy after upfront surgical resection for pancreatic cancer is uncommon yet associated with improved survival[J]. Annals of Surgical Oncology,2019,26(12):4108-4116.
[20] Conroy T,Ducreux M. Adjuvant treatment of pancreatic cancer[J]. Current Opinion in Oncology,2019,31(4):346-353.
[21] Parmar A,Chaves PJ,Saluja R,et al.Adjuvant treatment for resected pancreatic adenocarcinoma:A systematic review and network meta-analysis[J].Critical Reviews in Oncology/Hematology,2020,145(1):102 817.
[22] Zhang J,Wolfgang CL,Zheng L.Precision immuno-oncology:Prospects of individualized immunotherapy for pancreatic cancer[J].Cancers,2018,10(2):39.
[23] Pushalkar S,Hundeyin M,Daley D,et al.The pancreatic cancer microbiome promotes oncogenesis by induction of innate and adaptive immune suppression[J].Cancer Discovery,2018,8(4):403-416.
[24] Aroldi F,Zaniboni A.Immunotherapy for pancreatic cancer:present and future[J].Immunotherapy,2017,9(7):607-616.
[25] Wang Y,Sun XR,Feng WM,et al.Postoperative prophylactic hepatic arterial infusion chemotherapy for stage III colorectal cancer:A retrospective study[J]. OncoTargets and Therapy,2016,9(1):5897-5902.
[26] Hashimoto A,Tanaka T,Sho M,et al.Adjuvant hepatic arterial infusion chemotherapy after resection for pancreatic cancer using coaxial catheter-port system compared with conventional system[J]. Cardiovascular and Interventional Radiology,2016,39(6):831-839.
[27] Chen Y,Liao Y,Lam LM,et al.Pretreatment biomarkers as prognostic predictors of survival in patients with pancreatic cancer treated with gemcitabine-based therapy and 5-fluorouracil:Neutrophil-to-lymphocyte ratio vs platelet-to-lymphocyte ratio[J]. International Journal of Medical Sciences,2020,17(10):1449-1457.
[28] Li JQ,Yang JC,Liang JX,et al.Pharmacokinetic study and clinical evaluation of a slow-release 5-fluorouracil implant in pancreatic cancer patients[J].Anti-Cancer Drugs,2016,27(1):60-65.
[29] Oettle H,Riess H.Gemcitabine in combination with 5-fluorouracil with or without folinic acid in the treatment of pancreatic cancer[J].Cancer,2002,95(4 Suppl):912-922.
(收稿日期:2021-05-11)
3735501908287
