苯酚降解菌Y_1的分离与鉴定
2022-03-08叶子兰吴生亮姜立春阮期平
叶子兰,吴生亮,姜立春,阮期平
(1.绵阳师范学院 资源环境工程学院,四川 绵阳 621000; 2.绵阳师范学院分子生物学与生物制药重点实验室,四川 绵阳 621000)
引 言
苯酚,又名石炭酸,最早是由德国化学家龙格在煤焦油中发现的,现已成为一种重要的有机化工原料,广泛应用于皮革生产、塑料制造、石油炼制和医药合成等工业。苯酚及其衍生物是一类芳香族化合物,释放到环境中对人类健康和动植物的生长均会造成不利影响[1]。随着我国工业化进程的加快,苯酚的需求和消耗也随之增加,大量酚类物质及其衍生物在土壤和水体中的排放和积累导致了生态环境的日趋恶化,许多国家已将其列入环境优先控制污染物的黑名单中[2]。因此,如何去除苯酚及其衍生物,成为了污水处理不可忽视的重要课题。
目前,清除工业废水中苯酚的方法有很多[3-4],微生物降解因其成本低、效率高、无二次污染以及生态恢复性好等优点[5]而得到更广泛的应用。国内外众多学者已经分离鉴定了许多不同种类的苯酚降解菌,包括红球菌属(Rhodococcussp.)[6]、节杆菌(Arthrobactersp.)[7]、丝孢酵母菌属(Trichosporonsp.)[8]、假丝酵母菌属(Candidasp.)[9]、布鲁氏杆菌属(Brucellasp.)[10]、黏质沙雷氏菌属(Serratiamarcescens)[11]、泛菌属(Pantoeasp.)[12]、葡萄球菌属(Staphylococcus sp.)[13]、肠杆菌属(Enterobacter)[14]、沼泽考克氏菌(Kocuriapalustris)[15]、不动杆菌属(Acinetobacter)[16]、乙酸钙不动杆菌(Acinetobactercalcoaceticus)[17]、芽孢杆菌属(Bacillus)[18~21]和假单胞菌(Pseudomon-assp.)[22~24]等。这些已报道的苯酚降解菌中,有的菌种对苯酚浓度的耐受度低,有的菌种降解苯酚所需的周期过长,若将这些菌种用于生物法降解苯酚,还需对其做进一步的研究,改良特性以提高对苯酚的降解能力。因此,从特殊污染环境中分离降解能力强、环境适应能力强、应用潜力大的菌株,仍然十分必要[25]。本实验室从绵阳某绝缘材料厂的活性污泥中分离、筛选出菌种Y_1,利用形态学观察、生理生化鉴定和16S rDNA序列分析对其进行分类鉴定,考察了该菌株降解苯酚的能力。旨在找到能高效降解苯酚的优势菌株,为今后研究含酚废水的处理方法奠定基础。
1 实验材料和方法
1.1 实验材料
1.1.1 菌种来源
菌种来自绵阳某绝缘材料厂的活性污泥中。
1.1.2 仪器与设备
高压灭菌锅、超净工作台、恒温培养箱、摇床、光学显微镜、pH计、高速冷冻离心机、PCR扩增仪、电泳仪及电泳槽、凝胶成像仪、紫外可见分光光度计。
1.1.3 培养基
富集培养基[26]:牛肉膏3g、蛋白胨10g、NaCl 5g,上述组分溶解后加蒸馏水定容至1L,将pH调节至7.0~7.2。固体培养基则在其原有配方中加入2%的琼脂。
驯化筛选培养基:在富集培养基的基础上,按实验需要加入相应浓度的苯酚。
无机盐培养基[27]:K2HPO40.5g、KH2PO40.5g、NaCl 0.2g、NH4NO31g、MgSO40.2g、CaCl20.2g、FeSO4·7H2O 0.01g、MnSO4·H2O微量,苯酚(按实验需要加入),加蒸馏水定容至1 L,将pH调节至7.0~7.2。
1.2 实验方法
1.2.1 苯酚降解菌的驯化、筛选与分离
取10g活性污泥加入100 mL蒸馏水,于30℃、200 r/min的条件下在摇床中充分振荡半小时,静置后取上清液10 mL,加入到100 mL苯酚浓度为100 mg/L的驯化筛选培养基中,30℃、180 r/min摇床培养三天[28]。12 000 rpm/min离心10 min,弃上清。用生理盐水将菌体沉淀洗涤两次,再加入10 mL无菌水制成菌悬液。按2%的接种量接入苯酚初始浓度为100 mg/L的无机盐培养基中,按200 mg/L的梯度依次提高苯酚浓度,直到最高浓度为1 500 mg/L。淘汰不能利用苯酚的菌株,从而筛选出能降解苯酚且对其耐受能力较强的菌株。经过多次转接培养,将培养液按10-1、10-2、10-3、10-4、10-5、10-6和10-7七个梯度稀释,分别取100 μL涂布于苯酚浓度为500 mg/L的驯化筛选培养基平板上,30℃恒温培养20 h。挑取不同形态的单菌落接种到富集培养基中扩大培养,30℃、180 r/min振荡培养18h。用接种环取一环菌液,接种到富集培养基平板上,通过平板划线法分离得到纯菌株。
1.2.2 菌株的初步鉴定
1.2.2.1 形态学观察
将菌株接种到固体培养基上,放置在30℃的恒温培养箱中培养20 h,肉眼观察菌落的形状、大小、隆起度、边缘透明度与颜色等培养特征。在普通光学显微镜下难以看清细菌的形状和结构,因此,需要通过革兰氏染色、芽孢染色、荚膜染色和鞭毛染色等方法,将菌体染上颜色,从而借助颜色的反差作用观察菌体形态。经染色后利用光学显微镜观察革兰氏染色、形状、荚膜、芽孢以及鞭毛等菌体形态。
1.2.2.2 生理生化鉴定
主要选择了糖或醇类发酵试验(葡萄糖、甘露醇、阿拉伯糖、蔗糖、麦芽糖)、温度生长范围、pH生长范围、需氧性试验、硝酸盐还原、吲哚试验、硫化氢产生、明胶水解、酪素水解、淀粉水解、酪氨酸水解、耐盐性试验、过氧化氢酶的测定、卵磷脂酶的测定、甲基红试验、V-P试验、石蕊牛奶反应、溶菌酶抗性试验以及在pH 5.7的营养肉汤上的生长等19项试验进行检测,具体试验方法参照《微生物学实验手册》[29]和《微生物学实验技术》[30]。
1.2.3 细菌16S rDNA鉴定
参照文献[31]提取细菌总DNA。将细菌16S rDNA鉴定的通用引物作为上下游引物,以提取的菌株总DNA为模板进行PCR扩增。20 μL PCR反应体系:ddH2O 13.7 μL,10×Ex Taq buffer 2.0 μL,5u Ex Taq 0.2 μL,2.5mM dNTP Mix 1.6 μL,上游引物(5′-AGAGTTTGA TCCTGGCTCAG-3′)1 μL,下游引物(5′-GGTTACCTTGTTACGACTT-3′)1 μL,DNA模板0.5 μL。PCR反应条件:95℃预变性5 min,95℃变性30 s,56℃退火30 s,72℃延伸1.5 min,该步骤循环25次,最后72℃延伸10 min,于4℃冰箱保存。在进行DNA测序之前,检测PCR是否扩增成功。取2 μL PCR扩增产物进行1%琼脂糖凝胶电泳,经溴化乙锭染色后,用凝胶成像仪检测。将PCR扩增产物送至上海美吉生物医药科技有限公司进行16S rDNA测序。利用BLAST软件,将测得的序列与GenBank中已知序列进行比对,通过MEGA6.0软件采用邻接法(Neighbor-Joining)构建系统进化树[32-33]。
1.2.4 生长曲线的测定
细菌的生长要经过迟缓期、对数期、稳定期和衰退期四个阶段。在对数生长期,细菌生长速率最快,对碳源的利用率也最高。因此,测定菌株的生长曲线,将对数生长期内的菌种制备成种子液,用于苯酚降解实验。挑取两个单菌落接种到富集培养基中,32℃、180 r/min摇床振荡培养30 h。以未接种的富集培养基做空白对照,在600 nm波长下,每四小时测定OD值,以检测细菌浓度。为减少误差,取两组平行实验的平均值绘制生长曲线。
1.2.5 菌株的降酚特性
将平板上的单个菌落接种到富集培养基中,培养至对数生长期,制成菌悬液。筛选菌株Y_1时,发现该菌在苯酚浓度1 100 mg/L时能良好生长。因此,将菌株在苯酚浓度1 100 mg/L、pH 7.0~7.2、接种量4%、温度32℃、摇床转速180 r/min的条件下振荡培养,以不含苯酚的无机盐培养基为空白对照,采用4-氨基安替吡啉直接分光光度法[34]测定苯酚浓度。在相同条件下进行三组平行试验,取三组读数的平均值。依据苯酚标准曲线,计算出苯酚的降解率。
苯酚降解率计算公式:苯酚降解率=(接种前的苯酚浓度-生长消耗剩余的苯酚浓度)/接种前的苯酚浓度×100%
2 结 果
2.1 苯酚降解菌的驯化、筛选与分离
筛选出4株能以苯酚为唯一碳源生长的菌株,且对苯酚的耐受浓度均能达到1 500mg/L,分别命名为Y_1、Y_2、Y_3和Y_4。将4株菌在同一条件下培养:苯酚浓度800 mg/L、pH 7.2、接种量4%、温度32℃、摇床转速180 r/min,振荡培养30 h取样测定培养基苯酚浓度。4株菌对苯酚的降解情况见图1。由此可见,菌株Y_1的生长情况和降酚能力优于其他菌株。

图1 4株菌降酚情况Fig.1 Phenol reduction of 4 strains
2.2 菌株的初步鉴定
2.2.1 形态学观察
如图2所示,菌株Y_1形成的菌落呈圆形,不透明,表面隆起、湿润、光滑,边缘整齐,颜色为乳白色,不可在平板上滑动。菌株革兰氏染色呈阳性,细胞呈杆状,有荚膜,有芽孢,有鞭毛。

图2 在平板上的生长情况Fig.2 Strain Y_1 on medium
2.2.2 生理生化鉴定
对菌株Y_1进行生理生化实验鉴定,结果见下表。菌株可以分解葡萄糖和麦芽糖,产酸不产气,V-P反应结果为阳性,甲基红和吲哚实验结果为阴性。对比《伯杰氏细菌鉴定手册》[35]关于细菌的描述,菌株Y_1生理生化鉴定的结果基本符合芽孢杆菌的特征,再结合其形态学观察的结果,可以初步将该菌株确定为芽孢杆菌属(Bacillus)。

表 菌株Y_1的生理生化特征Tab. Physiological and biochemical characteristics of strain Y_1
2.3 16S rDNA分析
2.3.1 PCR扩增结果
以菌株Y_1基因组DNA为模板,经PCR扩增后得到一条约为1.5 Kb的DNA片段。电泳检测结果如图3所示,在约1 500 bp处有一清晰的条带,符合预期结果。
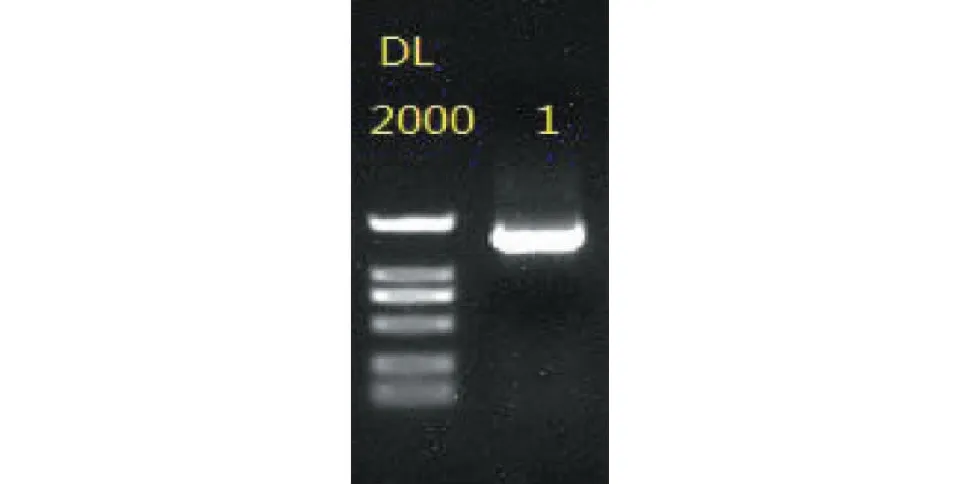
图3 电泳检测结果Fig.3 Electrophoresis results
2.3.2 系统进化树分析
测序后发现菌株Y_1的核苷酸序列共有1434 bp,符合预期。通过同源性比对可以发现,菌株Y_1与芽孢杆菌属相似度最高,选择了在种属水平最接近的19株菌,通过MEGA 6.0软件构建系统发育树,如图4所示。由图可知,菌株Y_1与蜡样芽孢杆菌(登录号:CP011153.1)的同源性高达99%,与苏云金芽孢杆菌(登录号:CP021061.1、CP015250.1、CP015176.1、CM000747.1、017208.1)也具有99%的同源性。结合其形态学观察和生理生化鉴定的结果,可以将菌株Y_1确认为苏云金芽孢杆菌(Bacillusthuringiensis)。
2.4 生长曲线的测定
对菌株Y_1的生长情况做了测定,由图5可知,当菌株培养8 h后进入对数生长期,在20h以后处于稳定生长阶段。在富集培养基中培养10h,当OD≈0.8时,菌种处于对数生长期初期,离心分离菌体制成种子液,用于后续苯酚降解实验。

图5 菌株Y_1生长曲线Fig.5 Growth curve of strain Y_1
2.5 菌株的降酚特性
2.5.1 苯酚浓度标准曲线的绘制
以苯酚浓度为横坐标,以吸光度(λ=510)为纵坐标,绘制苯酚浓度标准曲线。如图6所示。该苯酚浓度标准曲线表明,当波长等于510 nm时,苯酚浓度范围在2~20 mg/L之间,吸光度值Y和苯酚浓度X,满足线性方程Y=0.1456X+0.0089,R2=0.9996,表明二者呈良好的线性关系。
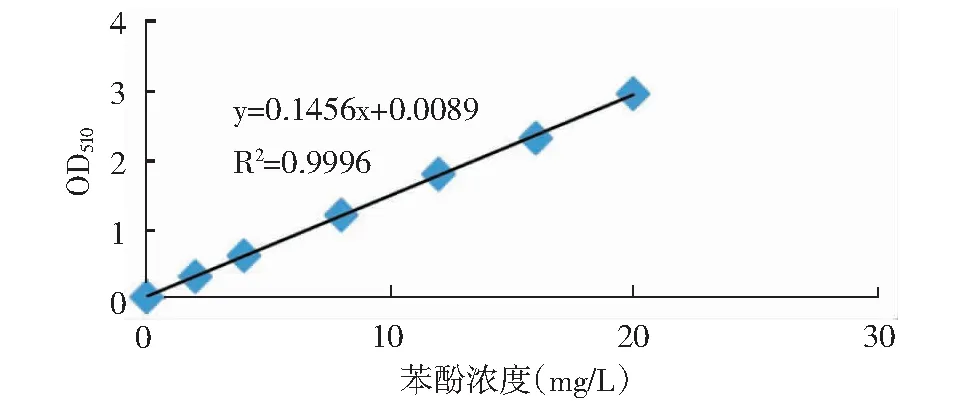
图6 苯酚浓度标准曲线Fig.6 Standard curve of phenol concentration
2.5.2 苯酚降解曲线
每6个小时取样培养液,测定剩余的苯酚浓度。以培养时间为横坐标,剩余苯酚浓度为纵坐标,绘制苯酚降解曲线。如图7所示,结果表明:培养时间越长,苯酚浓度越低,降解率随之升高。培养到42h时,剩余苯酚浓度为104mg/L,苯酚降解率高达90.5%,说明菌株Y_1具有较强的降酚能力,达到高效降酚菌的标准。
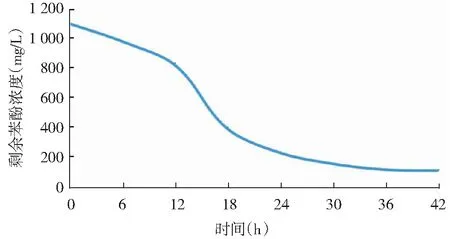
图7 苯酚降解曲线Fig.7 Phenol degradation curve
3 结 论
3.1 从绵阳某绝缘材料厂的活性污泥中分离得到4株苯酚降解菌。其中菌株Y_1的降酚能力最强,经分子生物学方法鉴定,初步确定该菌为苏云金芽孢杆菌(Bacillusthuringiensis)。
3.2 生理生化特性表明,当温度在15~40℃、pH值在4.4~10.0以及NaCl浓度在2%~10%时该菌均能良好生长。
3.3 降酚特性研究表明,当苯酚初始浓度为1 100 mg/L时,在36 h内,菌株Y_1对苯酚的降解率达到了90%,属于高效降酚菌。
本文分离筛选出一株能高效降解苯酚的菌株Y_1,能在以苯酚为唯一碳源的无机盐培养基中生长,其生长与降酚同步进行。该菌属主要在害虫防治中发挥作用,用于降解苯酚的苏云金芽孢杆菌鲜见报道。菌株Y_1降解苯酚的能力较强,且能很好地适应环境,是一株理想的苯酚降解出发菌株,具有重要的研究价值。
