鸡Toll样受体15单克隆抗体的制备及其初步应用
2022-03-08李梦妮傅思瑶杨梓纯许炎辉樊毛迪刘秀梵
李梦妮,王 航,傅思瑶,杨梓纯,许炎辉,樊毛迪,高 崧,刘秀梵
(扬州大学兽医学院,江苏省动物重要疫病与人兽共患病防控协同创新中心/农业农村部禽用生物制剂创制重点实验室,扬州 225009)
迄今为止,已发现的模式识别受体(pattern recognition receptors,PRRs)中,Toll样受体(toll-like receptors,TLRs)是研究热点之一。TLRs作为一种Ⅰ型跨膜糖蛋白模式识别受体,是动物天然免疫中的第一道屏障[1]。TLRs作为机体炎性反应链的启动蛋白可对病原相关分子模式(pathogen associated molecular patterns,PAMPs)进行识别,来参与天然免疫这一过程[2]。PRRs可由多种类型的细胞表达,如巨噬细胞、树突状细胞、中性粒细胞、上皮细胞、成纤维细胞[3]。TLRs可以在巨噬细胞中表达,TLRs通过与PAMPs或配体结合将巨噬细胞激活。PAMPs主要包括脂多糖、脂磷壁酸、聚肌苷酸、肽聚糖、鞭毛蛋白和单、双链RNA或DNA等[4-5]。TLRs可以激活相关信号分子,通过招募相关接头蛋白(TICAM-2、SARM、TICAM-1、MyD88和TIRAP/MAL)使得胞内转录和表达出各种炎性介质,随之相应非特异性和特异性免疫被激活,以至于能够将感染的病原体清除[6]。然而,TLRs与细菌感染之间紧密相连,对其进行深入研究可在细菌感染机制,疾病的预防、诊断与治疗方面具有重要意义。
目前,在禽类发现的10种TLRs:TLR1La/1Lb、TLR2a/2b、TLR3、TLR4、TLR5、TLR7、TLR15和TLR21[7]。ChTLR15由胞浆区、跨膜区和胞外区3部分组成。胞外区由14~32个亮氨酸重复排列组成N末端结构域,该亮氨酸残基形成的疏水界面有助于各蛋白之间的黏附,直接影响TLRs对PAMPs的识别[8]。胞内C端TIR结构域是与下游蛋白激酶作用的关键元件,它结合下游所递呈的分子,与接头蛋白相互识别,从而促使下游信号转导[9]。跨膜区域贯穿于前两者,富含半胱氨酸残基。目前,有研究者在钉螺中也发现了TLR15的存在[10],推翻了TLR15为禽类特有这一结论[11],其作用机制、生物学功能有待深入研究[12]。ChTLR15在天然免疫中发挥重要作用,其如何参与免疫应答、保护机体方面已有一定的研究基础[13]。因此,作者通过对鸡TLR15部分胞外区基因克隆,构建重组表达质粒,表达、纯化重组蛋白后免疫小鼠,制备针对ChTLR15的单克隆抗体,并定位其抗原表位,同时检测TLR15在HD11细胞和鸡部分组织中的分布情况,为ChTLR15蛋白生物学功能和禽类TLRs免疫调节机制相关的研究提供重要的物质基础。
1 材料与方法
1.1 主要材料
1.1.1 菌株、质粒、细胞 APEC O1血清型E516株、载体pET-30a、骨髓瘤细胞系SP2/0均由扬州大学农业农村部禽用生物制剂创制重点实验室保存。
1.1.2 实验动物 6~8周龄BALB/c雌鼠、ICR小鼠均购自扬州大学比较医学中心。
1.1.3 主要试剂 100×HT培养基、50×HAT培养基均购自Gibco公司;DMSO、弗氏完全佐剂、单克隆抗体亚类鉴定试剂盒、弗氏不完全佐剂均购自Sigma公司;凝胶过滤层析柱及填料购自GE Heathcare;HRP标记的羊抗鼠IgG、异硫氰酸荧光素(FITC)标记的山羊抗鼠IgG购自康为世纪生物科技有限公司。
1.2 方法
1.2.1 表达抗原序列的确定 利用Bepipred(http://tools.immuneepitope.org/bcell/)网站对鸡TLR15胞外区进行抗原表位的预测,以确定表达抗原的序列。
1.2.2 重组质粒pET-30a-ChTLR15(162—386 aa)的构建 从鸡HD11细胞中提取总RNA并反转录得到cDNA。利用诺唯赞ClonExpress Ultra One Step Cloning Kit说明书设计引物,F:5′-ACTTTAAGAAGGAGATATACATATGTTGG-AAGATCCACCCAATCCAGGA-3′;R:5′-TGGTGGTGGTGGTGGTGCTCGAGCTCTGGAAGGC-TTTCGATGGGTGTAC-3′。NdeI/XhoI酶切载体pET-30a,根据ClonExpress Ultra One Step Cloning Kit说明书将酶切后的载体直接与PCR扩增后的目的片段进行连接,构建重组质粒pET-30a-ChTLR15(162—386 aa)。
1.2.3 重组蛋白诱导表达与纯化 重组表达菌pET-30a-ChTLR15(162—386 aa)涂布在(Kan)LB琼脂平板上培养,挑单菌落接入(Kan)LB液体培养基中过夜培养,以1%的接种量转接至1 L(Kan)LB液体培养基中,待OD600 nm达到0.6~0.8时,加入IPTG至终浓度为1 mmol·L-1,37 ℃继续培养5 h后收集菌液。使用超声波裂解仪对诱导表达的菌液进行冰浴超声裂解,4 ℃,12 000 r·min-1离心30 min, 分别取其菌体以及离心后的上清与沉淀进行蛋白表达形式分析。若为包涵体表达,则采用尿素梯度透析复性法对其进行复性[14]。将复性后的蛋白使用Ni-NTA亲和层析初次纯化,收集初次纯化后的蛋白使用葡聚糖凝胶Superdex 200色谱柱进行凝胶过滤层析,进行再次纯化,最终获得较纯净的ChTLR15重组蛋白。通过SDS-PAGE电泳法检测蛋白纯度,再用BCA蛋白浓度测定试剂盒检测蛋白浓度后,分装,置-70 ℃冰箱保存。
1.2.4 免疫方案 对6~8周龄BALB/c雌鼠进行背部皮下免疫,剂量为每只100 μg。首次免疫将免疫原与弗氏完全佐剂等体积混合,并用生物组织匀质器充分乳化蛋白;后续两次免疫用弗氏不完全佐剂等体积混合免疫原蛋白;细胞融合前3 d加强免疫,不加佐剂,采用生理盐水混合免疫原腹腔注射同体积的蛋白溶液。
1.2.5 间接ELISA检测方法的建立 采用方阵滴定法,将纯化后的ChTLR15(162—386 aa)蛋白分别稀释至2.8、1.4、0.7、0.35、0.175 μg·mL-1的浓度包被酶标板,小鼠血清以1∶800、1∶1 600、1∶3 200、1∶6 400、 1∶12 800稀释,酶标二抗羊抗鼠IgG-HRP作1∶5 000 稀释。其他步骤按常规ELISA程序进行[15],以此确定最适抗原包被浓度和血清最适稀释度。
1.2.6 细胞融合及筛选 将脾细胞和SP2/0细胞按5∶1比例进行融合,间接ELISA及间接免疫荧光进行3~4次筛选后,选择只与重组蛋白反应而不与载体蛋白反应的阳性杂交瘤细胞。对效价高、生长状态好的阳性单克隆杂交瘤细胞进行扩增。
1.2.7 单抗特异性鉴定 以Western blot法检测4株单克隆抗体的特异性,将本实验室保存的空载体pET-30a、免疫原ChTLR15(162—386 aa)、鸡Toll样受体21(ChTLR21)、鸡磷脂酶A2-IB(ChPLA2-IB)蛋白作为待检抗原,PBST稀释的4株杂交瘤细胞培养上清作为一抗,进行Western blot反应确定单克隆抗体的特异性。
1.2.8 单抗亚类鉴定 按照Sigma公司单克隆抗体亚类鉴定试剂盒说明书操作,鉴定单抗亚类。
1.2.9 腹水效价的测定 采用体内诱生法制备腹水[16],以间接ELISA法及IFA法测定腹水抗体效价。
1.2.10 抗原表位的初步定位 从鸡HD11细胞中提取总RNA反转录后得到的cDNA为模板,根据ChTLR15全长基因,如图1所示,分别截取不同片段。PCR扩增片段分别命名为A(487—1 059 bp)、B(487—960 bp)、C(487—861 bp)、D(187—564 bp)、E(187—663 bp)、F(187—762 bp)、G(753—1 158 bp)。NdeI/XhoI酶切载体pET-30a,根据ClonExpress Ultra One Step CloningKit将酶切后的载体直接与PCR扩增后的目的片段进行连接。将鉴定正确的阳性质粒参照“1.2.3”进行诱导表达。以截短表达蛋白作为抗原,以单克隆抗体2G4、6C7、6D10、7C4作为一抗,根据抗原抗体在Western blot中的结合反应对ChTLR15抗原表位进行定位。
1.2.11 抗原表位的精确定位 以初步截短定位的结果为基础,如图2所示,将初步定位结果进行再次截短表达,最后进行Western blot分析,以确定4株单克隆抗体针对的精确抗原表位。

图1 抗原表位初步截短定位Fig.1 Preliminary identification of antigen epitopes recognized by mAbs
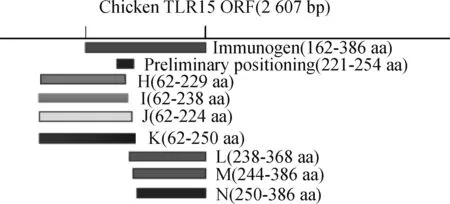
图2 抗原表位精确截短定位Fig.2 Precise identification of antigen epitopes recognized by mAbs
1.2.12 激光共聚焦显微镜观察鸡TLR15在HD11细胞中的定位 将HD11细胞均匀铺于细胞板中,37 ℃、5%CO2培养箱中培养72 h后,弃去培养液。PBS洗涤,4%多聚甲醛室温固定20 min,PBS洗涤后用0.5% Triton-X-100透膜打孔,37 ℃静置15 min,PBS洗涤。将6C7株阳性杂交瘤细胞上清按1∶32比例稀释后孵育细胞,此步骤需设置空白对照,置于37 ℃培养箱孵育1 h。PBS多次洗涤,而后避光加入工作浓度的Alexa Fluor 488 donkey anti-mouse IgG(H+L),37 ℃孵育1 h。用鬼笔环肽进行肌动蛋白(F-actin)染色,DAPI进行细胞核染色,PBS洗涤后拍干,封片后上机观察。
1.2.13 免疫组化检测ChTLR15在鸡部分组织中的分布情况 将SPF鸡的肝、脾、肺、肾进行预处理,而后用石蜡包埋法进行包埋。将包埋后的组织进行切片,厚度控制在5 μm左右。48 ℃烤片24 h,再经脱蜡、润湿、甲醇/双氧水灭活处理制备组织切片。以6C7单抗的细胞上清(1∶500)为一抗,同时设置PBS缓冲液为对照组。山羊抗鼠HRP-IgG(1∶200)为二抗,DAB显色液进行显色,接着用苏木素染料进行衬染,超纯水梯度进行脱水透明,吹干后用树胶封片,镜下观察分布情况。
2 结 果
2.1 表达抗原序列的分析
利用网站(http://tools.immuneepitope.org/bcell/)预测ChTLR15线性抗原表位,如图3所示,最终选择第162—386 aa作为目标免疫原。

图3 ChTLR15蛋白线性表位预测Fig.3 Linear epitope analysis of ChTLR15 protein
2.2 重组表达载体的构建
将双酶切后的载体pET-30a与PCR扩增的序列连接,转化DH5α,挑取单克隆进行培养,以载体通用引物进行菌液PCR鉴定,如图4所示,PCR产物经1%琼脂糖凝胶电泳出现1条清晰的条带,与预期大小一致。经测序验证,目的片段与NCBI中序列相符,重组质粒构建成功。

M. DL200 DNA 相对分子质量标准;1、2. pET-30a-ChTLR15(162—386 aa)片段M. DL200 DNA marker;1, 2. The fragment of pET-30a-ChTLR15(162-386 aa)图4 pET-30a-ChTLR15(162—386 aa)PCR鉴定结果Fig.4 Amplification of pET-30a ChTLR15(162-386 aa) fragment by PCR
2.3 重组蛋白的诱导表达
对诱导表达并超声裂解后的全菌以及离心后的上清和沉淀进行SDS-PAGE及Western blot分析。Western blot结果如图5A所示,重组蛋白ChTLR15以包涵体和可溶性2种形式表达。SDS-PAGE结果如图5B所示,包涵体中的蛋白杂条带较少且蛋白表达量较高,所以采用沉淀中的蛋白进行纯化。
2.4 重组蛋白的纯化
重组蛋白经Ni-NTA亲和层析初次纯化后条带较杂(图6A),凝胶过滤层析再次纯化后的重组蛋白峰形单一且蛋白纯度高(图6C),将所收集的样品进行SDS-PAGE电泳检测,重组蛋白只出现1条清晰的条带(图6B)。
2.5 间接ELISA方法的建立
方阵试验结果见表1,血清稀释度为1∶6 400,抗原浓度为0.35 μg·mL-1,此时阳性血清的OD450 nm值最接近于1.0。所以,将该梯度判定为最适抗原包被浓度与最佳血清稀释度。
2.6 小鼠的血清抗体效价
以方阵试验建立的结果为依据,采用ELISA法对三免后的小鼠进行效价测定,同时将未免疫的小鼠血清设置为阴性对照。如图7所示,1、2号鼠的效价均可达到1∶102 400以上,3号小鼠效价只有1∶25 600。未符合免疫要求的小鼠可继续进行第4次免疫,直至达到要求。

A. Western blot鉴定;B. SDS-PAGE检测;M. 蛋白质相对分子质量标准;1. ChTLR15(162—386 aa)裂解全菌;2. ChTLR15(162—386 aa)裂解上清;3. ChTLR15(162—386 aa)裂解沉淀;4. pET-30a诱导裂解全菌A. Western blot identification; B. SDS-PAGE analysis; M. Standard molecular weight; 1. Lysed whole bacteria of ChTLR15(162-386 aa); 2. Supernatant lysates of ChTLR15(162-386 aa); 3. Precipitation lysates of ChTLR15(162-386 aa); 4. pET-30a induced lysates of the whole bacteria图5 ChTLR15(162—386 aa)表达形式的Western blot和SDS-PAGE分析Fig.5 Western blot and SDS-PAGE analysis of the expression form of ChTLR15(162-386 aa)
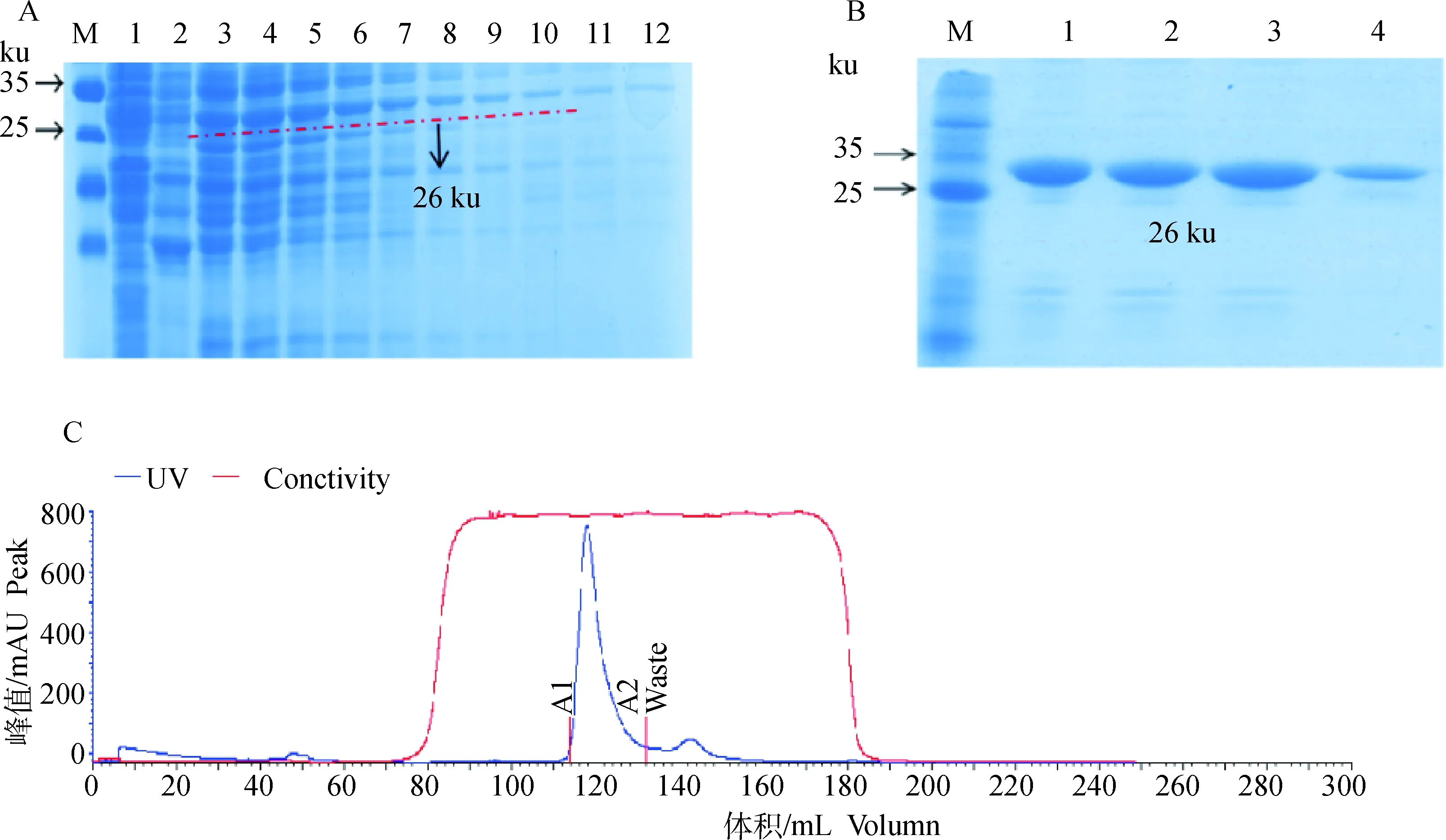
A.Ni-NTA亲和层析初次纯化后重组蛋白的SDS-PAGE分析;B.凝胶过滤层析再次纯化后重组蛋白的SDS-PAGE分析;C.凝胶过滤层析再次纯化后重组蛋白的色谱分析A. SDS-PAGE analysis of the recombinant protein after initial purification by Ni-NTA affinity chromatography; B. SDS-PAGE analysis of the recombinant protein further purified by gel filtration chromatography; C. Chromatographic analysis of the recombinant protein further purified by gel filtration chromatography图6 重组蛋白纯化鉴定Fig.6 Recombinant protein purification and identification
2.7 杂交瘤细胞的克隆化
采用ELISA及IFA法对杂交瘤细胞株进行筛选,3次亚克隆后,单抗反应性如表2所示,从中选出OD450 nm值高、荧光反应性强、状态良好且不与空载体反应的阳性细胞孔。共筛选出4株能分泌抗ChTLR15(162-386 aa)蛋白的单抗细胞株,分别命名为2G4、6C7、6D10、7C4。
2.8 单克隆抗体的荧光反应性
分别以2G4、6C7、6D10、7C4杂交瘤细胞培养上清液与HD11细胞进行间接免疫荧光试验。结果如图8所示,2G4、6C7、7C4与HD11细胞有荧光反应,而6D10与HD11细胞无荧光反应性。其中,2G4的荧光反应性较弱,6C7与7C4荧光反应性较强。
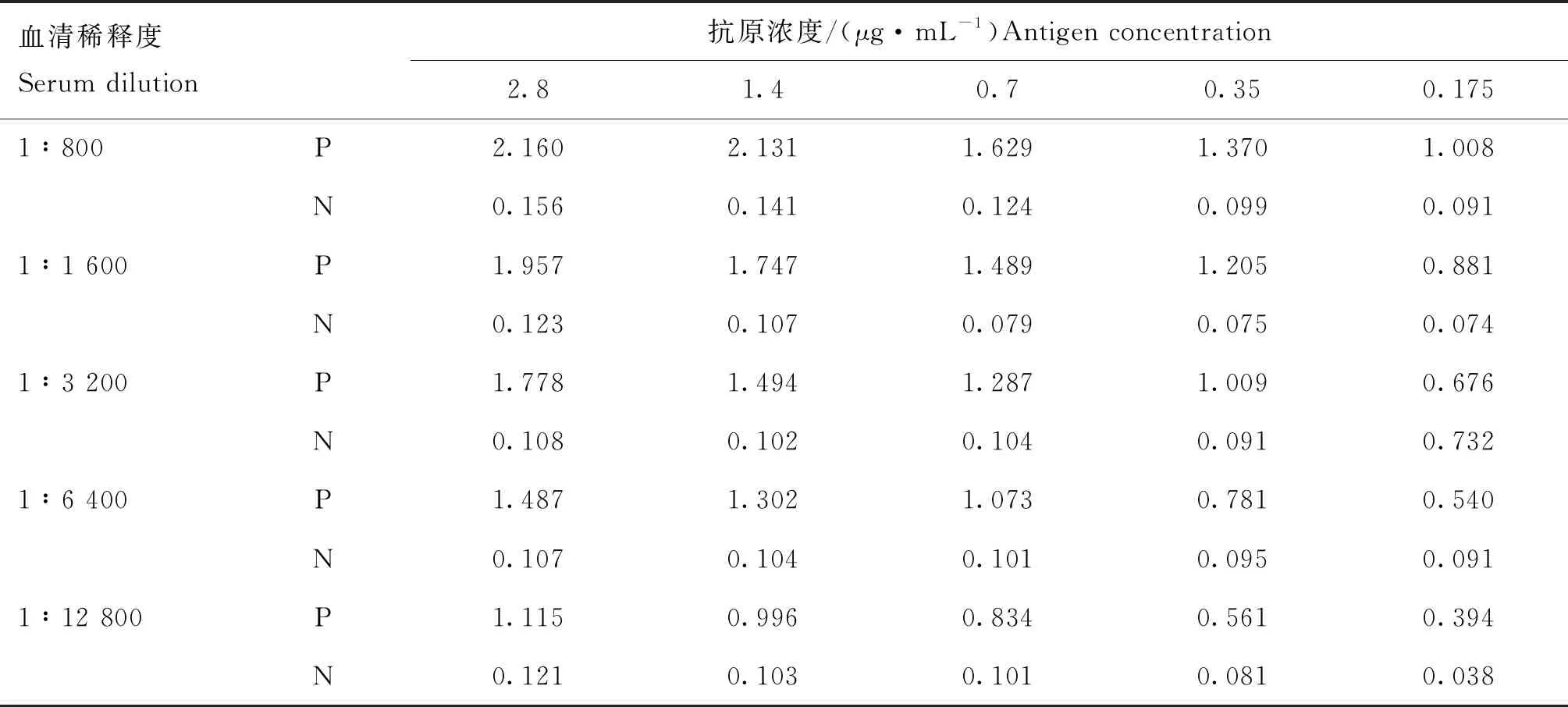
表1 方阵试验确定最适抗原包被浓度与血清稀释度

图7 抗体效价的测定Fig.7 Determination of serum antibody titer of immunized mice

表2 4株抗单抗的反应性

图8 杂交瘤细胞上清与HD11细胞的IFA反应性(40×)Fig.8 IFA identification of mAbs reacted with HD11 cells (40×)
2.9 单抗特异性鉴定
经Western blot鉴定,如图9所示,杂交瘤细胞上清只与免疫原ChTLR15(162—386 aa)反应,与其他受检蛋白不反应。
2.10 单抗亚类鉴定
根据单克隆抗体亚类分型试剂盒说明书对所获得的4株单抗细胞上清进行亚类鉴定,结果(表3)表明,2G4与6C7的亚类为IgG2a,6D10与7C4的亚类为IgG1。
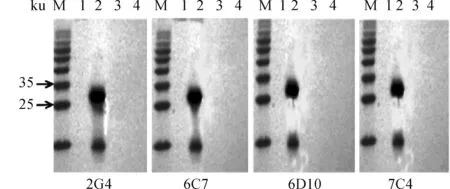
M.蛋白相对分子质量标准;1. pET-30a;2. ChTLR15(162—386 aa);3.TLR21;4.PLA2-IBM. Standard molecular weight of protein;1. pET-30a; 2. ChTLR15(162-386 aa); 3. TLR21; 4. PLA2-IB图9 单抗反应性鉴定Fig.9 Reactivity identification of mAbs by Western blot

表3 4株单抗的亚类
2.11 腹水的效价
将最终获得的4株稳定分泌针对ChTLR15蛋白的单克隆抗体,用间接ELISA法及IFA法检测腹水效价,结果如表4所示,6C7、6D10腹水ELISA效价分别为1∶20 480、1∶40 960;2G4、7C4无腹水ELISA效价。2G4、6C7、7C4腹水IFA效价分别为1∶80、1∶2 560、1∶5 120,6D10无腹水IFA效价。
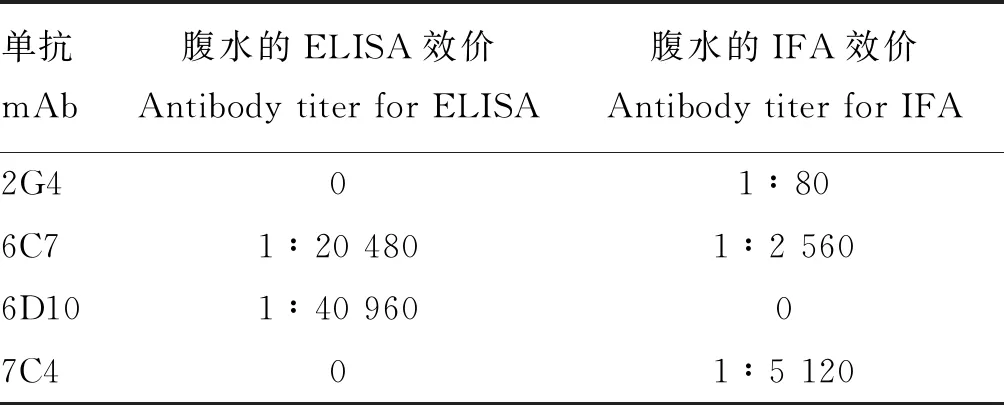
表4 杂交瘤细胞上清的抗体效价
2.12 抗原表位的鉴定
截短ChTLR15(162—386 aa)蛋白与4株单抗作Western blot分析,结果如图10所示,2G4与7C4识别的抗原表位为230QLGTVLEF237,6C7与6D10识别的抗原表位为245EMDLLS250。

图10 2G4、6C7、6D10、7C4识别的抗原表位Fig.10 Antigen epitopes recognized by MAbs 2G4, 6C7, 6D10, 7C4
2.13 激光共聚焦显微镜观察ChTLR15亚细胞定位
蓝色(DAPI)表示细胞核,红色(鬼笔环肽)表示细胞骨架肌动蛋白,绿色[Alexa Fluor 488 donkey anti-mouse IgG(H+L)]表示ChTLR15,NC表示阴性对照。激光共聚焦显微技术3D立体图(图11)显示,ChTLR15位于细胞表面。
2.14 鸡TLR15在SPF鸡部分组织中分布
取SPF鸡肝、脾、肺、肾,经免疫组织化学检测,结果显示(图12),PBS对照组无阳性信号,健康组有微弱的阳性染色,攻毒组有较明显的阳性染色,阳性染色细胞呈黄褐色。其中,肝染色最深,肾和肺染色次之,脾中少数阳性染色细胞呈浅黄色。

图11 激光共聚焦检测ChTLR15蛋白亚细胞定位(标尺=10 μm)Fig.11 The subcellular localization of ChTLR15 protein detected by laser confocal microscope (bar=10 μm)

A.肝;B.脾;C.肺;D.肾;1. PBS对照组;2. 健康组;3. APEC E516攻毒组A. Liver; B. Spleen; C. Lung; D. Kidney; 1. PBS control group; 2. Healthy group; 3. APEC E516 challenge group图12 ChTLR15的免疫组织化学检测(40×)Fig.12 Detection of ChTLR15 in tissues from both mock and APEC challenged birds by immunohistochemistry (40×)
3 讨 论
ChTLR15最先由Higgs鉴定出来,在鸡脾、法氏囊和骨髓中表达,且可能与宿主防御有关[11]。关于ChTLR15在家禽免疫相关细胞和组织中的表达情况以及其与家禽抵抗病原微生物感染能力的关系是最近研究的焦点。TLR15主要通过其胞外区识别病原微生物的PAMPS而发挥作用,故本研究选用了部分胞外区基因片段进行原核表达,成功构建了重组质粒pET-30a-ChTLR15(162—386 aa)。Western blot鉴定重组蛋白以可溶性、包涵体两种形式表达,但包涵体表达的蛋白杂条带少且表达量高,故选用包涵体制备目的蛋白。采用尿素梯度透析法进行变复性,并利用凝胶过滤层析法进行蛋白纯化,获得了纯度较高的重组蛋白,进行动物免疫、细胞融合与亚克隆。
单克隆抗体只针某一特定抗原表位,具备纯度高、特异性好的优点[17-19],抗原纯度、合适的免疫方案是影响单克隆抗体质量的重要因素[20]。迄今,除邢波建等[21]制备出ChTLR15多克隆抗体外,未见有ChTLR15单克隆抗体的报道。本研究为了获得ELISA反应性、荧光反应性的单抗,以IFA加ELISA“双指标”进行筛选,共筛选出4株能稳定分泌抗体的杂交瘤细胞株,分别命名为2G4、6C7、6D10、7C4。2G4、6C7、7C4与鸡巨噬细胞系HD11具有不同强度的荧光反应;6D10则不具备与该细胞系的荧光反应性,推测可能是原核表达系统缺少糖基化、磷酸化和高级修饰,使得翻译加工后的蛋白不能正常折叠[22],而上述鸡传代细胞系中天然TLR15蛋白具有类似其在鸡体内的构象表位,具体原因还需进一步分析[23],荧光的强弱和ELISA值的高低,可能与抗体的结合能力有关[24]。以上4种单抗不同的荧光和ELISA反应性再次证明,确有必要同步采取这两种方法进行筛选,才能得到具有不同反应性的单抗。
抗原表位又称抗原决定簇,为可与抗体或B/T细胞抗原受体特异性结合的化学基团,可以由蛋白质一级结构或三级结构组成,是机体产生免疫应答的物质基础[25]。为了确定制备的单抗所针对的抗原表位,对ChTLR15基因进行多次截短表达,最终确定单抗2G4与7C4识别的抗原表位为230QLGTVLEF237,6C7与6D10识别的抗原表位为245EMDLLS250。
de Zoete等[26]用标记的TLR15转染HeLa 57A和鸡DF-1细胞,共聚焦显微镜观察发现TLR15与细胞表面标记麦胚凝集素共定位,认为TLR15是一种定位于细胞表面的糖蛋白。本文以HD11细胞为材料,对细胞核、肌动蛋白进行染色,以具荧光反应性的单抗6C7为一抗,Alexa Fluor 488 donkey anti-mouse IgG(H+L)为二抗,通过激光共聚焦扫描形成3D立体图,直观地展现ChTLR15蛋白位于细胞表面,与de Zoete等[26]的研究结果一致。
孙钰等[27]使用鼠伤寒沙门菌诱导鸡盲肠和脾脏中TLRs的表达,利用荧光定量PCR技术检测表达情况,发现TLR2、4、5、15、21的mRNA表达量在盲肠和脾均显著上升。Abasht等[28]发现鸡感染沙门菌后,其脾中TLR2、TLR15 mRNA表达量增加。王燕等[29]以白痢沙门菌感染雏鸡,发现ChTLR15 mRNA表达量也呈增加趋势。综上所述,鸡ChTLR15在细菌感染后的表达量往往上调。本研究采用免疫组化技术检测TLR15在鸡部分脏器中的分布,TLR15在SPF鸡肝、脾、肺和肾中均有表达,但表达量较少;O1血清型APEC感染的SPF鸡中肝、脾、肺和肾的TLR15表达量均有增加,也印证了上述研究的结论。
4 结 论
成功制备出4株抗ChTLR15的单克隆抗体,并对其抗原表位进行了鉴定;确定了TLR15在部分脏器中的分布及其在HD11细胞中的定位,为其后续ChTLR15的生物学功能以及禽类TLRs相关的免疫调节机制研究提供了有力工具。
