亚热带红壤区森林土壤剖面微生物残体碳分布及影响因素
2022-03-07于颖超张心昱戴晓琴吕斯丹史丽娟
于颖超,张心昱,*,戴晓琴,吕斯丹,杨 洋,史丽娟
1 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室, 北京 100101 2 中国科学院大学资源与环境学院, 北京 100190
土壤是陆地生态系统中最大的有机碳库,其所含碳量大约是大气和植被所含碳量总和的2—3倍,在陆地生态系统碳循环中起到重要作用[1]。微生物通过分解代谢促进土壤有机碳(SOC)降解,同时也通过合成代谢将土壤中可利用性碳转化为可长期储存的稳定态碳,在碳库的调控中发挥着重要作用[2]。以往研究认为,土壤微生物活体有机碳在SOC总量中的比例低于4%,对陆地生态系统碳库贡献较小[3]。微生物死亡残体有机碳(MRC)在土壤中周转时间比微生物活体碳更长,对稳定性碳库的形成具有重要贡献[4],并可表征微生物对SOC的长期贡献[5-6]。
土壤剖面中20cm 以下的SOC储量占总SOC储量的50%左右[7],土壤微生物残体的标志物氨基糖主要来源于微生物细胞壁,其在微生物死亡后仍能够在土壤中长期稳定存在[8],因此MRC对深层土壤稳定SOC库的贡献不容忽视。底物SOC、TN、DOC含量、pH及含水量等在土壤剖面中存在差异,影响微生物群落结构、微生物活性和繁殖[9]。有研究表明,MRC含量受到底物SOC和活体微生物生物量的影响[10];另外,全球森林生态系统土壤微生物残体控制因素的研究表明,在0—20cm土壤中,微生物残体的含量主要受到pH和微生物生物量碳的调控[11]。
目前的研究主要集中在表层土壤,缺乏针对包含土壤剖面和母质层整体系统开展的研究,20cm以下土壤和母质中MRC对SOC的贡献及其影响机制还不清楚[12]。地球关键带指浅层岩石-土壤-大气-水-生物及人类活动相互作用、为生命系统提供支撑资源的异质的地球表层系统[13]。本研究基于地球关键带的理念,认知表层-深层土壤-母质中MRC的分布特征,这对理解土壤圈和陆地生态系统碳循环过程、碳库形成机制及碳库动态演变具有重要意义。
中国亚热带红壤区丘陵山地森林生态系统是全球代表性的红壤区域地球关键带生态系统类型。我国人工林面积占全球人工林总面积25%[14],其中亚热带人工林具有碳汇功能[15]。因此,本研究选取亚热带典型森林土壤剖面,通过氨基糖和磷脂脂肪酸(PLFA)微生物标志物方法分别表征MRC含量和活体微生物生物量,探究细菌MRC(MRCB)、真菌MRC(MRCF)从地表到母质的剖面分布特征及其影响机制。我们假设 (1)随着剖面深度增加,MRCB、MRCF及MRC含量减少;而MRC对SOC的贡献升高,这是由于随着土壤剖面深度增加,植物源碳逐渐减少导致微生物碳对SOC的相对贡献增加[16];(2)微生物残体来源于死亡后的微生物细胞壁,与活体微生物生物量有关[17]。由于底物通过调控微生物代谢影响微生物生物量,进而影响MRC的积累[10]。因此在整个土壤剖面中,MRC含量可能主要受底物的影响。本研究旨在促进亚热带森林土壤剖面及母质中微生物残体碳对土壤碳库贡献的理解,对于研究红壤土壤碳库储存具有重要意义。
1 材料与方法
1.1 研究地点
研究地点位于江西省千烟洲亚热带森林生态系统观测研究站(26°44′29″N,115°03′29″E)。处于亚热带季风气候区,年均气温17.9℃,年均降雨量为1475mm,土壤类型以红壤为主,成土母质多为红色砂岩和泥岩[18]。主要树种为1985年前后种植的湿地松(PinuselliottiiEngelem)、马尾松(Pinusmassoniana)和杉木(Cunninghamialanceolate)等[19]。
1.2 土壤样品与采集

图1 土壤剖面及采样土层示意图Fig.1 The photo of a soil profile and sampling soil layers
2019年6月,在江西省千烟洲亚热带森林生态系统观测研究站森林样地中,设置4个面积为20m*20m的针叶林样方,植被主要为马尾松林(表1)。在样方中间位置,挖掘土壤剖面至母质。在4个土壤剖面中分别取0—5cm、5—10cm、10—20cm、20—40cm、40—母质上5cm、母质上5cm和母质7个层次(图1)。具体剖面采样点信息见表1。
采集土壤样品并混合均匀,去除石砾、根系等杂物,过2mm筛,用自封袋密封。取部分土壤样品烘干、研磨,分析SOC和全氮(TN)含量。其余样品于4℃下冷藏保存,用于测定土壤含水量(SWC)、pH、溶解态有机碳(DOC)、微生物-PLFA含量及MRC含量。
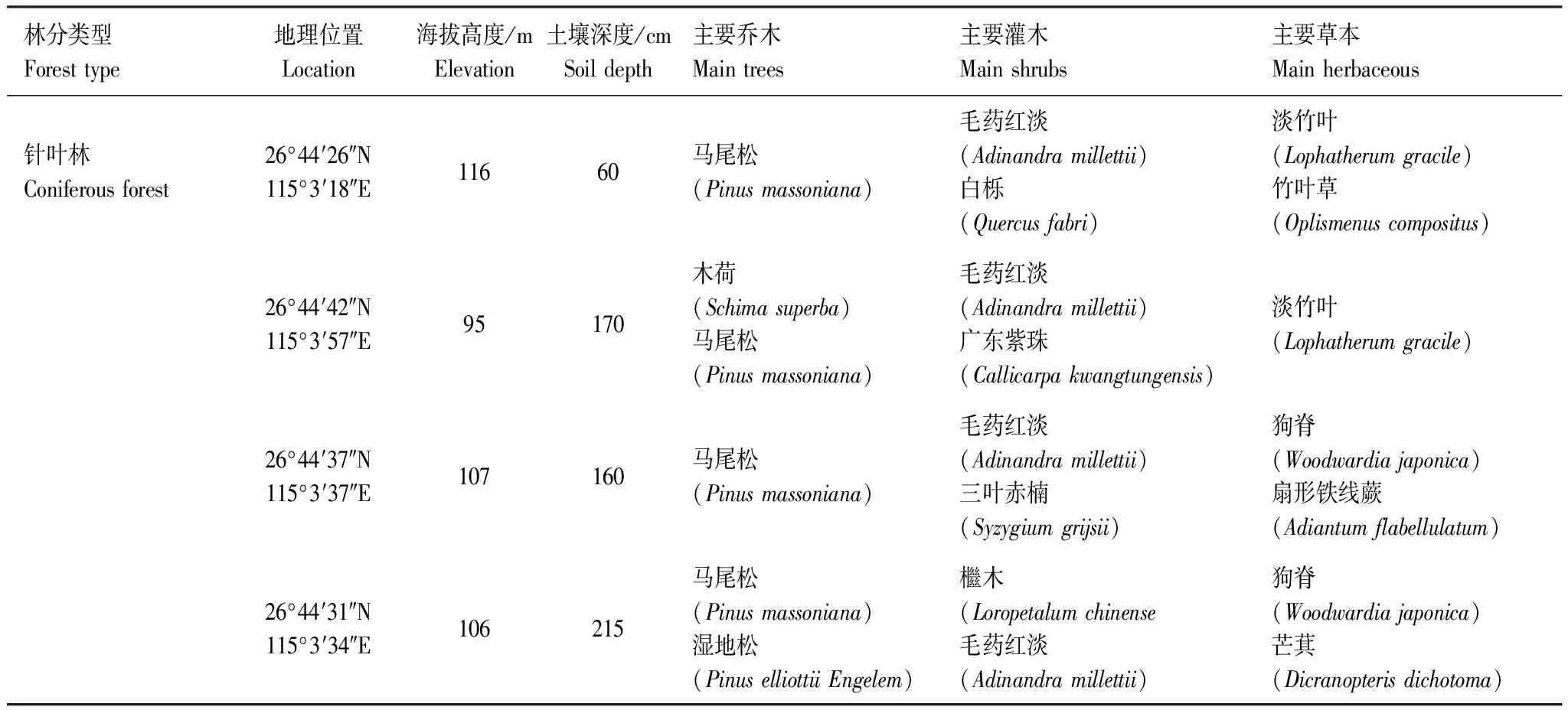
表1 土壤剖面基本概况
1.3 土壤样品分析
土壤容重(Db)用环刀法测定, SWC用烘干恒重法测定,pH(土水比1∶2.5)用pH计测定,DOC 通过0.05mol/L K2SO4(土液比1∶5)浸提,通过总有机碳分析仪(Liqui TOC II, Elementar, Germany)测定。SOC和TN通过元素分析仪(Elementar, Vario Max CN, Germany)测定[20]。土壤基本理化性质见表2。
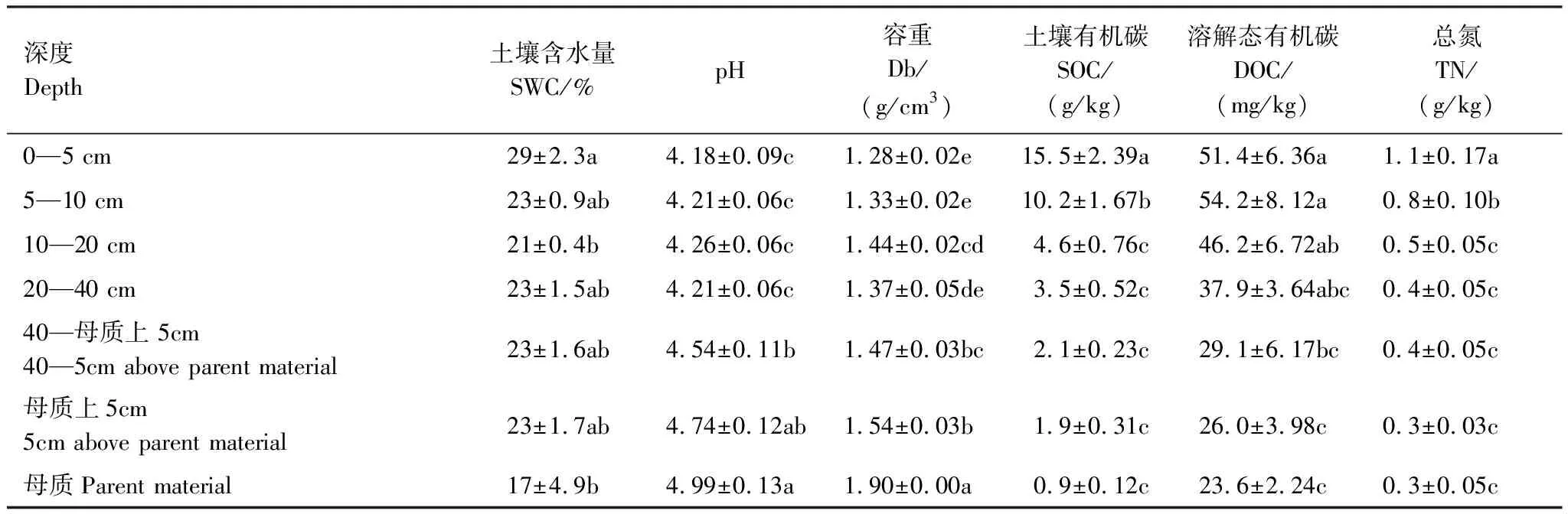
表2 土壤理化性质剖面分布
土壤中氨基葡萄糖(GluN)主要来源于真菌细胞壁,以几丁质成分存在。氨基胞壁酸(MurN)唯一来源于细菌细胞壁[21]。氨基糖的测定参考Indorf等[22]邻苯二醛(OPA)柱前衍生-高效液相色谱(HPLC)方法。即取1g新鲜过筛土于水解管中,加入10mL 6 mol/L盐酸,在烘箱中105℃下放置6 h进行水解,并使用 OPA衍生,使用配备十八烷基硅化硅胶凝胶柱(ODS)(Acclaim120 C18;4.6×150mm,3μm)的高效液相色谱仪分离(Dionex Ultimate3000,Thermo Fish Scientific,USA),使用发射波长为445nm和激发波长为330nm的荧光检测器检测,采用混合氨基糖的标准溶液色谱图对氨基糖进行鉴定和定量。
磷脂脂肪酸(PLFA)是微生物活体细胞膜的成分,其在微生物死亡后迅速分解,不存在于死亡微生物中,可以作为活体微生物生物量的指标[23]。主要参考Frostegard等[24]和Bossio等[25]方法,主要步骤为称取相当于8g干土的鲜土样品,用磷酸钾、氯仿和甲醇缓冲液提取,在硅胶柱上分离磷脂。样品经温和碱性甲醇分解形成脂肪酸甲酯(FAMEs)后,在己烷中溶解,加入脂肪酸19∶0作为内标,通过气相色谱仪(Agilent 7890 B)测定,用MIDI Sherlock微生物鉴定系统(Version 4.5; MIDI Inc., Newark, DE)对PLFA进行鉴定。表征微生物的PLFA标志物见表3。

表3 表征不同种群微生物的磷脂脂肪酸标志物
2 计算与统计分析
2.1 土壤中微生物残体碳的计算
土壤MRCF含量(g/kg)的计算公式为:
MRCF=(GluN-2 × MurN)×179.2 × 9
式中,GluN的分子质量为179.2,GluN、MurN 单位为mmol/g,假设细菌细胞中MurN与GluN以1∶2比例出现,从GluN中减去细菌GluN得到真菌GluN,通过数值 9将真菌GluN变换为MRCF[21]。
土壤中MRCB含量(g/kg)计算公式为:
MRCB=MurN × 251.2 × 45
式中,MurN 单位为mmol/g,MurN的分子质量为251.2,通过MurN含量乘以转换系数45得到 MRCB含量[30]。MRC含量(g/kg)为MRCF与 MRCB含量(g/kg)加和[32]。
2.2 统计分析
使用SPSS 20.0进行统计分析。通过One-sample Kolmogorov-Smirnov检验数据正态分布,对于不符合正态分布的细菌、真菌-PLFA含量进行对数转换。采用单因素方差分析(One-Way ANOVA)比较不同剖面深度的MRCB、MRCF、MRC及微生物-PLFA含量的差异,采用 Duncan法进行多重比较(P<0.05为差异显著)。结构方程模型(SEM)在软件AMOS 22.0中完成,利用SEM分析土壤环境因子、土壤养分及微生物-PLFA 含量对MRC的影响路径及程度,采用极大似然估计法对模型进行拟合。本研究中,χ2/df<2 、P>0.05、RMSEA<0.10、GFI>0.90时,模型拟合良好。利用Sigma Plot 10.0 软件进行作图。数据为平均值±标准误(n=4)。
3 结果与分析
3.1 微生物残体碳含量的剖面分布
从土壤表层至母质,MRCB、MRCF、MRC含量随着土壤剖面深度的增加显著降低(P<0.05),在母质处含量最低,变化范围分别为0.08—1.15、0.18—4.79 、0.25—6.01 g/kg。MRCB、MRCF、MRC含量为0—5cm>5—10cm>10—20cm>20—40cm≈40cm—母质。在0—5cm土壤中,MRCF/MRCB比值(3.92)显著高于其它土层(1.25—2.60)(P<0.05)(图2)。

图2 微生物残体碳含量的剖面分布Fig.2 Distributions of microbial residue carbon contents in the soil profiles不同的字母代表显著性差异(P<0.05)
3.2 真菌、细菌微生物生物量的剖面分布
从土壤表层至母质,细菌、真菌、放线菌及微生物-PLFA含量随土壤剖面深度的增加而显著降低(P<0.05),变化范围为 0.12—3.92 、0.02—0.93、0.00—0.74、0.13—5.59 mg/kg。在整个土壤剖面中真菌及微生物-PLFA含量表现为0—5cm>5—10cm>10—20cm≈20cm—母质。在母质处土壤微生物-PLFA含量最低,细菌、真菌及微生物-PLFA含量分别为0.12、0.02、0.13mg/kg(图3)。

图3 不同种群微生物-PLFA含量的剖面分布Fig.3 Distributions of microbial-PLFA content from different microbial communities in the soil profiles PLFA: 磷脂脂肪酸Phospholipid fatty acids
3.3 微生物残体碳对土壤有机碳贡献的剖面分布
随着土壤剖面深度增加,MRCF对SOC贡献先降低后升高;在0—5cm土壤中,MRCF对SOC贡献最高,为36%;在20—40cm土壤中,MRCF对SOC贡献最低,为12%。在整个土壤剖面中MRCB、MRC对SOC贡献分别为6%—12%,18%—46%,但变化不显著 (P>0.05)(图4)。

图4 微生物残体碳对土壤有机碳贡献的剖面分布Fig.4 Contribution of microbial residue carbon to soil organic carbon contents in the soil profiles SOC: 土壤有机碳Soil organic carbon;MRC: 土壤微生物残体碳Microbial residue carbon
3.4 土壤微生物残体碳含量的影响因素
SEM拟合结果表明,在整个土壤剖面中, Db、DOC和微生物-PLFA含量解释了土壤MRC 含量81% 的变异。Db 间接影响MRC含量,一方面通过影响DOC,路径系数为-0.53,影响微生物-PLFA含量的形成,最终影响MRC含量;另一方面通过直接影响微生物-PLFA含量,路径系数为-0.39,进而影响MRC含量。DOC 通过影响微生物-PLFA含量间接影响MRC含量,间接影响效应为0.37。微生物-PLFA含量直接影响MRC含量,路径系数为0.90(图5)。
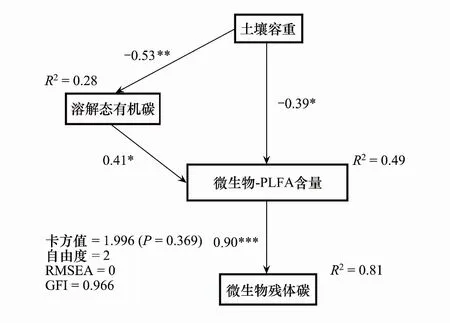
图5 微生物残体碳影响因素的结构方程模型(SEM)分析 Fig.5 Structural equation model analyses of the factors affecting microbial residue carbon contents 图中单向箭头表示路径,箭头上的数字表示标准化的路径系数;***表示P<0.001, **表示P<0.01,*表示P<0.05;R2值表示其他变量所解释的因变量的比例
4 讨论
与第一个假设一致,MRCB、MRCF、MRC及SOC含量随着土壤剖面深度增加而降低,与此前研究结果一致[11, 33]。微生物残体主要来源于死亡后的微生物细胞壁[34],与微生物生物量呈正相关性[17]。本研究SEM表明DOC含量通过影响微生物生物量进而影响MRC含量,这与第二个假设一致。DOC是微生物生长的速效底物,为微生物提供能量,进而影响微生物生物量[35]。随着土壤剖面深度增加,矿物表面的吸附作用导致DOC含量降低[36],微生物获得的能量减少,微生物-PLFA含量降低。因此随着土壤剖面加深,DOC含量通过调控微生物代谢降低微生物生物量,进而减弱MRC积累。另外由于植物凋落物和细根碳的影响,使得0—20cm土壤中存在大量植物碳[37—38]。这部分植物碳能够为土壤微生物提供能源,经微生物分泌的胞外酶作用后形成溶解糖、有机酸和氨基酸输入土壤,可被微生物快速吸收利用,通过微生物的生物合成作用构建自身生物量[39—40],在微生物死亡后形成长期稳定存在的微生物残体,有利于0—20cm土壤中MRC的积累。
另外在土壤剖面中,Db对微生物-PLFA含量具有显著负效应,表明微生物生物量还受到土壤环境的影响。随着剖面深度增加,土壤Db增大,土壤中通气透水性降低[41],这减少了剖面中气体流动和氧气含量[42],限制了土壤中DOC 向下部迁移,20cm以下土壤中低含氧量和较低的速效底物限制微生物合成代谢,抑制活体微生物生物量产生[11, 43],导致微生物-PLFA含量降低,不利于微生物残体的积累,因此MRC含量随着土壤剖面深度增加而降低。此外也有研究表明,微生物生物量受到土壤矿物的影响,土壤有机质与矿物质的结合降低了有机质被微生物接触利用的机会[4]。因此在20cm以下土壤剖面中,由于矿物质的保护阻碍了微生物获取养分,最终导致微生物生物量形成和微生物残体积累受到抑制。
MRCB、MRC对SOC贡献沿着土壤剖面深度增加没有显著变化,但MRCF对SOC的贡献先降低后升高,这与第一个假设不一致。此前有研究表明,MRC对SOC贡献沿着剖面深度增加而升高[44]。本研究土壤剖面中 MRC含量与SOC含量变化趋势一致,所以MRC对SOC贡献沿着土壤剖面没有显著变化。对于MRCF而言,由于在0—20cm土壤剖面中,难分解的植物碳输入随着剖面深度增加逐渐减少,而真菌主要分解难降解有机质[45],故真菌-PLFA含量显著降低,真菌微生物残体来源于真菌细胞壁,这导致MRCF对SOC贡献降低。而在20cm以下的土壤中,由于SOC的稳定受到土壤团聚体的影响[4],而真菌细胞外的菌丝和多糖直接参与土壤团聚体的形成[46],因此可能由于团聚体闭蓄作用的影响,MRCF对土壤稳定性有机碳的贡献升高。
在整个土壤剖面中,MRCF对SOC的贡献高于MRCB。已有研究表明,相比于细菌,真菌能够利用更顽固的组分作为能量来源[47]。本研究地点主要树种为马尾松,马尾松松针角质层发达,多为厚革质,马尾松凋落物的输入使得0—20cm表层土壤中含有较多木质素、纤维素等难分解物质,不容易被分解[48]。因此在0—20cm土壤中,真菌的竞争优势使得MRCF对SOC贡献更高。在20cm以下土壤中,一方面因为细菌细胞壁成分主要为肽聚糖,而真菌细胞壁含有难分解的几丁质成分;MRCB更容易分解,而MRCF分解的更慢,这有利于MRCF在土壤中残存和蓄积[49]。另外,由于真菌细胞外的菌丝和多糖参与土壤团聚体的形成,MRCF更容易受到物理保护[46],因此 MRCF对SOC贡献更高。
5 结论
本研究表明,MRCB、MRCF及MRC含量随土壤剖面深度增加而降低, MRCF对SOC的贡献随剖面深度增加先降低后增加,范围为12%—36%。而MRCB、MRC对SOC的贡献随剖面深度增加没有显著变化,分别为6%—12%、18%—46%。MRC对SOC的贡献沿着剖面变化并不显著,主要因为土壤剖面中 MRC含量与SOC含量变化趋势一致。在整个土壤剖面中,微生物-PLFA含量和DOC含量对MRC含量具有显著正效应,而 Db则是显著负效应。本研究结果表明,微生物残体碳在20cm以下的亚热带土壤碳汇中发挥重要作用。
