黄芪多糖对大鼠缺氧/复氧诱导的心肌细胞自噬及凋亡抑制作用的机制探讨
2022-03-07王忠庆蔡帆诸波陈功魏刚
王忠庆,蔡帆,诸波,陈功,魏刚
心肌缺血再灌注损伤(MIRI)是心肌组织缺血后恢复血液灌注造成的不可逆损伤,往往会造成心功能降低,心肌梗死面积扩大,最终导致心力衰竭[1-2]。MIRI 的发生机制与氧自由基产生、钙超载、炎症反应异常、细胞凋亡及自噬有关[3]。自噬作为内源性调节机制参与MIRI,当MIRI 发生后,心肌细胞自噬水平便会增加[4]。黄芪多糖(APS)是豆科植物荚膜黄芪或蒙古黄芪干燥根的主要活性成分之一,由葡萄糖、已糖醛酸、果糖、半乳糖、阿拉伯糖等混合而成[5]。APS 具有抗肿瘤、抗病毒、抗氧化应激、抗凋亡等作用,可作为免疫促进剂或调节剂[6-7]。甘草酸苷是高迁移率族蛋白1(HMGB1)的抑制剂,其直接结合HMGB1 并抑制其细胞因子活性。研究显示APS 通过抑制心肌细胞的凋亡和自噬水平,减轻心肌细胞H/R 造成的损伤和缓解链脲佐菌素诱导大鼠的MIRI[8-11]。另外有研究表明高迁移率族蛋白1/Toll样受体4/核转录因子-κB(HMGB1/TLR4/NF-κB)信号通路通过激活炎症反应及细胞凋亡引发MIRI[12]。但目前关于APS 是否通过调控自噬抵抗细胞缺氧/复氧(H/R)以及是否能通过下调HMGB1/TLR4/NF-κB信号通路来抑制MIRI 鲜有报道。本研究对原代培养的心肌细胞进行H/R 处理,模拟MIRI 模型,观察APS 通过调控HMGB1/TLR4/NF-κB 信号通路对心肌细胞H/R 过程中自噬及凋亡的影响。
1 材料与方法
1.1 材料
H9C2 细胞(美国菌种保藏中心);APS(粉末,纯度90%)(中国上海源叶生物科技公司);胎牛血清(杭州四季青生物工程材料有限公司);胰蛋白酶(美国GIBCO 公司);DMEM 培养基(美国Sigma 公司);BCA 蛋白定量试剂盒(南京凯基生物技术有限公司);兔抗HMGB1、TLR4、NF-κB p65、B 细胞淋巴瘤-2(Bcl-2)、含半胱氨酸的天冬氨酸蛋白水解酶-3(caspase-3)、Bcl-2 相关X 蛋白(Bax)、P62、微管相关蛋白 1A/1B-轻链 3(MAP1LC3,缩写为 LC3)-Ⅱ单克隆抗体(美国Abcam 公司);膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)双染色法凋亡检测试剂盒(大连宝生物工程有限公司);酶联免疫吸附试验(ELISA)试剂盒(武汉博士德生物有限公司);Trizol 试剂盒(日本TaKaRa 公司);SYBRTMGreen 实时荧光定量 PCR 预混液(日本Toyobo 公司);HMGB1、TLR4、NF-κB p65 逆转录试剂盒(美国Thermo Scientifc 公司);二氧化碳培养箱、Multiskan FC 酶标仪(美国Thermo 公司);超净工作台(苏州安泰空气技术有限公司);低温高速离心机(德国Eppendorf 公司);透射电镜(日本JEOL 公司);CFX96型荧光定量PCR 仪(美国Bio-RAD 公司);DanoDrop 1000 超微量蛋白核酸分析仪(美国Thermo 公司)。
1.2 方法
1.2.1 H/R 细胞模型制作及分组
H/R 细胞模型制作[13]:将对数生长期的H9C2细胞接种于24 孔板,待细胞融合达到85%时,更换培养基为单纯无糖培养基。通入95% N2和5%CO2的混合气体,37℃培养4 h,再更换培养基为含10%胎牛血清的DMEM 培养基,通入95%空气和5%CO2的混合气体,37℃培养12 h。
细胞分组:将心肌细胞随机分为4组:对照组(正常培养的细胞);缺氧复氧模型组(H/R组);黄芪多糖组(APS组),H/R组细胞造模前30 min加入APS(终浓度为1 mg/L[8]);HMGB1 信号通路抑制剂组(HMGB1抑制剂组),H/R 细胞造模前30 min 加入HMGB1 抑制剂Glycyrrhizin(终浓度为100 μg/ml[12])。
1.2.2 CCK8 法及EdU 染色法检测细胞增殖能力
将上述分组的细胞,分别于12 h、24 h、48 h、72 h 取出细胞,每孔加入10 μl CCK8 溶液,每孔设3 个复孔,在37℃培养箱内孵育2 h,使用酶标仪于450 nm 处检测吸光度。调整细胞密度为3×105个/孔并接种于24 孔板上,培养24 h 后,按照EdU 染色试剂盒说明进行染色、固定、封片,用LAS AF Lite 图像处理软件进行统计分析。
1.2.3 ELISA 法检测炎症因子含量
造模结束后收集24 孔板内的培养液,按照ELISA 检测试剂盒说明进行检测,使用酶标仪于450 nm 处检测吸光度,绘制标准曲线,代入曲线算得肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6 含量。
1.2.4 透射电镜观察细胞自噬小体的形成
造模结束后收集细胞,胰蛋白酶消化,以1×106个/孔的密度接种在6 孔板培养,每孔设3个复孔,培养48 h 后收集细胞,用2.5%戊二醛于4℃固定过夜,然后进行电镜的固定、脱水、包埋,制成50~70 nm 的超薄切片,于透射电镜(25 000×)下观察各组细胞自噬小体的形成情况。
1.2.5 AnnexinV-FITC/PI 双染法检测细胞凋亡
细胞造模24 h 后,取5×105个细胞离心,磷酸盐缓冲液(PBS)洗涤细胞,加入500 μl Binding Buffer 悬浮细胞。再各加入10 μl AnnexinV-FITC 和PI,避光孵育30 min,最后用流式细胞仪检测细胞凋亡。以NovoExpressTM软件进行分析。
1.2.6 实时定量PCR(qRT-PCR)检测细胞HMGB1、TLR4、NF-κB p65 mRNA 表达水平
造模结束后,收集各组H9C2 细胞,采用Trizol法提取总RNA。将RNA 反转录合成cDNA,扩增体系为SYBR Green Mix 10 μl,ddH2O 8 μl,上/下游引物各0.5 μl,cDNA 模板1 μl,共20 μl。扩增条件:95℃预变性5 min,95℃ 30 s,60℃ 10 s,72℃ 25 s,共40 个循环。使用2-ΔΔCT公式计算各mRNA 的相对表达水平。
引物序列如下:HMGB1 上游引物,5’-ATCCATTGGTGATGTTGC-3’,下游引物,5’-TCTTTTCATAGGGCTGCT-3’。TLR4 上游引物,5’-ATCCCTTATTCAACCA-3’,下游引物5’-TGTCTCCACAGCCACC-3’。NF-κB p65 上游引物,5’-TGTTTCCCCTCATCTTTCC-3’,下游引物5’-GTGGTATCTGTGCTTCTCTCC-3’。甘油醛-3-磷酸脱氢酶(GAPDH)上游引物,5’-GAAGGTGAAGGTCGGAGT-3’,下游引物,5’-GAAGATGGTGATGGGATTTC。miR-1-3p 上游引物,5’-ACACTCCAGGTGGGTGGAATGT-3’,下游引物,5’-CTCAACTGGTGTCGTGGAG-3’。
1.2.7 Western blot 检测细胞HMGB1、TLR4、NFκB p65、Bcl-2、Bax、caspase-3、P62、LC3-Ⅱ蛋白表达水平
细胞裂解法提取各组细胞总蛋白,用BCA 蛋白检测试剂盒进行蛋白浓度测定及定量。沸水变性蛋白进行SDS-PAGE 电泳,采用湿转法将蛋白转移至PVDF 膜上,用5%脱脂牛奶封闭2 h,加入一抗(HMGB1、TLR4、NF-κB p65、Bcl-2、caspase-3、Bax、P62、LC3-Ⅱ、GAPDH,稀释比例为1:2 000)4℃过夜孵育,TBST 漂洗,加入辣根过氧化物酶(HRP)标记的二抗(1:10 000)室温孵育2 h,DAB 显色。全自动化学发光仪中曝光,进行灰度分析,以GAPDH为内参校正。
1.3 统计学方法
数据统计采用SPSS 16.0 统计学软件,作图工具采用Graphpad 5.0。计量资料采用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 APS 对H/R 损伤细胞增殖能力的影响
CCK 8 结果(图1)显示,与对照组相比,H/R组细胞存活能力显著降低(P<0.05);与H/R组相比,APS组、HMGB1 抑制剂组细胞存活能力明显升高(P<0.05)。EdU 染色结果(图2)显示,与对照组相比,H/R组EdU 阳性细胞比例明显减少(P<0.05);与H/R组相比,APS组、HMGB1 抑制剂组EdU 阳性细胞比例明显升高(P<0.05)。

图1 CCK8 法检测细胞存活能力

图2 EdU 染色检测细胞增殖能力(×400)
2.2 APS 对H/R 损伤细胞TNF-α、IL-1β、IL-6含量的影响(图3)

图3 ELISA 法检测细胞TNF-α、IL-1β、IL-6 含量
与对照组相比,H/R组细胞TNF-α、IL-1β、IL-6 含量均明显升高(P均<0.05);与H/R组相比,APS组、HMGB1 抑制剂组细胞TNF-α、IL-1β、IL-6 含量均明显降低(P均<0.05)。
2.3 APS 对H/R 损伤细胞自噬小体形成的影响
透射电镜结果(图4)显示,对照组细胞内可见线粒体、内质网结构,几乎未见自噬小体。与对照组相比,H/R组细胞内见双层膜的自噬小体及自噬泡。与H/R组比较,APS组、HMGB1 抑制剂组细胞内可见少量自噬小体及其吞噬物。

图4 透射电镜观察细胞内自噬小体(箭头所示)(×25 000)
2.4 APS 对H/R 损伤细胞凋亡的影响(图5)
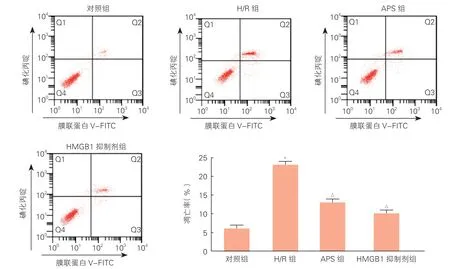
图5 流式细胞仪检测细胞凋亡情况
流式细胞仪结果显示,与对照组相比,H/R组细胞凋亡率显著升高(P<0.05);与H/R组相比,APS组、HMGB1 抑制剂组细胞凋亡率均明显降低(P均<0.05)。
2.5 APS 对H/R 损伤细胞HMGB1、TLR4、NF-κB p65 mRNA 表达的影响(图6)

图6 APS 对H/R 损伤细胞HMGB1、TLR4、NF-κB p65 mRNA 表达水平的影响
qRT-PCR 结果显示,与对照组相比,H/R组细胞HMGB1、TLR4、NF-κB p65 mRNA 表达水平均明显升高(P均<0.05);与H/R组相比,APS组、HMGB1 抑制剂组细胞HMGB1、TLR4、NF-κB p65 mRNA 表达水平均明显降低(P均<0.05)。
2.6 APS 对H/R 损伤细胞HMGB1、TLR4NF-κB p65、LC3-Ⅱ蛋 白、P62、Bcl-2、Bax、caspase-3、表达水平的影响(图7)

图7 蛋白免疫印迹法检测细胞HMGB1、TLR4、NF-κB p65、LC3-Ⅱ、P62、Bcl-2、Bax、caspase-3 蛋白表达水平
与对照组相比,H/R组细胞Bcl-2、P62 蛋白表达水平均明显降低,HMGB1、TLR4、NF-κB p65、Bax、caspase-3、LC3-Ⅱ蛋白表达水平均明显升高(P均<0.05);与H/R组相比,APS组、HMGB1 抑制剂组细胞HMGB1、TLR4、NF-κB p65、Bax、caspase-3、LC3-Ⅱ蛋白表达水平均明显降低,Bcl-2、P62 蛋白表达水平均明显升高(P均<0.05)。
3 讨论
MIRI 是临床缺血性心脏病防治的一大难题,其中涉及的机制较多,炎症反应、氧化应激、细胞凋亡及自噬都参与其中。体内炎症反应的激活使得心肌细胞进一步损伤,加剧细胞凋亡和心肌梗死面积[14]。APS 具有抗炎、抗氧化、抗肿瘤等作用,不仅能够增强T 细胞、B 细胞的免疫功能,还能增强化疗敏感性和杀灭肿瘤细胞[15-16]。近年来研究发现APS 通过抑制促分裂原活化蛋白激酶激酶激酶激酶3(MAP4K3)的表达和哺乳动物雷帕霉素靶蛋白(mTOR)信号通路,抑制细胞凋亡,改善心肌细胞功能[17]。本研究中H/R 损伤细胞增殖能力减弱,凋亡及自噬活性升高,经过APS 或者HMGB1 抑制剂提前处理后,细胞增殖、凋亡及自噬都有一定程度的恢复,表明APS 与HMGB1 抑制剂对H/R 损伤细胞具有相似的修复作用,能够抑制细胞凋亡及自噬活性。
HMGB1 能够结合DNA,缺血坏死的心肌细胞会释放HMGB1,从而触发炎症反应,是MIRI 炎症反应的早期介质[18]。MIRI 发生后,TLR4 受体被激活,进而引起下游NF-κB 蛋白的活化,然后NF-κB 进入细胞核,激活TNF-α、IL-1β、IL-6等炎症因子的转录活性,加重机体炎症反应[19]。蔡智慧等[20]发现栀子苷通过TLR4/NF-κB 信号通路抑制H/R 损伤心肌细胞炎症因子TNF-α、IL-1β、IL-6 的释放。俞超楠等[12]发现表儿茶素通过抑制HMGB1 信号通路修复心肌细胞H/R 损伤。张业昊等[21]研究发现黄芩苷通过抑制TLR4/NF-κB 信号通路及IL-1β、IL-1α、IL-6 的表达修复H/R 损伤人脑微血管内皮细胞。本研究中H/R 损伤心肌细胞HMGB1、TLR4、NF-κB p65 mRNA 和蛋白表达水平、炎症因子TNF-α、IL-1、IL-6 释放水平均明显高于对照组正常细胞,而APS 和HMGB1 抑制剂可抑制H/R 损伤心肌细胞HMGB1/TLR4/NF-κB 信号通路和炎症因子的表达。这表明APS 和HMGB1 抑制剂对H/R 损伤心肌细胞的修复作用相似,其机制可能与抑制HMGB1/TLR4/NF-κB 信号通路有关。
细胞自噬是生物体内高度保守的代谢途径,可选择性的降解胞内有害成分,在调控炎症反应及免疫方面具有重要作用[22]。自噬过程需要多个自噬调节蛋白参与。LC3 是自噬体膜蛋白,参与自噬形成的各个阶段,可作为检测自噬活动的标志物,没有自噬发生时,以LC3-Ⅰ形式存在,当发生自噬后,LC3-Ⅰ经泛素化修饰形成LC3-Ⅱ,从而启动自噬[23]。P62 作为自噬受体,被运送自噬体内降解,当自噬被诱导时,P62 蛋白水平下降,自噬抑制后,P62 蛋白则开始积累[24]。因此可采用LC3-Ⅱ、P62 蛋白水平及透射电镜观察自噬小体反映自噬活性。王雪林等[25]发现APS 能够降低LC3 的表达,增加P62 的表达,从而抑制黄嘌呤氧化酶诱导的肺癌A549 细胞自噬。王飘等[26]发现三七总苷通过增加P62 的表达,降低LC3-Ⅱ、Beclin-1 的表达有效改善MIRI。本研究中H/R 损伤心肌细胞较对照组P62 表达水平明显下降,LC3-Ⅱ水平明显升高,透射电镜观察胞内可见大量自噬体或自噬泡形成。而APS 和HMGB1 抑制剂可抑制H/R 损伤心肌细胞LC3-Ⅱ水平,提高P62 表达水平,透射电镜可观察胞内少量自噬小体。这表明APS 和HMGB1 抑制剂调节H/R 损伤心肌细胞的自噬活性相似,可能与LC3-Ⅱ、P62 表达水平有关。
H/R 过程会影响心肌细胞线粒体能量代谢,启动线粒体途径介导的凋亡。Bcl-2 家族是调节凋亡程度的重要分子,包括抗凋亡蛋白和促凋亡蛋白,同时促凋亡蛋白Bax 可以调控抗凋亡蛋白Bcl-2,Bax 能够通过级联反应激活caspase-3,促进细胞凋亡[27]。邓秋菊等[28]发现H/R 心肌细胞中HMGB1表达量升高,敲低HMGB1 可缓解H/R 心肌细胞的凋亡。赵丽华等[29]发现下调HMGB1 表达,可降低caspase-3 的表达水平,进而抑制心肌细胞凋亡。周慧良等[30]发现MiR-499 靶向调控HMGB1 表达,显著下调Bax、caspase-3 的表达,上调Bcl-2 的表达,进而逆转H9C2 心肌细胞的凋亡。本研究中H/R 损伤心肌细胞较对照组Bax、caspase-3 表达水平明显升高,Bcl-2 水平明显下降。而APS 和HMGB1 抑制剂可降低H/R 损伤心肌细胞Bax、caspase-3 表达水平,提高Bcl-2 水平。表明APS 和HMGB1 抑制剂调节H/R 损伤心肌细胞的凋亡可能与Bcl-2、Bax、caspase-3 表达水平有关。
综上所述,APS 能够修复H9C2 心肌细胞的H/R损伤,可能通过抑制HMGB1/TLR4/NF-κB 信号通路,抑制细胞凋亡和自噬活性,以期为心肌缺血再灌注的治疗提供新方向。
利益冲突:所有作者均声明不存在利益冲突
