新诊断2 型糖尿病患者β 细胞第一时相分泌功能与颈部动脉粥样硬化斑块的相关性研究
2022-03-07桑丹臧嘉斌庄雄杰曾玲段新月柳岚
桑丹,臧嘉斌,庄雄杰,曾玲,段新月,柳岚
胰岛β 细胞分泌和作用缺陷是2 型糖尿病(T2DM)的关键发病机制。在糖代谢障碍早期,β细胞的细胞膜对葡萄糖的转运发生下调反应,因此胰岛素分泌缺陷的最初表现,即对葡萄糖刺激的无反应性。但精氨酸等非葡萄糖物质作用于β 细胞的不同位点,使其仍保留对非糖物质的反应性[1]。因此临床上常用精氨酸刺激试验(AST)来评估患者胰岛β 细胞的储备功能。
糖尿病患者心血管疾病的发生率是非糖尿病人群的2~4 倍,心血管疾病累及心、脑、外周大血管,也是糖尿病患者致残、致死的主要原因。而心血管疾病的主要病变为动脉粥样硬化,颈动脉粥样硬化可作为冠状动脉粥样硬化的替代依据,也被认为是全身动脉粥样硬化的窗口指标[2-3]。
C肽(CP)作为比胰岛素更可靠地反映β细胞分泌功能的指标,近年来有不少关于其与T2DM 患者动脉粥样硬化的相关性研究[4-5],但结论尚不明确[6]。且鲜少有报道通过AST 后CP 的变化反映新诊断T2DM 患者β 细胞第一时相分泌功能与颈部动脉粥样硬化斑块的相关性。本文就此进行了以下研究。
1 资料与方法
1.1 研究对象
横断面选取2018 年1 月至2021 年1 月在中山大学附属第八医院(深圳福田)内分泌科住院的新诊断T2DM 患者328 例(在本研究中第一次诊断或在1 年之内诊断T2DM 且未使用任何降糖药物治疗的患者),其中男性237 例,女性91 例,平均年龄(49.1±13.4)岁。入选标准:符合《2017 年中国糖尿病防治指南》T2DM 诊断标准[7];既往未服用调脂药物。排除标准:(1)1 型糖尿病,继发性糖尿病以及特殊类型糖尿病;(2)病情不稳定,处于应激状态,如合并糖尿病急性并发症、合并严重感染性疾病等;(3)合并免疫系统疾病及肿瘤;(4)合并影响糖代谢的内分泌系统其他疾病,包括但不限于甲状腺功能亢进症、Cushing 综合征、肢端肥大症、嗜铬细胞瘤等。本研究通过中山大学附属第八医院(深圳福田)伦理委员会审批通过。
1.2 研究方法
询问患者病史、进行体格检查,记录年龄、性别、吸烟史、饮酒史及血压等一般情况。体重指数=体重(kg)/身高(m2)(kg/m2);吸烟定义为一生中连续或累积吸烟6 个月及以上[8]。
胰岛β 细胞第一时相分泌功能检查:AST 前1日晚22:00 后禁食禁饮,次日早晨在卧床状态下抽血。一侧上肢肘正中静脉抽血测空腹CP 记为0 min,然后30 s 内快速静脉注射25%精氨酸注射液20 ml后,立即计时并于另一上肢在注射后2 min、3 min、4 min、5 min 抽血送检测CP。精氨酸刺激后急性CP变化[CP 增值(∆CP)]来反映胰岛β 细胞第一时相分泌功能。∆CP=[(CP 2 min+CP 3 min+CP 4 min+CP 5 min)/4]-(CP 0 min)。为避免高糖毒性对胰岛β 细胞功能的影响,研究对象均在空腹血糖<11.1 mmol/L 时进行AST。
分组:根据∆CP 三分位间距将入选患者分为低∆CP组(n=110)、中∆CP组(n=109)、高∆CP组(n=109)。
1.3 颈动脉超声检查
被检者均由同一名超声科医师进行颈部动脉超声检查。患者仰卧位,充分暴露颈部,头稍偏向对侧。使用飞利浦EPIQ 7C 超声仪(荷兰),L12-3 超声探头,从双侧锁骨上窝颈总动脉起始处由下至上沿血管走行进行横、纵切面扫查,依次对双侧锁骨下动脉、椎动脉、颈总动脉、球部、分叉处、颈内动脉、颈外动脉进行检查。局限性内中膜厚度≥1.5 mm 被认为存在动脉粥样硬化斑块。
1.4 血液生化指标测定
所有患者于入院后24 h 内,禁食12 h,禁饮8 h,于次日清晨抽取肘静脉血,测定糖化血红蛋白(HbA1c)、总胆固醇、甘油三酯、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血肌酐、血尿酸、空腹CP、尿微量白蛋白/肌酐值(UACR)。
1.5 统计学方法
所有数据均使用SPSS 20.0 统计软件进行统计学分析。计量资料正态分布以均数±标准差表示,非正态分布数据以中位数 (P25,P75) 表示,组间计量资料采用单因素方差分析,非正态分布计量资料采用非参数秩和检验进行比较。计数资料以百分率表示,采用卡方检验进行比较。Logistic 回归分析颈部动脉粥样斑块影响因素以及∆CP 与颈部动脉粥样硬化患病率的相关性。P<0.05 为差异具有统计学意义。
2 结果
2.1 三组患者临床资料比较(表1)
研究对象中检测出有颈部动脉粥样硬化斑块的患者平均年龄为(56.3±11.5)岁,占总研究对象的56.1%。
低∆CP组、中∆CP组、高∆CP组三组患者间性别、吸烟史、高血压、入院前服用降压药情况、收缩压、舒张压、总胆固醇、LDL-C、血肌酐、UACR 比较,差异均无统计学意义(P均>0.05)。低∆CP组年龄、HbA1c、HDL-C 高于高∆CP组,且随着∆CP 水平的下降,颈部动脉粥样硬化斑块发生率依次升高,高∆CP组、中∆CP组和低∆CP组分别为43.1%、56.9%、68.2%(P均<0.05);而体重指数、甘油三酯、血尿酸、空腹CP 低于高∆CP组(表1,P均<0.05)。
表1 三组患者临床资料比较 [,中位数 ( P25,P75) ]

表1 三组患者临床资料比较 [,中位数 ( P25,P75) ]
注:∆CP:C 肽增值;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;UACR:尿微量白蛋白/肌酐值。1 mmHg=0.133 kPa
2.2 新诊断T2DM 患者颈部动脉粥样硬化斑块与∆CP 的Logistic 二元回归分析(表2)
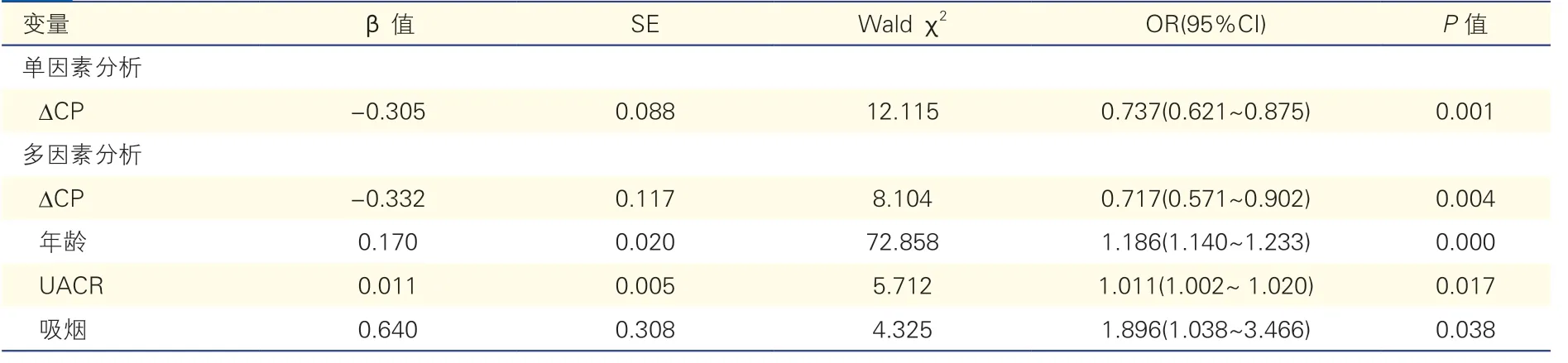
表2 新诊断T2DM 患者颈部动脉粥样硬化斑块与∆CP 的Logistic 二元回归分析
新诊断T2DM 患者颈部动脉粥样硬化斑块发生的影响因素:以是否发生颈部动脉粥样硬化斑块为因变量,在单因素Logistic 分析中,∆CP下降与颈部动脉粥样硬化斑块的发生独立相关(P<0.05)。校正性别、血压、血脂、HbA1c、血肌酐、血尿酸以及高血压用药情况等因素后,∆CP下降仍与颈部动脉粥样硬化斑块的发生独立相关(P<0.05)。
2.3 颈部动脉粥样硬化斑块患病风险评估(表3)
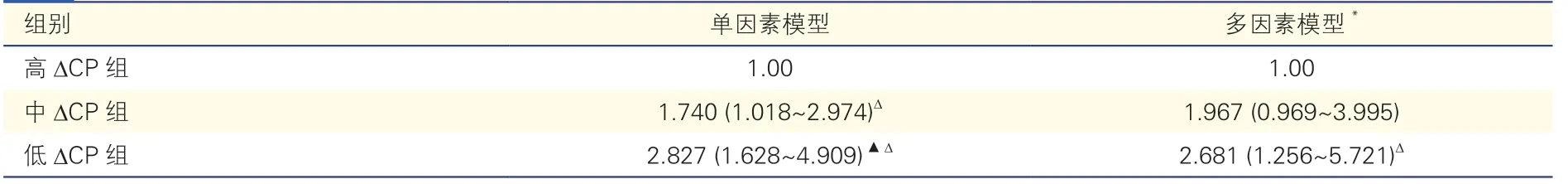
表3 ∆CP 与颈部动脉粥样硬化斑块的患病风险评估
以高∆CP 为参照组(OR=1.0),颈部动脉粥样硬化斑块是否发生为因变量,在单因素及多因素Logistic 模型中,低∆CP组患者颈部动脉粥样硬化斑块的患病风险较高∆CP组明显升高(P均<0.05)。
3 讨论
在T2DM 的自然病程中,β 细胞功能最先发生变化的是第一时相胰岛素分泌的减少或消失,反映了β 细胞储备能力降低。该时相为一个胰岛素分泌高峰,尽管只持续数分钟,却具有重要的临床意义,能降低肝糖输出、抑制脂肪分解、减少糖异生、控制餐后血糖高峰[9]。AST 是一种非葡萄糖刺激β 细胞功能测定试验,快速静脉注射精氨酸可诱发胰岛素快速分泌相(AIR),反映第一时相胰岛素分泌情况。对葡萄糖刺激无反应或反应差的患者,对精氨酸刺激可仍有反应。因此若AIR 刺激有反应,提示仍有一定数量功能尚存的β 细胞,反之表明β 细胞功能丧失殆尽[10]。CP 是比胰岛素更为可靠评价胰岛β 细胞功能的指标,因二者均是由胰岛素原经蛋白酶及羧肽酶分解的等克分子浓度的肽类物质,在门静脉中具有相等的当量浓度;但CP 的半衰期较胰岛素更长,且被胰岛素靶器官利用极少;能反映使用外源性胰岛素治疗患者的β 细胞的胰岛素合成及分泌功能[11]。因此本研究采用已被证实的能更好反映β 细胞储备功能的AST 2~5 min CP 均值与空腹CP 的差值∆CP 来评估β 细胞储备功能。
美国心脏协会(AHA)称“糖尿病是一种心血管疾病”。心脑血管病变的基础是动脉粥样硬化,颈动脉粥样硬化可反映全身动脉粥样硬化。糖尿病患者发生动脉粥样硬化的危险因素包括传统因素(年龄、性别、脂代谢紊乱、血压、吸烟、血糖控制等)[12]或非传统因素(凝血纤溶系统、炎症因子等)[13-15],但关于β 细胞第一时相分泌功能与颈部动脉粥样硬化相关性的研究并不多见。
本研究结果显示:(1)按入选患者∆CP 三分位进行分组发现,年龄、体重指数、HbA1c、甘油三酯、HDL-C 和血尿酸在三组间差异具有统计学意义,提示高龄、平均血糖水平高的患者β 细胞第一时相分泌功能差,而超重或者肥胖、脂代谢紊乱以及尿酸升高患者β 细胞的早相分泌功能稍优于低、中∆CP组患者,但从∆CP 幅度来看,这些患者∆CP不能较基础值升高4~6 倍,提示尽管超重或肥胖、脂代谢紊乱患者有胰岛素抵抗的存在,但β 细胞功能的减退仍是T2DM 发生的决定因素[16]。(2)研究对象中检测出有颈部动脉粥样硬化斑块的患者平均年龄为(56.3±11.5)岁,表明动脉粥样硬化在T2DM患者中发病年龄轻,与国内外研究一致[17-18]。(3)随着∆CP 水平的下降,颈部动脉粥样硬化斑块发生率依次升高,分别为43.1%、56.9%、68.2%。同样空腹CP 低的患者也有较高的动脉粥样硬化斑块发生率。国内陈宇诗等[19]以口服葡萄糖耐量试验中30 min CP 和空腹CP 差值与30 min 血糖和空腹血糖差的比值来反映早相胰岛素分泌指数(IGI),发现颈动脉粥样硬化发生率在低、中、高IGI 30 min组依次为56.76%、43.24%、31.53%,均略低于本研究发现的动脉粥样斑块发生率,考虑与本研究除了测量双侧颈动脉之外,还检测了锁骨下动脉有关。国内指南指出颈部动脉包括颈动脉、椎动脉和锁骨下动脉[20]。且近年研究发现,右侧锁骨下动脉内膜病变早于颈动脉,较颈动脉能更早期发现动脉粥样硬化[21-23];其次本研究采用精氨酸作为刺激因素,能诱发一部分对葡萄糖无反应患者的β 细胞功能;另外纳入的对象均未服用调脂药物,高血糖与血脂紊乱的共同作用加剧了动脉病变。(4)本研究以是否出现颈部动脉粥样硬化斑块为因变量,发现∆CP 下降与动脉粥样硬化斑块的发生独立相关。在单因素分析基础上,进一步校正性别、血压、血脂、HbA1c和降压药物服用等混杂因素后,Logistic 回归分析显示∆CP 减少仍与新诊断T2DM 患者颈部动脉粥样硬化的发生独立相关。本研究还发现,同样作为动脉硬化风险因素除了年龄为不可逆外,吸烟对动脉粥样硬化的发生也有促进作用。另外白蛋白尿是肾脏内皮细胞受损的表现,也是全身动脉内皮损伤和血管病变的标志之一,上述结果也与既往报道一致[24]。(5)以高∆CP 为参照组,随着∆CP 水平的下降,颈部动脉粥样硬化的患病风险明显升高,低∆CP组患者的颈部动脉粥样硬化患病风险是高∆CP 的2.681倍。研究表明,β 细胞储备功能下降是心血管事件和死亡率的显著预测因子[25]。Roussel 等[26]在健康人群中使用葡萄糖钳夹技术评估β 细胞功能,发现β 细胞的储备功能与颈动脉内中膜厚度显著相关而与胰岛素抵抗无关。AST 后∆CP 减少与动脉粥样硬化的发生独立相关,可能的机制是:迅速增加的CP可以通过红细胞介导的机制激活内皮型一氧化氮合酶,从而导致动脉内皮细胞产生一氧化氮促进血管扩张、增加血流[27];减少黏附分子,如P 选择蛋白、细胞间黏附分子,显著减少炎症刺激的白细胞与内皮细胞间的相互作用[28];还通过核因子κB 通路拮抗高糖诱导的内皮功能障碍显著降低内皮细胞活性氧的产生,减少血管损伤;减少细胞因子的释放从而降低血管内皮细胞黏附分子的表达[29]。这些机制都提示高∆CP 在对抗动脉粥样硬化方面的积极作用。
另一方面T2DM 早期,低∆CP 表明患者β 细胞第一时相分泌缺陷,导致餐后即时胰岛素分泌障碍,使得餐后血糖不能迅速下降,餐后血糖高峰导致的血糖波动与动脉粥样硬化发生关系更加密切[30]。基础研究表明,第一时相缺陷所致的餐后血糖急剧升高导致的高糖毒性加速蛋白非酶促糖基化,如糖基化的红细胞膜变形能力下降、低密度脂蛋白被糖基化后难被其受体识别,吞噬细胞则增加对低密度脂蛋白的摄取,形成泡沫细胞促进动脉斑块形成;糖基化终末产物通过细胞因子的促增殖作用,促进血管基质增生;增加氧化应激及细胞凋亡加剧血管病变[31];餐后高血糖又可使纤溶增加和反复的凝血机制激活,促进凝血;激活内皮细胞的蛋白激酶C,刺激黏附因子的产生[32]。因此在低∆CP 以及餐后血糖过高的双重打击下,患者更易出现动脉粥样硬化斑块。
血压、血脂、HbA1c等传统心血管疾病危险因素未在二分类Logistic 回归方程,与Yang 等[18]的研究结果一致。可能与部分患者在入院前已经服用降压药物、糖尿病程短、平均发病年龄不大有关,同时也需要我们更深入研究以充分认识这些传统危险因素。
另外,基于以下原因,本研究没有将空腹血糖以及餐后2 h 血糖纳入分析:(1)血糖受影响因素多,入选为新诊断的T2DM 患者,入院时血糖均明显升高并立即使用胰岛素进行强化治疗,空腹或餐后血糖均为治疗中的状态。另外胰岛素治疗期间患者的餐后血糖波动幅度不大,纳入餐后血糖或血糖波动幅度的话,不能准确反映餐后血糖波动情况;(2)空腹CP 以及△CP 不受外源性胰岛素、血糖波动情况影响,准确度更高。因此应用AST 来反映β 细胞第一时相功能,受影响因素少,对于患者在胰岛素强化治疗结束后,降糖药物的选择来减少餐后血糖波动,从而降低动脉粥样硬化的发生更具有参考价值。
本研究尚可扩大样本量并进行多中心、前瞻性研究进一步验证本结果的准确性。但观察对象为新诊断或病程小于1 年且未治疗的T2DM 患者,较大程度地控制了病程等其他混杂因素的影响。采用糖负荷后胰岛素增值与血糖增值比值来反映β 细胞功能,也得到广泛应用,但该方法的缺点是,不能比较胰岛素分泌曲线平坦人群的β 细胞功能。使用非糖物质刺激β 细胞并观察刺激后急性CP 变化反映β 细胞第一时相功能为本研究的创新之处。
综上,新诊断T2DM 患者β 细胞第一时相分泌功能下降与颈部动脉粥样硬化关系密切,提示早期通过综合管理、合理用药,监测CP 水平、改善β 细胞功能对糖尿病大血管并发症的发生、发展具有一定的保护作用。
利益冲突:所有作者均声明不存在利益冲突
