基于G-三链体分子信标的多聚核苷酸激酶荧光检测新方法
2022-03-06朱文平刘硕硕李志怡
朱文平,刘硕硕,李志怡
(周口师范学院 化学化工学院, 河南 周口 466001)
T4多聚核苷酸激酶(T4 PNK)是一种典型的DNA修复酶,它在许多基本细胞过程中(包括DNA重组、DNA损伤修复和DNA复制等)起关键作用[1,2]。T4 PNK通过将γ-磷酸从三磷酸核苷转移到核酸或寡核苷酸中,特异性催化5'-OH磷酸化,这在DNA修复和细胞核酸代谢中都很重要[3]。此外,T4 PNK参与遗传完整性的维持与多种人类疾病密切相关,并被发现是癌症治疗的潜在靶点,因此T4 PNK的测定和PNK抑制剂的筛选对于疾病诊断和药物发现至关重要[4,5]。
PNK测定的常规方法包括放射性同位素32P-标记[6]、聚丙烯酰胺凝胶电泳[7]和放射自显影等[8]。尽管这些方法已经很成熟,但它们存在灵敏度和特异性低、耗时长、成本高等缺点,有些会导致放射性污染,因此,它们的用处有限。荧光法因其灵敏度高、响应快而备受关注,现已发展成为应用广泛的PNK测定方法之一。但是大多数荧光法严重依赖复杂的序列设计和昂贵的染料标记,从而增加了检测的成本和操作难度[9]。因此,开发一种简便、低成本且高灵敏的T4 PNK活性荧光检测方法仍然是一个不小的挑战。
分子信标(MB)是一种专门设计的单链DNA分子,以其优异的灵敏度和特异性被广泛用作荧光探针来构建均相检测系统[10]。传统的MB需要对一个DNA 进行双重荧光标记,制备过程耗时且成本较高,而非标记的荧光策略可以避免MB的缺点。G-三链体(G3)是一种新的非经典DNA结构,由只有三个G束的富含G的序列组成[11],它可以与硫黄素T(ThT)结合形成“发光”荧光探针,近年来基于G3/ThT荧光特性构建的生物传感器已成功用于核酸、金属离子、蛋白质和生物小分子等的检测[12]。综上所述,本文利用G3/ThT复合物做信号报告分子,基于G3MB探针构建了一种高效简便的T4 PNK荧光检测新方法。
1 实验部分
1.1 仪器与试剂
T4 PNK、Lambda核酸外切酶(λexo)、小牛肠碱性磷酸酶(CIP)等均购于纽英伦生物技术(北京)有限公司。硫酸铵来自国药集团化学试剂有限公司,ThT来自阿拉丁试剂(上海)有限公司。三磷酸腺苷溶液(ATP, 100 mmol/L)和三(羟甲基)氨基甲烷(Tris)来自生工生物工程(上海)股份有限公司。实验中的寡核苷酸由生工生物工程(上海)股份有限公司合成并纯化,序列组成如下:G3MB(5'-3')TGGGAAGGGAGGGAAAAAGAGTCTTCCAGTGTGATGATTTC
CCT(斜体部分为G3序列);P1(5'-3')TCATCACACTGGAAGACTCT;实验所用缓冲溶液为Tris-HCl缓冲液1(50 mmol/L NaCl, 10 mmol/L Tris-HCl, 10 mmol/L MgCl2, pH=7.9)和Tris-HCl缓冲液2(20 mmol/L Tris-HCl, 20 mmol/L KCl, 20 mmol/L MgCl2, 140 mmol/L NaCl, pH=7.4)。
本实验荧光光谱的测定仪器为安捷伦Cary Eclipse荧光分光光度计,激发波长设为430 nm,荧光光谱的收集范围为450~600 nm,PMT电压设置为700V,激发和发射狭缝宽度均为10 nm。
1.2 实验方法
首先将G3MB和P1用Tris-HCl缓冲液1溶解成20 μmol/L的浓度,然后取出部分G3MB退火处理,后稀释至10 μmol/L置于冰箱上层备用。取600 μL的离心管若干,编号之后各加入20 μL的反应溶液,包括3 μL P1(10 μmol/L),2 μL PNK缓冲液(10×),2 μL ATP(10 mmol/L)以及不同体积的T4 PNK稀释液和纯水,混匀器上振荡均匀,后置于水浴锅中37 ℃恒温水浴1 h。反应结束后,设置温度为65 ℃,恒温水浴20 min对T4 PNK进行灭活处理。接着向上述溶液中分别加入5 μL λexo缓冲液(10×),3 μL G3MB(10 μmol/L)和纯水凑成50 μL的体积,37 ℃恒温水浴20 min取出,加入0.5 μL的λexo原液,37 ℃下酶切1 h,然后分别加入10 μL ThT(300 μmol/L)和240 μL Tris-HCl缓冲液2,振荡混匀后37 ℃水浴30 min,最后进行荧光光谱的测定。
2 结果与讨论
2.1 实验原理
笔者研究了一种基于G3MB的T4 PNK荧光检测新方法,实验原理如图1所示。本实验设计了两条DNA链,分别为G3MB和P1,其中G3MB的5'端包含一个G3序列,G3MB自杂交形成的发夹结构将部分的G3序列封闭到G3MB的茎干区。另外,G3MB环状区的碱基与P1链是互补的。由图1可知,P1链在ATP与T4 PNK的共同作用下被磷酸化, 后与G3MB杂交形成一个双链复合物,打开MB结构将MB茎干区封闭的G3序列释放出来。加入λexo后双链复合物中5'磷酸化的P1链被λexo酶切降解,释放出G3MB,后者又重新变成发夹结构,G3序列被重新封闭在G3MB的茎干区。再加入染料ThT,由于其不能与封闭的G3结合,只得到较弱的荧光信号。无T4 PNK时,P1链不能被磷酸化,P1和G3MB杂交形成双链复合物,释放出被封闭在茎干区的G3序列。此时加入λexo,由于没有λexo的最适底物(即5'磷酸化的双链DNA),所以双链复合物不能被λexo酶切,G3序列仍处于自由状态,接着再加入染料ThT,G3与ThT特异性结合从而使荧光信号增强,检测体系的荧光强度与T4 PNK的浓度呈反比。

图1 基于G3MB探针的T4 PNK荧光检测研究的原理示意图
2.2 实验原理验证
在该实验中,通过分析对比不同实验条件下得到的荧光光谱可实现对方法实验原理的验证。如图2所示,曲线e描述的是体系中只有10 μmol/L ThT无DNA链时的荧光光谱;曲线d代表在0.01 U/mL T4 PNK和ATP共同存在时,加入λexo得到的荧光光谱;曲线c的实验条件与曲线d类似,但T4 PNK是经过热灭活后添加的,其荧光光谱的强度跟T4 PNK测定的空白(曲线b)相差无几,说明T4 PNK的酶活性已热灭活;荧光强度最大的曲线a代表体系中只存在P1与G3MB,两者杂交形成双链复合物,但无λexo作用加入ThT后得到的荧光光谱。通过图2各曲线的对比分析可知,只有当ATP与T4 PNK同时存在时,P1/G3MB双链复合物中磷酸化的P1才会被λexo酶切,最终得到弱的荧光信号(曲线d);无T4 PNK的空白或加入灭活的T4 PNK,P1/G3MB双链复合物不能被λexo酶切, G3序列结合ThT后荧光增强。综上所述,本实验的原理是正确可行的。

图2 不同实验条件下的荧光光谱图
2.3 实验条件考察
根据前期的实验摸索和相关资料查阅,本实验对检测性能影响较大的有两个实验条件,分别是荧光染料ThT和λexo的浓度。为达到最佳的检测效果,实验中采取固定其他实验条件来对上述两个条件进行考察优化,从而找出各自的最佳浓度,具体的考察内容及结果如下。
荧光染料ThT作为该实验的信号报告分子,其浓度对检测体系的荧光强度有着直接影响,实验中首先对ThT的浓度进行了考察,结果如图3所示。实验过程中考察了8种不同浓度的ThT,分别是2、4、6、8、10、12、14和16 μmol/L。如图3所示,当ThT浓度增大时,相应的荧光信号比先增大后减小,峰值对应的ThT浓度为10 μmol/L。当荧光信号比达到峰值后,继续增大ThT的浓度,荧光信号强度增大速率减缓,但对应的背景荧光增强,导致荧光信号比减小。因此,在随后的实验过程中,ThT的最佳浓度选作10 μmol/L并保持不变。

图3 体系的荧光信号比对ThT浓度作图(荧光信号比是指荧光信号在490 nm处的强度与空白的比值)
另外,λexo的浓度也是实验考察的重要对象之一。实验过程中一共考察了7个不同的λexo浓度,分别为0.000 5、0.002、0.01、0.05、0.1、0.2和0.3 U/mL。如图4所示,荧光强度在初期随λexo浓度的增大急剧减小,在浓度为0.1 U/mL后趋于稳定,继续增大λexo浓度对实验结果影响不大,说明此浓度时λexo对DNA底物的酶切趋于完全,因此0.1 U/mL是λexo的最佳浓度,在接下来的实验过程中将λexo的浓度固定在0.1 U/mL。

图4 体系的荧光强度对λexo浓度作图
2.4 传感方法对T4 PNK的检测性能
在上述最佳的实验条件下,本方法通过测定不同浓度T4 PNK条件下的荧光光谱来考察T4 PNK的检测性能。如图5A所示,随着T4 PNK浓度的逐渐增大对应的荧光光谱强度反而逐渐减小,这是因为更多的P1被磷酸化导致P1/G3MB双链复合物中的P1被酶切,释放出更多的封闭G3序列的G3MB。图5B表示的是传感方法对T4 PNK检测的荧光响应(490 nm处)校准曲线,实验结果表明荧光响应值跟T4 PNK浓度的对数在0.000 2~0.01 U/mL的范围内呈现良好的线性关系,如图5B的插图所示。该方法对T4 PNK检测的线性回归方程为
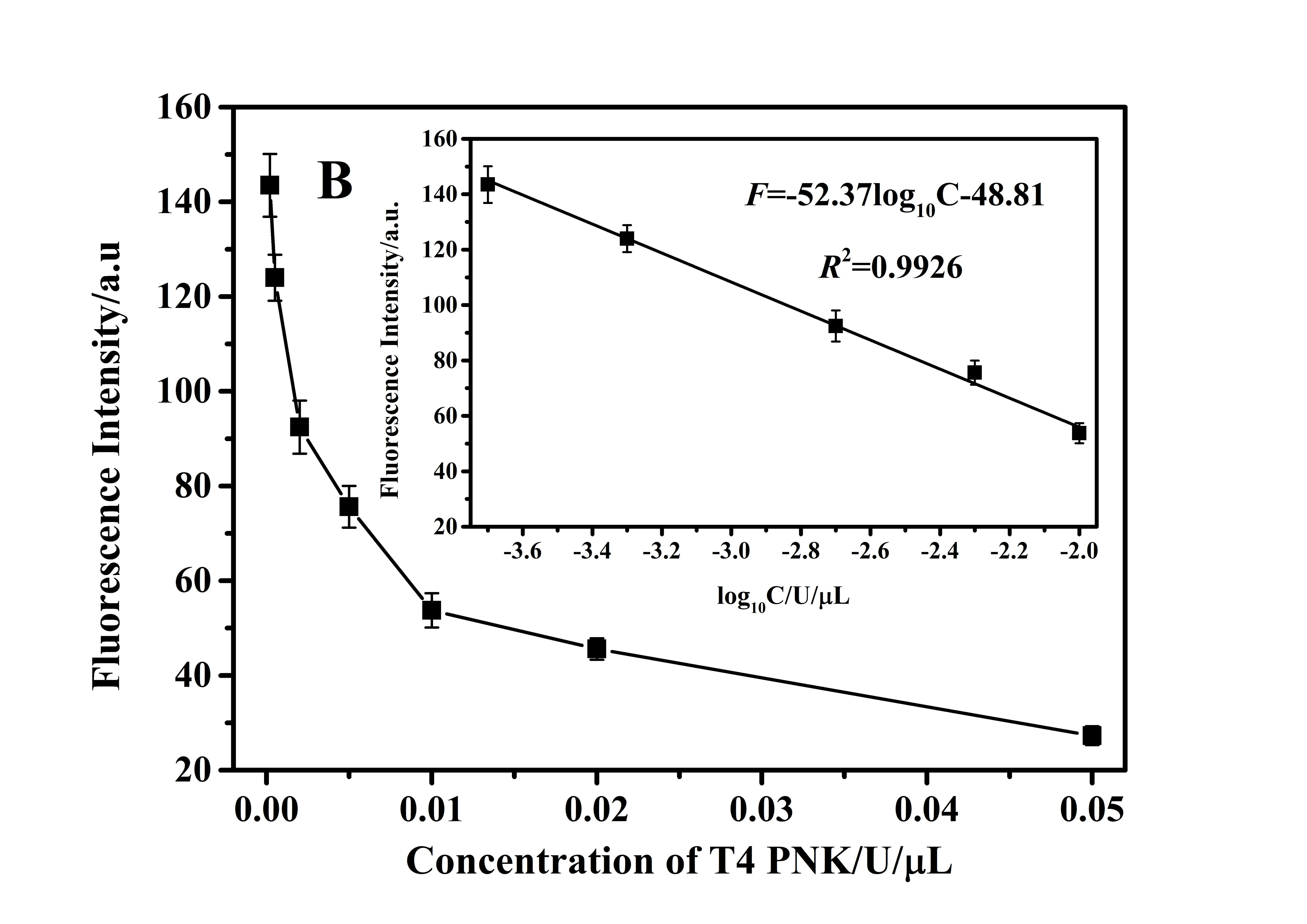
图 5 (B)传感方法对T4 PNK检测的荧光响应(490 nm处)校准曲线;插图为衍生的校准曲线,每个数据点是N = 3次单独测量的平均值,误差棒表示标准偏差。
F=-52.37 logC-48.81,
其中F代表检测体系的荧光强度,C代表T4 PNK浓度。另外,根据3σ规则估算,本方法对T4 PNK的检测限为0.000 2 U/mL,相关系数R2=0.992 6。

(A)检测体系在分析不同浓度T4 PNK时的荧光光谱
2.5 传感方法的选择性
T4 PNK荧光检测选择性的评估是将方法对目标T4 PNK和其他核酸酶的荧光响应信号进行对比分析,如图6所示。
从图6可以明显看出,只有加入T4 PNK时,相对荧光强度才较小,而加入其他大浓度的核酸酶时,相对强度与无T4 PNK的空白接近。实验中T4 PNK的浓度为0.01 U/mL,其他5种核酸酶的浓度10倍于T4 PNK,但其他核酸酶引发的荧光响应的相对强度仍然与空白相近,由此可见,本方法对T4 PNK的检测具有十分突出的选择性。
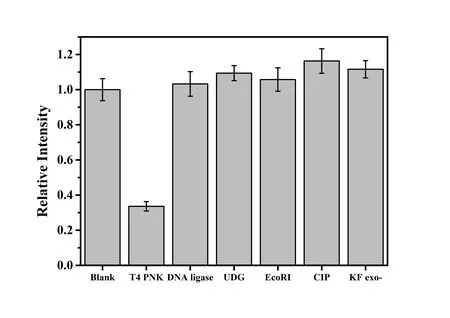
图 6 T4 PNK荧光检测的选择性
2.6 T4 PNK活性抑制评估
筛选有效的T4 PNK抑制剂对临床治疗的发展具有重要意义,通过查阅相关文献资料可知硫酸铵是常用的PNK活性抑制剂,且其并不影响λexo的活性,可以作为抑制剂筛选的模型。因此,硫酸铵被选作T4 PNK的抑制剂,实验中一共考察了6个不同的抑制剂浓度,分别是5、10、15、20、25和30 mmol/L。如图7所示,随着硫酸铵浓度的不断增大,T4 PNK的相对活性逐渐降低。实验结果表明,硫酸铵的半抑制浓度(IC50)为17 mmol/L,该结果与文献报道接近[13]。

图7 硫酸铵对T4 PNK活性的抑制作用(无抑制剂的T4 PNK活性设为1)
3 结束语
提出了一种基于G3MB探针的T4 PNK荧光检测新方法。该方法基于G3与ThT结合荧光增强的特性,构建无荧光基团标记的生物传感器用于T4 PNK活性的高灵敏检测,还可用于酶活性抑制作用的评估。本方法具有操作简单、低成本和高选择性等优点,为构建高效的T4 PNK检测新方法提供了参考价值。
