乳酸菌抗冷胁迫作用研究进展
2022-03-06吴正钧
张 佳,韩 瑨,吴正钧, ,张 娟,余 意
(1.光明乳业研究院乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,上海 200436;2.上海大学生命科学学院,上海 200444)
乳酸菌(lactic acid bacteria,LAB)是发酵可利用的糖类物质后主要产物为乳酸、不形成芽孢的革兰氏阳性细菌的统称,它们在分类上具有多样性[1]。乳酸菌分布广泛,除了动物的消化道、植物的茎、叶、果实及部分天然发酵食品外,也存在于部分极端低温的生境中[2]。同时,乳酸菌也是导致部分冷藏包装食品污染的重要原因[3]。乳酸菌可用于各种发酵食品的生产和保存。此外,部分乳酸菌可以对宿主健康产生明确地促进作用,如调节肠道菌群的组成[4]、缓解腹泻、乳糖不耐症、糖尿病等[5],对于癌症也有一定预防作用[6]。因此,这些乳酸菌被作为益生菌在医药、食品和养殖业等领域广泛应用[7]。
大多数乳酸菌适合在20~45 ℃生长,当环境温度急剧下降并明显低于其正常的生长温度范围时,乳酸菌细胞的代谢甚至形状会出现异常,这会影响细胞的存活性。例如,在制备直投式酸奶发酵剂时需经过深度冷冻或真空冷冻干燥过程,而低温会对组成酸奶发酵剂的乳酸菌细胞内的酶活[8]、细胞质的流动性等造成严重损伤,使其死亡率明显升高,从而降低发酵剂的生产性能[9]。同时,发酵乳作为乳酸菌的优良载体,在运输和保存过程中,通常需要采用冷藏措施,低温也会导致部分乳酸菌的活菌数或活力降低,从而影响其在体内功能的发挥。此外,为了达到长期保存的目的,通常需要将乳酸菌存放在低于零度甚至-80 ℃的环境中,在此过程中,极端低温会导致细胞渗透压升高、形成冰晶,导致细胞完整性受损等,从而导致部分细胞死亡。
当周围环境温度急剧下降时,细菌细胞会产生一系列的生理变化,如膜的流动性下降、部分蛋白质折叠效率降低及核糖体的功能发挥受到限制等[10]。前期已有研究者对古细菌、嗜中温细菌等对冷胁迫的应激反应进行了综述,包括降低组成细胞膜脂肪酸的不饱和度、合成冷休克蛋白等[11-12]。研究者很早就注意到环境胁迫对乳酸菌细胞完整性及生理代谢的影响,但受限于缺乏合适的遗传操作工具等原因,对乳酸菌受到冷胁迫时冷休克蛋白的表达及其生理功能缺乏系统的研究。随着组学(Omics)技术出现及质谱分析技术的发展,研究者对乳酸菌的抗冷胁迫作用获得了更全面和深入的了解。因此,本文总结了过去二十年内研究乳酸菌抗冷胁迫的主要进展及方法,以期为后续的研究提供一定的借鉴。
1 冷胁迫对乳酸菌的影响
1.1 对细胞膜流动性和完整性的影响
在冷冻过程中细胞膜发生膜脂质相变,磷脂双层从液态无序液晶相变为刚性有序凝胶相,并伴随细胞周围及胞内基质由外至内的冰晶形成[13]。针对冷冻造成细胞损伤的机制,Mazur等[14]提出了双因素假说。该假设认为,在低冷却速率下,细胞损伤主要来自渗透压的改变(溶液效应),低温引起的冰晶形成会导致胞外溶质浓缩,使细胞长时间暴露于离子强度增加、pH改变的环境中;在高冷却速率下,胞内冰晶的形成被认为是导致细胞死亡的主要原因。然而,当冷冻保护剂存在时,并未观察到细菌细胞内冰晶的形成[15]。因此,也有研究者认为LAB细胞在快速冷冻时的损伤不是来自于胞内的冰晶,而是由解冻过程中发生的细胞内外渗透压不平衡所引起[16]。Meneghel等[13]认为冷冻会产生结冰和高渗透压双重效应,对保加利亚乳杆菌分别进行冻融处理和高渗透压胁迫处理,观察到了相似的生物活性损失。因此,他们强调高渗透压的形成是冷冻损伤的主要来源。
细胞包被(Cell envelope)的组成在很大程度上取决于微生物生活的环境,其中温度是最重要的因素之一[17]。细胞膜的组成和结构对细菌的冷适应很重要,因为它们构成了细胞和环境之间的动态界面,使细菌能够应对环境挑战[18]。此外,细胞膜还可作为分子传感器,在分子运输和相关应激反应的激活中发挥重要作用[19]。当受到冷胁迫时,微生物细胞膜的流动性和完整性会受到影响。Wang等[20]将3株植物乳杆菌分别在-20和-196 ℃预冻3 h后再进行冷冻干燥,然后采用荧光双染色法测定了细胞膜完整性。结果发现,在不同预冻温度下,3株植物乳杆菌的膜完整性受到不同程度的破坏。与-20 ℃相比,在-196 ℃预冻会导致3株被测试植物乳杆菌的细胞膜损伤密度显著增加,这表明适当的预冻温度能够使细胞内形成更均匀的冰晶,从而减少对细胞膜的损伤[20]。
1.2 对蛋白质结构和功能的影响
低温会降低细胞内蛋白质尤其是酶的活性,甚至影响蛋白质的正常折叠,主要表现如下:影响某些蛋白质的分泌[10];导致部分蛋白质折叠缓慢或效率低下;降低酶进行转录或翻译的活性。细胞要维持生命活动,需要保持酶的一定活性。随着温度的降低,酶反应速率也降低,而蛋白质的刚性增加。为了应对这些影响,生活在低温环境中的嗜冷菌(psychrophile)通过下调初级代谢或改变蛋白质的分子结构、减少稳定相互作用增加分子的无序度,从而维持酶的功能[21]。
冷胁迫会导致乳酸菌细胞产生何种应激反应,取决于实际面临的温度是否高于0 ℃。当温度低于0 ℃时,大多数原核细胞出现被动反应,胞内水结冰,引发细胞膜和DNA损伤,最终导致细胞缓慢死亡[22]。高于冰点的低温可能导致乳酸菌生长停滞,但这种情况不会突然引发细胞死亡。然而对于嗜冷菌,即使在低于冰点的温度下也能维持其代谢和生长[23],原因在于嗜冷菌中含有独特的冷适应蛋白,例如伴侣蛋白。伴侣蛋白是帮助蛋白质折叠的重要蛋白质。当GroEL和DnaK的伴侣蛋白CspB在嗜温大肠杆菌中表达时,可提高其抗冷性[24]。Mbye等[25]述了乳酸菌在冷胁迫时,细胞适应低温环境蛋白表达的变化(表1)。通过产生冷适应蛋白,乳酸菌在低温下能保持一定的活性。

表1 冷胁迫时部分乳酸菌蛋白表达的变化Table 1 Effects of cold stress on total protein profiles in selected lactic acid bacteria
1.3 对核酸结构和功能的影响
冷胁迫会给细胞带来诸多挑战,例如酶反应速率降低、对底物的亲和力降低,细胞膜流动性降低和RNA聚合酶活性受损等。除此之外,冷胁迫还可影响核酸的结构和功能。研究表明,冻融过程中细菌的死亡主要归结于膜损伤和DNA变性[28]。冷胁迫还会造成核糖核酸和脱氧核糖核酸二级结构的稳定,导致核糖核酸翻译和转录效率的降低[24]。DNA通常为负超螺旋,受温度影响后易产生错误折叠[29]。研究发现,对枯草芽孢杆菌施加冷刺激后,负超螺旋迅速增加[30]。DNA超螺旋的调节在DNA的复制和转录中可起到重要作用[31]。Mizushima等[32]为了检测冷休克对DNA超螺旋的影响,通过含有氯喹的琼脂糖凝胶电泳进行分析。结果发现,当对细胞进行冷休克处理时,细胞中质粒DNA的负超螺旋增加。
2 乳酸菌抗冷胁迫所采用的策略
据报道,冷适应细菌在应对低温条件时有一系列的适应策略[33],如表2所示。其中,胞外聚合物和相容性溶质的产生可为细菌提供渗透保护,膜脂肪酸中不饱和脂肪酸含量的增加有助于维持细菌细胞膜的流动性,分子伴侣的产生可稳定蛋白质,而冷适应蛋白的表达可使细菌更好地适应温度下降。在乳酸菌中,主要通过细胞包被的变化、膜性能的变化、冷休克蛋白的表达和相容性溶质的产生来应对冷胁迫。

表2 微生物适应低温的细胞及分子机制Table 2 Cellular and molecular mechanism of microbial adaptation to low temperature
2.1 细胞包被的变化
胞外聚合物是多种生物分泌到其局部环境中的多功能、高分子量生物聚合物复合物,它们被认为具有多种功能[33]。其中胞外多糖具有促进细胞粘附和吸附环境中低浓度营养物质的作用,同时可为细胞提供多种保护功能如渗透保护、冷冻保护等。研究发现,产生胞外多糖是细菌适应低温环境的共有特征[18]。乳酸菌菌株也可产生胞外多糖[36]。胞外多糖可以作为荚膜多糖附着在细菌表面,也可以作为粘液多糖分泌到周围介质中。在低温条件下,一些冷适应细菌还具有肽聚糖层增厚和与肽聚糖生物合成有关基因上调的特征[33]。Polo等[27]研究发现,肽聚糖组成的差异可能是造成不同乳杆菌在不同预冻温度下冷冻干燥后存活率产生差异的原因。
2.2 膜性能的变化
已有研究证明,冷冻可改变脂质的物理状态,从而改变脂质组织和膜流动性[37]。冷应激(cold shock)处理会改变乳酸菌的膜脂肪酸组成,使菌株的抗冻性增加。Beal等[38]研究发现,嗜热链球菌CFS2的脂肪酸组成与细胞抗冻性密切相关,且不饱和脂肪酸与饱和脂肪酸的之比(UFA/SFA)越高,对冷冻的抵抗力越好。冷冻干燥后的保加利亚乳杆菌的存活率也与UFA/SFA有关[39]。由此可知,受冷胁迫后膜脂组成的差异会造成菌株抗冻性的不同。此外,菌株自身膜脂组成的差异也会造成抗冻性不同。Meneghel等[13]对两株抗冻性不同的菌株,保加利亚乳杆菌ATCC 11842和CFL1的膜脂肪酸进行分析。结果表明,抗冻菌株ATCC 11842的细胞膜中显示出更高的不饱和脂肪酸含量。除了不饱和脂肪酸含量外,UFA/SFA和cycC19:0含量也会对膜流动性造成影响。Fonseca等[40]对影响膜流动性的因素进行了总结(表3),不饱和脂肪酸与饱和脂肪酸之比增加会导致膜流动性的增加,而长链脂肪酸长度的增加则会降低细胞膜的流动性。此外,Velly等[41]还发现环状脂肪酸与不饱和脂肪酸的比率似乎与乳酸乳球菌TOMSC161的冷冻干燥耐受性相关,cycC19:0含量越高,细胞对冷冻干燥的耐受性越好。然而,当前的研究中大部分只是讨论冷胁迫后乳酸菌膜脂肪酸成分的变化,关于乳酸菌调控脂肪酸变化的具体机制仍不清楚,因此,在未来的研究中可从脂肪酸合成相关基因着手,从基因组学的角度对脂肪酸调节机制作进一步探索。
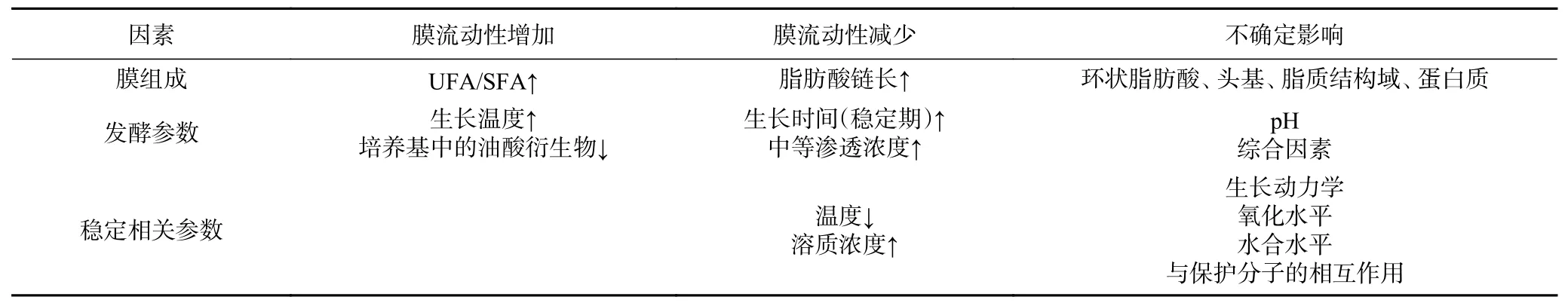
表3 影响LAB膜流动性的主要因素Table 3 Main factors affecting fluidity of LAB membrane
当环境温度降低时,为了在低温条件下的生存,大多数微生物通常会改变膜脂组成,使细胞膜保持一定的流动性。例如,增强脂肪酸脱氢酶对膜脂中脂肪酸底物的催化作用,使脂肪酸链中的双键数量增加,导致UFA/SFA提高,膜脂凝固点降低,从而增加膜流动性[42]。Suzuki等[43]对蓝细菌在低温中的信号转导途径进行研究,发现蓝细菌中存在一个双组分信号转导系统,可调节Δ15-脂肪酸脱氢酶(desB)基因的表达。该基因的表达可提高膜脂中α-亚麻酸含量,增强菌株的低温耐受能力。
由于菌株的膜脂肪酸组成与其抗冻性之间存在一定联系,因此,可通过改变微生物细胞膜的脂肪酸组成来改善其低温适应性,从而使微生物适应冷冻环境,加入油酸可改变细胞膜的脂肪酸组成。对于乳酸菌而言,培养基中加入油酸可提高二氢甾酸的浓度和UFA/SFA。UFA/SFA的提高会增加细胞膜的流动性,从而提高乳酸菌的抗冻性。
李占雷(2014)认为供应链是为了实现全链价值的提升。整合全链资源,帮助节点上的企业融资。表现出是一种金融产品、市场等的特点。
2.3 冷休克蛋白的表达
在环境胁迫下,为了促进自身的生存,细菌必须通过诱导特定的应激反应来快速适应外部干扰[19]。许多微生物在低温下会表达冷休克蛋白,以适应温度的快速下降。当温度高于0 ℃时,细胞出现主动应激,合成一类特定蛋白,即冷休克蛋白[10]。冷休克蛋白是一类核酸伴侣,其主要功能是防止RNA在低温下形成次级结构或促进形成次级结构的RNA的降解。例如冷休克蛋白中的RNA解旋酶DeaD可以阻断二级结构的形成,进一步在冷休克反应产生的核糖核酸外切酶PNPase和RNase R的作用下对它们进行降解[44]。
生产乳酸发酵产品的过程中,乳酸菌细胞会暴露在各种环境胁迫下,例如低温、pH、渗透压和高压,这可能会影响细胞的生理活性[45]。然而,细菌细胞自身具备许多防御机制来提高在压力环境中的生存能力,如伴侣蛋白(GroES/GroEL和DnaK/DnaJ/Grp E)、蛋白酶、运输系统和质子泵[34]。研究人员首次在乳酸乳球菌MG1363中发现了以串联重复方式排列的编码冷休克蛋白基因(csp)的基因家族cspA、cspB、cspC、cspD和cspE[35],与30 ℃培养的细胞相比,经过10 ℃冷休克处理后,cspA、cspB、cspC、cspD的转录水平提高了10~40倍,但cspE的转录水平保持不变。在植物乳杆菌中,也鉴定到多种冷休克基因,如cspC、cspL和cspP。Song等[26]对植物乳杆菌L67进行1、4、6 h的冷胁迫处理后,发现cspL和cspP的表达显著增加。在低温环境中细胞内RNA二级结构的稳定性增加,从而干扰转录和翻译过程的进行,CSPs可以作为RNA伴侣,以不依赖于能量的方式发挥解链和或RNA二级结构去稳定化的功能,起到抗转录终止子的作用,从而提高E.coli对低温环境的适应能力[46]。此外,CSP还可在多种细胞代谢过程中发挥作用,例如脂肪酸代谢、染色体构建、转录、翻译、一般代谢、能量代谢和应激反应[35]。
Broadbent等[47]对乳酸乳球菌MM160进行冷胁迫处理,然后通过2D-聚丙烯酰胺凝胶电泳分析35S标记蛋白来表征乳酸乳球菌的冷胁迫反应。放射自显影结果显示,在L.lactisMM160中,在10 ℃下的最初30 min内,至少诱导了8种蛋白质。用L.lactisMM210进行的类似实验表明,冷胁迫诱导了大约15个Csps。L.lactisMM160和MM210的时间进程标记实验显示,温度降低后,其他蛋白质的表达缓慢恢复,但即使在10 ℃下4 h后,在两株乳球菌中,合成的蛋白质主要是Csp。进一步分析发现,冷胁迫后的乳酸乳球菌细胞中含有更低的饱和脂肪酸与不饱和脂肪酸的比率。
Kim等[48]研究了冷胁迫对瑞士乳杆菌(L.helveticus)LB1、戊糖片球菌(P.pentosaceus)PO2、嗜热链球菌(S.thermophilus)TS2以及乳酸乳球菌乳酸亚种(L.lactissubsp.lactis)M392、M474、M712和乳酸乳球菌乳脂亚种(L. lactissubsp.cremoris)M126、M149、M179的冷冻耐受性的诱导作用。结果表明,当乳酸菌培养物在-20 ℃冷冻24 h后,除L.lactisM712(存活率50%)外,其它菌株的存活率都非常低。其中L.cremorisM179,只有1%的细胞存活。然而,当培养物在冷冻前经过10 ℃冷应激2 h后,在测试的菌株中,来自乳酸乳球菌乳酸亚种的菌株和戊糖片球菌PO2的存活率都显著提高,其中L.lactisM474的增幅最大,存活率由30%增加至67%。而这种效应在被测试的乳酸乳球菌乳脂亚种、L.helveticusLB1及S.thermophilusTS2中未出现。采用针对Escherichia coli及Bacillus subtilis中编码主要休克蛋白的基因的简并引物进行PCR,在所有被测试的菌株中都检测到扩增产物。对L.lactisM474的扩增产物进行克隆和测序后所推导出的蛋白质的氨基酸序列与其它已知的冷休克蛋白具有高度的相似性。利用针对L.lactisM474冷休克蛋白编码基因的引物对其它被测试的菌株进行扩增,仅在乳球菌中发现了PCR产物,而L.helveticus,S.thermophilus或P.pentosaceus中未观察到扩增产物。因此,不同乳酸菌冷休克蛋白的基因在序列上存在一定的差异,这种差异导致其宿主对冷胁迫出现不同的表现。还需要进一步对冷休克蛋白结构与抗冷冻作用之间的关联性予以更深入的研究。
2.4 相容性溶质
Tribelli等[18]报道了细菌与冷适应有关的典型特征,包括酶结构的调整、相容性溶质(compatible solutes)的合成等。在低温环境下,乳酸菌也会合成相容性溶质,例如海藻糖和甘氨酸。相容性溶质不仅能在低温环境下为微生物细胞提供渗透保护和冷冻保护,还可作为碳源、氮源和能源。研究较多的相容性溶质有甘氨酸、甜菜碱、甘油、海藻糖、蔗糖、甘露醇和山梨醇,它们能降低细胞质的冰点,防止大分子聚集、清除自由基和稳定细胞膜,从而使微生物适应低温环境。更重要的是,相容性溶质还能降低细胞内胶体的玻璃化转变温度[49]。最近的一项研究显示,添加甘油后,细菌细胞细胞质的玻璃化转变温度降低了30 ℃,解冻后的存活率也有所提高[49]。Li等[50]发现,与其它冷冻保护剂相比,在冷冻干燥过程中添加10%的海藻糖能更好地保持罗伊氏乳杆菌CICC6226细胞膜的完整性和流动性。由此可知,除了自身合成外,乳酸菌还可从外部环境中吸收以积累相容性溶质。由于不同乳酸菌转运相容性溶质的能力可能存在差异,因此对不同种类乳酸菌转运相容性溶质的机制进行研究,也可为判断乳酸菌的抗冷胁迫能力提供新的思路。
3 乳酸菌抗冷胁迫作用的表征
3.1 气相色谱-质谱法
3.2 液质联用
首先将乳酸菌接种于合适的培养基中,培养至对数期,然后进行冷休克处理,按Lindae等[51]的方法提取菌体蛋白质。先通过双向电泳找出差异表达的蛋白质,将差异蛋白点用胰蛋白酶消化,再通过LC-MS对差异蛋白进行质谱鉴定,以确定冷休克蛋白的表达。Chen等[52]对Lactobacillus kefiranofaciensM1进行冷休克处理,然后分析冷休克前后菌株的蛋白表达差异,结果发现经冷休克后的Lactobacillus kefiranofaciensM1有21个蛋白点表达水平发生变化。采用LC-MS对这些差异蛋白点进行鉴定,鉴定出了伴侣蛋白DnaK、GroEL等。
3.3 基质辅助激光解析飞行时间质谱
冷休克蛋白的测定还可采用Maldi-TOF MS方法进行。提取乳酸菌的菌体蛋白质先进行双向电泳(2-DE),从2-DE凝胶中将差异表达的蛋白斑点片段手动切除,然后通过Maldi-TOF MS进行质谱鉴定。Song等[26]通过Maldi-TOF MS对一株植物乳杆菌L67在冷胁迫下的差异表达蛋白进行鉴定,有24种蛋白质表达增强,13种蛋白质被鉴定,其中2种蛋白质与泛酸激酶和合成酶有关。13种被鉴定的蛋白质分为六类:能量代谢、细胞生长、未知功能、信号转导、应激反应和转录。
3.4 细胞活性分析
细胞活性分析包括活菌计数、酸化能力测定和乳酸脱氢酶活性测定。通常采用选择性平板计数法测定经过冷冻处理后乳酸菌培养物中的活菌数。将样品进行稀释,取合适稀释倍数的稀释液接种在MRS固体培养基中,48 h进行计数[13]。乳酸菌培养物在冷冻前后和储存期间酸化能力的变化也是衡量其抗冷冻协作用的重要表征,Fonseca等[53]采用Cinac系统测定了经过不同处理的乳酸菌的酸化能力,将细菌悬浮液接种于脱脂乳中,连续测定脱脂乳的pH直到酸化结束,以pH变化对时间的导数代表酸化速率。对于不同的乳酸菌样品,达到在脱脂乳中最大酸化速率所需的时间tm(以min为单位)能够表征细胞经过冷胁迫后的活力。tm越高,潜伏期越长,酸化活性越低[38]。乳酸脱氢酶(LDH)可催化乳酸转化为丙酮酸,这是乳酸菌细胞产生能量的重要一步[20]。细胞中LDH的活性在冷冻或冷冻干燥后会降低,因此可以通过该酶活性判断细胞受损情况。其活性测定通常采用比色法,通过NADH在340 nm处的吸收减少来确定[20]。
4 总结与展望
在低温下,乳酸菌会通过改变细胞膜脂肪酸组成、产生冷休克蛋白及产生相容性溶质等来适应环境,以保持良好的活性。关于乳酸菌抗冷胁迫的研究仍存在不足之处,包括:a.冷休克蛋白与低温耐受性的确切构效关系;b.同种内不同菌株之间由遗传导致的细胞膜差异与冷胁迫诱导产生的膜脂组成差异对细胞抗冷冻性能影响的程度;c.冷休克蛋白对膜脂合成的调节作用。这些问题需要通过对与不饱和脂肪酸、冷休克蛋白等合成相关基因的编辑(敲除、沉默和定向突变)予以进一步的阐明。此外,冷休克蛋白自身结构的特点如何保证其在低温下发挥活性也值得关注。因此,未来可以开展以下几方面的工作:a.从基因组学的角度出发,对脂肪酸合成的相关基因进行敲除,深入探究不同菌株抗冻性强弱与遗传基因之间的关系;b.结合蛋白组学和基因组学,探究冷休克蛋白对膜脂组成的调节作用,即对冷休克蛋白的代谢通路进行分析,通过相关基因的编辑来研究冷休克蛋白与膜脂组成之间的关联;c.由于乳酸菌转运相容性溶质的能力可能存在差异,因此后续的研究中还可对不同乳酸菌转运相容性溶质的机制进行研究,这可为研究乳酸菌的抗冷胁迫作用提供新的借鉴。
