术前预测胰腺癌分化程度的临床-影像组学模型的建立和验证
2022-03-06吴雅蔚费孝静侯锦路叶德华
刘 敏,周 倩,吴雅蔚,臧 秀,费孝静,侯锦路,叶德华
1. 盱眙县人民医院影像科,江苏 淮安 223000;
2. 无锡市锡山人民医院鹅湖分院消化内科,江苏 无锡 214000;
3. 盐城市第一人民医院影像科,江苏 盐城 224000
胰腺癌是常见的腹部肿瘤,恶性程度极高,5年生存率仅约7%[1]。既往文献[2]报告,准确评估胰腺癌的恶性程度,对于手术切除前评估和改善生存率及预后有积极的作用。肿瘤的恶性程度与肿瘤细胞的分化程度息息相关。因此,术前准确地预测胰腺癌分化程度对于胰腺癌患者的肿瘤恶性程度评估及肿瘤分期、治疗、预后都至关重要。计算机体层成像(computed tomography,CT)是术前评估胰腺癌患者首选的影像学方法[3-5],但CT检查有其局限性,无法对胰腺癌的分化程度进行判定。因此,需要更智能、更敏感的诊断技术,以期实现术前判定胰腺癌分化程度。近年来,基于大数据的影像组学研究已成为一个蓬勃发展的研究方向[6-9]。现有的研究[10-11]结果表明,影像组学在预测胰腺癌良恶性方面具有一定的可行性。沈力等[12]建立了一个术前评估胰腺癌恶性程度的预测模型,成功地在不同分化程度的胰腺癌中实现恶性程度的评估,但是并没有结合经典的临床指标。因此,本研究对肿瘤标志物和影像组学进行结合和分析,尝试建立并验证一种用于术前个体化预测胰腺癌分化程度的临床-影像组学模型,以辅助临床决策。
1 资料和方法
1.1 临床资料
回顾并分析2010年9月—2019年12月江苏省盱眙县人民医院经术后病理学检查证实的胰腺癌患者资料。纳入标准:① 经术后病理学检查证实为胰腺癌并伴有明确的病理学分级;② 术前接受腹部增强CT检查,并有完整的CT增强扫描图像;③ 完整的临床资料。排除标准:① 患者术前曾接受放化疗;② 患者有其他肿瘤性疾病;③ 图像伪影大,不能达到分析标准。最终,共56例患者的临床和CT资料纳入分析,其中男性38例,女性18例,年龄45~78岁,平均年龄(61.5±10.3)岁。依据术后病理学检查结果将患者分为高分化组(29例)和中低分化组(27例)。依据入组时间先后,分为训练组39例(70%)及验证组17例(30%)。其中训练组高分化21例,中低分化18例;验证组高分化8例,中低分化9例。
采集全部患者的血清标本,采用化学发光免疫法对其糖类抗原(carbohydrate antigen,CA)19-9等项目进行检测。CA19-9正常范围为0~30 U/mL,本实验收集的患者CA19-9为(202.45±45.61)U/mL。
1.2 扫描方法
56例患者均在治疗前进行了CT增强检查。采用德国Siemens公司的SOMATOM Definition Flash 64排双源CT机,扫描范围自膈顶至盆腔。嘱咐患者在CT增强扫描前8 h禁食,于扫描前饮用1 000 mL水。CT增强扫描采用的对比剂为碘海醇(1.5 mL/kg),于患者前臂静脉采用高压注射器以2.5~3.5 mL/s的速率团注,造影剂注射量为80~100 mL。分别于注射对比剂之后25~30和60~70 s采集动脉期和门静脉期图像。扫描参数:管电压120 kV,参考管电流250 mA,扫描层厚为5 mm,对扫描图像行薄层1.25 mm重建,用于后续图像处理。
1.3 图像处理
在影像存储与传输系统(picture archiving and communication system,PACS)工作站将门静脉期CT图像导出,并转换成Bmp格式保存。将所有CT图像重建像素为512×512的图像矩阵。使用软件MaZda对图像进行纹理分析,使用软件中的感兴趣区(region of interest,ROI)编辑器沿病灶周围手动勾勒ROI,通过调整使ROI覆盖完整病灶,随后计算出病变区的特征[13-14]。本实验对采集的所有CT图像灰阶进行标准化设定,图像灰阶范围在[μ-3δ,μ+3δ]中(μ为平均灰度值,δ为标准差)[15]。图像定性评估由2名放射科医师(均有5年以上影像学诊断工作经验)完成。若2名医师图像评估存在分歧,则与另一名高年资放射科医师(有10年以上影像学诊断经验)讨论后达成一致意见。
1.4 纹理特征提取与筛选
提取的特征分别为直方图(histogram)、灰度共生矩阵(gray-level co-occurrence matrix,GLCM)、游程矩阵(run-length matrix,RLM)、绝对梯度(absolute gradient,GRA)、自回归模型(auto-regressive model,ARM)和小波变换(wavelet transform,WT),共计6大类279个纹理特征(表1)。大量的组学特征将加大运算量,故本实验采用软件内置的3种特征提取方法[交互信息提取(mutual information,MI)、Fisher系数提取(fisher coefficient,Fisher)和分类错误概率联合平均相关系数提取(classification error probability combined with average correlation coefficients,POE+ACC)]对特征进行筛选,3种提取方法分别提取10个最有意义的特征,共计30个特征。首先对30个特征进行整合,去除重复性特征。然后,因为不同变量之间存在多重复杂性,研究[16]证实变量间相关性过大(|r|>0.6)将影响模型的稳定性,故本实验删去|r|>0.6的特征。

表1 采用3种特征提取方法所提取的重要特征
1.5 统计学处理
本研究以术后病理学检查结果为金标准进行分级,采用SPSS 20.0统计软件和R语言软件对数据进行分析。使用基于R语言的软件包用于进一步的统计学分析,分别为用于可视化的ggplot2和corrplot软件包,以及用于受试者工作特征(receiver operating characteristic,ROC)曲线分析的pROC软件包。对所得特征行正态性检验,符合正态分布采用组内独立样本t检验,不符合正态分布采用Mann-WhitneyU检验,并对差异有统计学意义的特征进行ROC曲线分析。本研究数据以±s表示,P<0.05为差异有统计学意义。
2 结 果
2.1 影像组学特征筛选
应用软件自带特征提取法共提取30个特征,并去除重复的特征,剩余合计23个特征(表1)。对剩余的23个组学特征进行相关性分析(图1),将相关性|r|>0.6的特征删去。最终获得6个特征见表2。
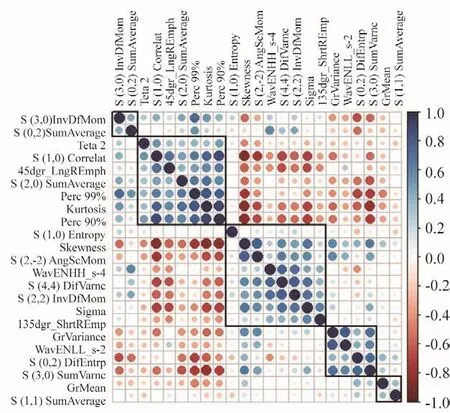
图1 23个重要的组学特征的自相关性和交叉相关性相关图
正态性检验结果:S(3,0)lnvDfMom不遵循正态分布,其余均遵循正态分布。进一步统计分析发现,两组间Teta2和S(1,0)Entrop差异有统计学意义(P<0.05)。而两组间S(3,0)lnvDfMom、S(2,0)SumAverage、S(1,1)SumAverage及GrMean差异均无统计学意义(P>0.05,表2)。

表2 胰腺癌恶性程度的组学特征比较
2.2 模型建立
ROC曲线分析显示(图2),以S(1,0)Entropy=1 258.87为阈值时,其鉴别胰腺癌恶性程度的效能最优(AUC为0.70,灵敏度为83.33%,特异度为61.90%)。而以Teta2=0.36为阈值时,AUC达到最大(AUC=0.68),灵敏度和特异度分别为83.33%和57.14%。联合特征Teta2+S(1,0)Entropy时AUC为0.74,灵敏度83.33%,特异度71.43%。联合肿瘤标志物CA19-9时AUC为0.82,其对应的灵敏度和特异度分别为72.22%和85.71%。
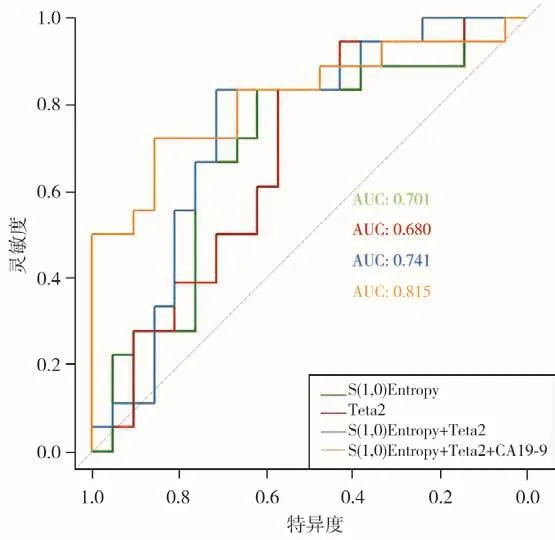
图2 鉴别胰腺癌分化程度的ROC曲线
2.3 独立队列验证
在验证组中,从训练队列中筛选出的纹理特征[Teta2和S(1,0)Entropy]联合CA19-9后,AUC为0.78,灵敏度为66.67%,特异度为80.95%。
3 讨 论
本研究发现Teta2和S(1,0)Entropy在鉴别胰腺癌恶性程度方面显示出一定的价值,且这两个影像组学特征联合可以获得较单一特征更优的鉴别能力。本实验在此基础上,还加入了胰腺癌的经典血清学指标CA19-9,结果显示影像组学+血清学指标的诊断模型具有更好的诊断效能。本研究结果表明,临床-影像组学诊断模型有潜力作为术前预测胰腺癌分化程度的临床工具。
本研究提取共计279个特征,采用多种方法对特征进行降维,最终发现特征Teta2和S(1,0)Entropy在两组间差异有统计学意义。S(1,0)Entropy描述病灶内的紊乱程度,代表肿瘤的异质性。于浩鹏等[17]发现熵(GLCMEntropy_AllDirection_offset7_SD)在胰腺神经内分泌肿瘤的病理学分级中同样差异有统计学意义,AUC为0.715。而Teta2则是一个来自自回归模型的高阶特征,可提供关于相邻像素之间相对于其灰度值的局部交互的信息。张永嫦等[18]通过对乏血供胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasm,pNEN)和胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)的CT图像进行纹理分析,证实了纹理特征Teta2具有较高的诊断效能。上述文献皆与本研究结论相一致。
本研究建立了一种用于术前个体化预测胰腺癌分化程度的临床-影像组学模型,该模型由肿瘤指标(CA19-9)和影像组学特征构成。既往基于影像组学或纹理分析对胰腺癌的分级研究已经获得了较为丰富的成果。Choi等[19]基于CT增强扫描采用纹理分析对pNEN进行分级鉴别,证明低球度、高偏度、低峰度等CT纹理特征在诊断2/3级pNEN时较常规的影像学指标更有诊断优势。D’Onofrio等[20]基于CT三围纹理特征对pNEN进行分级鉴别诊断,结果表明峰度和熵这两种特征可以大大提高对pNEN的鉴别准确度。上述研究均基于单纯的影像学建立诊断模型,并未结合临床指标。而本研究的临床-影像组学模型尝试实现对患者的个体化预测,这符合当前个体化精准医疗的趋势。
本实验的挑战之一是对大量冗杂可用特征进行筛选,事实上过多的特征不仅增加运算量还会增加获取重要特征的难度。首先通过软件自带的3种降维方法挑选出30个重要特征,并去除重复的特征,剩余23个。文献[21]报告不同特征之间存在多重复杂性,因此再进行共线性检查去除|r|>0.6的高共线性特征。与传统的单一降维方法相比,多步骤联合的降维方法有更好的可视化效果,且创新性地将传统降维方法与统计学方法结合,以得到更好的降维效果[22]。
本实验存在一定的局限性:① 本研究由两个相对较小的样本量队列组成。虽然影像组学的诊断性能是在一个相对独立的队列中被重复,但本研究中所做的观察需要在更大的样本量的研究中被复制;② 不同的CT参数对组学特征的影响还有待进一步探索;③ 胰腺癌ROI的勾画采用手动勾画,后续研究将采取结合深度学习的方法实现自动化分割;④ 本研究结果来自于单一机构,因此需要多中心研究以明确模型的通用性。
综上所述,本研究建立了一个联合临床经典指标和影像组学特征的临床-影像组学诊断模型,可作为术前个体化无创性预测胰腺癌恶性程度的临床工具,有助于作出胰腺癌精准治疗的决策。
