α-淀粉酶降低青稞快消化淀粉含量工艺优化
2022-03-05宋晓凡孙康娜院珍珍
张 花 宋晓凡 李 岩 孙康娜 院珍珍
(青海大学农牧学院,青海 西宁 810016)
青稞(HordeumvulgareL. var.nudumHook. f.)俗称裸大麦[1],是大麦的变种,属于禾本科植物,作为青藏高原的一种重要谷物,具有高蛋白、高纤维、高维生素和低脂肪、低糖的特性,并且富含β-葡聚糖等功能因子,具有很好的营养功能[2-3],对预防心血管疾病、糖尿病等有显著作用[4-6]。淀粉按其在人体内的消化程度和速度,可分为快消化淀粉(RDS)、慢消化淀粉(SDS)和抗性淀粉(RS)3种类型[6-7]。研究[8-10]表明,青稞中的慢消化淀粉能够缓慢释放能量,可以保证饭后血糖的相对稳定,避免造成大幅度的波动引起血糖过高和过低的现象,有益于高血压、糖尿病和肥胖患者病情调控。
目前,有关青稞淀粉的研究多集中在其提取与不同来源青稞淀粉的理化性能对比上,对青稞淀粉改性和结构分析方面的研究较少,也缺乏对其进一步的应用潜能进行探索的理论依据。为探索青稞淀粉特性并改善其消化性能,研究拟以青稞为原料,采用酶解法降低青稞快消化淀粉含量,通过响应面优化试验及α-淀粉酶和α-葡萄糖苷酶的活性确定酶法降低快消化淀粉含量的最适条件[11-13],旨在提高和增加青稞的附加值,为青稞高附加值产品研究提供依据。
1 材料与方法
1.1 材料与试剂
萌芽黑青稞粉:青海汉和生物科技股份有限公司;
高温α-淀粉酶:2万U/mL,上海源叶生物科技有限公司;
糖化酶:10万U/mL,江苏锐阳生物科技有限公司;
猪胰α-淀粉酶:45.5万U/g,合肥博美生物科技有限责任公司;
苯酚:分析纯,天津市致远化学试剂有限公司;
3,5-二硝基水杨酸:分析纯,上海展云化工有限公司;
酒石酸钾钠、氢氧化钠:分析纯,天津市河东区红岩试剂厂。
1.2 仪器与设备
冷冻离心机:LR10M型,湖南赫西仪器装备有限公司;
恒温振荡器:THZ-82型,国华企业集团有限公司;
台式高速离心机:H/T16MM型,湖南赫西仪器装备有限公司;
紫外可见分光光度计:UV-1780型,岛津仪器(苏州)有限公司。
1.3 试验方法
1.3.1 技术路线
青稞粉→酶解→灭酶→水洗离心→收集固体→烘干→粉碎→体外模拟消化→低快消化淀粉青稞粉
1.3.2 操作要点
(1) 酶解液配制:取一定单位的酶液用蒸馏水定容至100 mL。
(2) 酶解:加酶量以每克青稞粉中加入的酶单位计,加入酶解液震荡摇匀,放入恒温振荡水浴锅(35~75 ℃)中以140 r/min的转速恒温振荡酶解。
(3) 灭酶:沸水浴20 min。
(4) 离心、烘干:酶解结束后,20 ℃下,4 500 r/min离心,沉淀用蒸馏水洗涤至上清液无色(洗涤2~3次),收集固体于45 ℃烘干。
1.3.3 单因素试验 取适量青稞粉,以快消化淀粉含量为指标,选用α-淀粉酶添加量为50,100,150,200,250 U/g,酶解温度为35,45,55,65,75 ℃,酶解时间为1,2,3,4,5 h,料液比为1∶5,1∶10,1∶15,1∶20,1∶25 (g/mL)。考察一种因素时,固定其他参数条件为α-淀粉酶添加量150 U/g、酶解温度65 ℃、酶解时间2 h、料液比1∶10 (g/mL)。
1.3.4 响应面试验 在单因素试验基础上,选取α-淀粉酶添加量、料液比、酶解时间和酶解温度为响应因素,以快消化淀粉含量为响应值,采用Design-Expert 8.0.6软件进行四因素三水平的响应面试验以优化α-淀粉酶酶解工艺,平行3次。
1.3.5 RDS、SDS、RS含量测定 参照Englyst等[14]的方法并稍作修改。取0.2 g样品,加入9 mL蒸馏水,漩涡震荡5 min,沸水浴30 min,期间晃动试管以防结块,自然冷却至室温。向试管中加入3个玻璃珠、1 mL乙酸钠缓冲液(1 mol/L,pH 5.2)及5 mL酶溶液,37 ℃水浴震荡酶解,分别在20,120 min时吸取5 mL样品,沸水浴灭酶20 min, 4 500 r/min离心15 min,取1 mL上清液,分别加入2 mL蒸馏水和DNS于沸水浴中显色5 min,流水冷却后加入7 mL蒸馏水,摇匀,测定540 nm处紫外吸收值。标准曲线方程为Y=1.148 5X-0.023 7,R2=0.996 4,并分别按式(1)~式(3)计算RDS、SDS、RS含量。
(1)
(2)
RRS=mTS-RRDS-RSDS,
(3)
式中:
RRDS——RDS 含量,%;
RSDS——SDS 含量,%;
RRS——RS 含量,%;
m0——水解0 min后样品中葡萄糖质量,mg;
m20——水解20 min后样品中葡萄糖质量,mg;
m120——水解120 min后样品中葡萄糖质量,mg;
mTS——样品中总淀粉质量,mg。
1.3.6 总淀粉含量测定 采用淀粉含量检测试剂盒法测定。标准曲线方程为Y=0.451X-0.451 3,R2=0.994 8,并按式(4)计算总淀粉含量。
(4)
式中:
Y′——总淀粉含量,mg/g;
X′——测得的吸光度对应标准曲线的浓度,mg/mL;
n——稀释倍数,1 000;
V——提取后总体积,mL;
W——青稞粉质量,g。
1.3.7α-葡萄糖苷酶抑制率测定 取0.05 mol/L PBS缓冲液(pH 6.8) 600 μL,滴加300 μL PNPG (20 mmol/L)溶液和40 μL样品,37 ℃水浴酶解20 min,滴加200 μL 0.2 U/mL 的α-葡萄糖苷酶溶液,室温反应10 min,加入2 mL 0.1 mol/L的Na2CO3终止反应,3 000 r/min离心10 min,吸取200 μL上清液于96孔板中,用酶标仪测定405 nm处吸光值。空白对照为pH 6.8、0.05 mol/L的PBS溶液。按式(5)计算α-葡萄糖苷酶抑制率[15]。
(5)
式中:
M——α-葡萄糖苷酶抑制率,%;
a——含有α-葡萄糖苷酶溶液不含样品的吸光值;
b——不含α-葡萄糖苷酶溶液和待测样品的吸光值;
c——含有α-葡萄糖苷酶溶液和待测样品的吸光值;
d——不含α-葡萄糖苷酶溶液和含待测样品的吸光值。
1.3.8α-淀粉酶抑制率测定 分别取150 μL样品液和150 μL 0.5 mg/mL的α-淀粉酶液,混匀,37 ℃孵育10 min,加入250 μL质量分数为1%的可溶性淀粉溶液,37 ℃孵育10 min,加入500 μL DNS终止反应,沸水浴5 min。冷却后取200 μL于96孔板中,使用酶标仪测定540 nm处吸光度,按式(6)计算α-淀粉酶抑制率。
(6)
式中:
N——α-淀粉酶抑制率,%;
a——含有α-葡萄糖苷酶溶液不含样品的吸光值;
c——含有α-葡萄糖苷酶溶液和待测样品的吸光值;
d——不含α-葡萄糖苷酶溶液和含待测样品的吸光值。
2 结果与分析
2.1 单因素试验
2.1.1α-淀粉酶添加量对RDS含量的影响 由图1可知,酶解初始阶段快消化淀粉含量随α-淀粉酶添加量的增加而减小,当α-淀粉酶添加量为150 U/g时,快消化淀粉含量最低为15.4%。继续增加α-淀粉酶添加量,快消化淀粉含量逐渐增加,可能是由于酶解产物的积累对酶解反应的反向抑制作用。因此,确定α-淀粉酶的最适添加量为150 U/g。
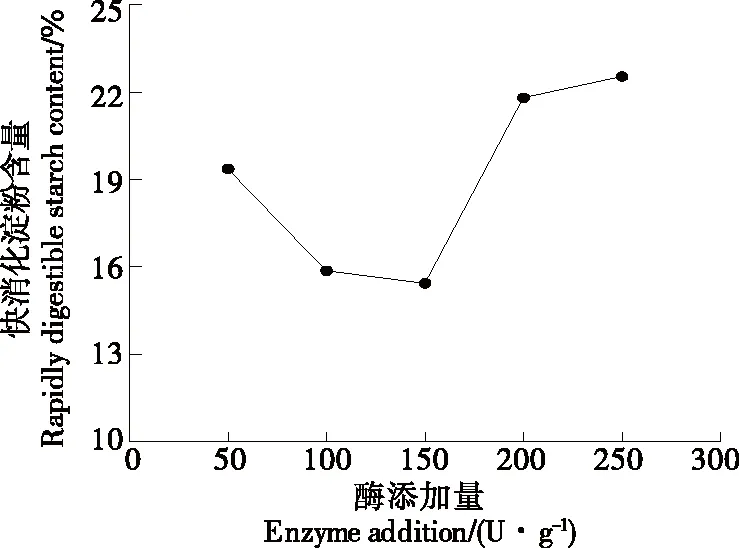
图1 α-淀粉酶添加量对RDS含量的影响
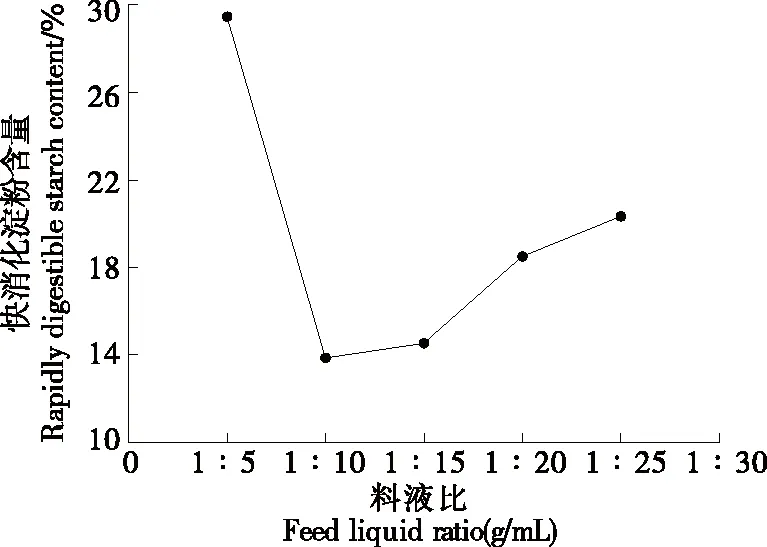
图2 料液比对RDS含量的影响
2.1.2 料液比对RDS含量的影响 由图2可知,随着青稞粉质量浓度的降低,青稞中快消化淀粉含量随之降低,当料液比为1∶10 (g/mL)时,其含量达到最低(13.9%)。随着青稞粉质量浓度的进一步降低,快消化淀粉含量升高,可能是由于料液比过小时,溶液中的酶浓度较低,从而导致酶与淀粉的接触几率下降;当料液比较大时,酶与淀粉之间的流动性较低,不易酶解,快消化淀粉含量降低较少。因此,确定最适料液比为1∶10 (g/mL)。
2.1.3 酶解时间对RDS含量的影响 由图3可知,快消化淀粉含量随酶解时间的延长不断减小,当酶解时间为2 h时,快消化淀粉含量最低为8.7%。继续延长酶解时间,支链淀粉含量减少、小分子淀粉含量上升,使得快消化淀粉含量增加。因此,确定α-淀粉酶的适宜酶解时间为2 h。
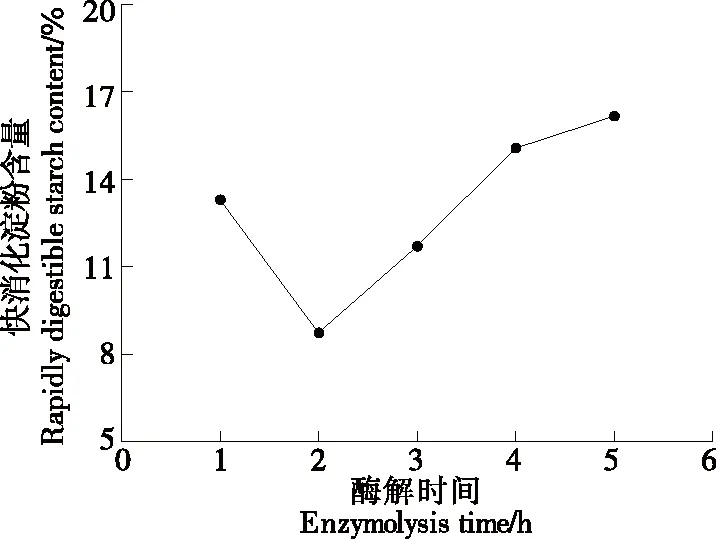
图3 酶解时间对RDS含量的影响
2.1.4 酶解温度对RDS含量的影响 由图4可知,当酶解温度<65 ℃时,随着酶解温度的升高,青稞快消化淀粉含量降低,当酶解温度为65 ℃时,快消化淀粉含量最低为8.9%,超出此温度范围后,随着酶解温度的升高,快消化淀粉含量升高,可能是因为温度过高导致了淀粉的降解。因此,α-淀粉酶的适宜酶解温度为65 ℃。
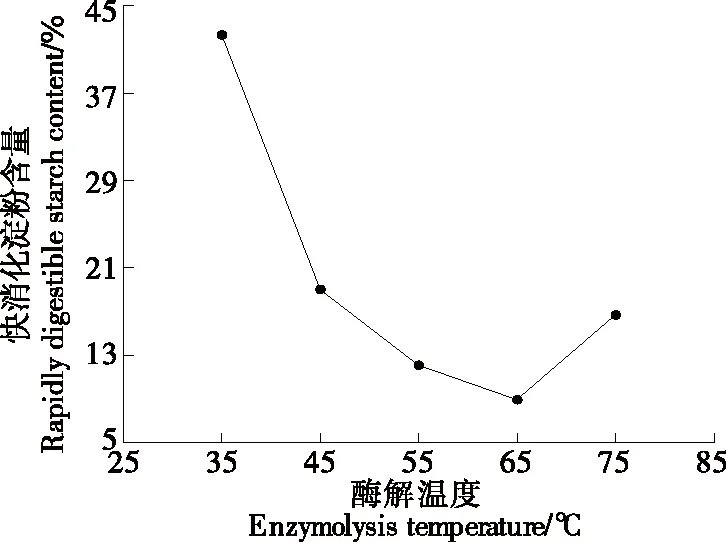
图4 酶解温度对RDS含量的影响
2.2 响应面试验
2.2.1 响应面试验设计及结果 单因素试验选择的水平范围见表1,试验设计及结果见表2。
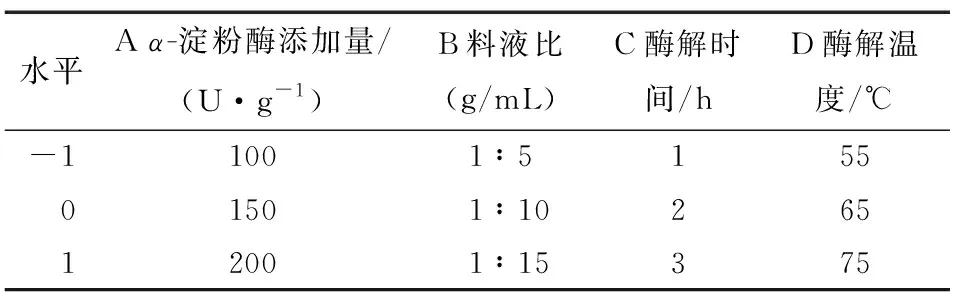
表1 响应面试验因素水平设计表
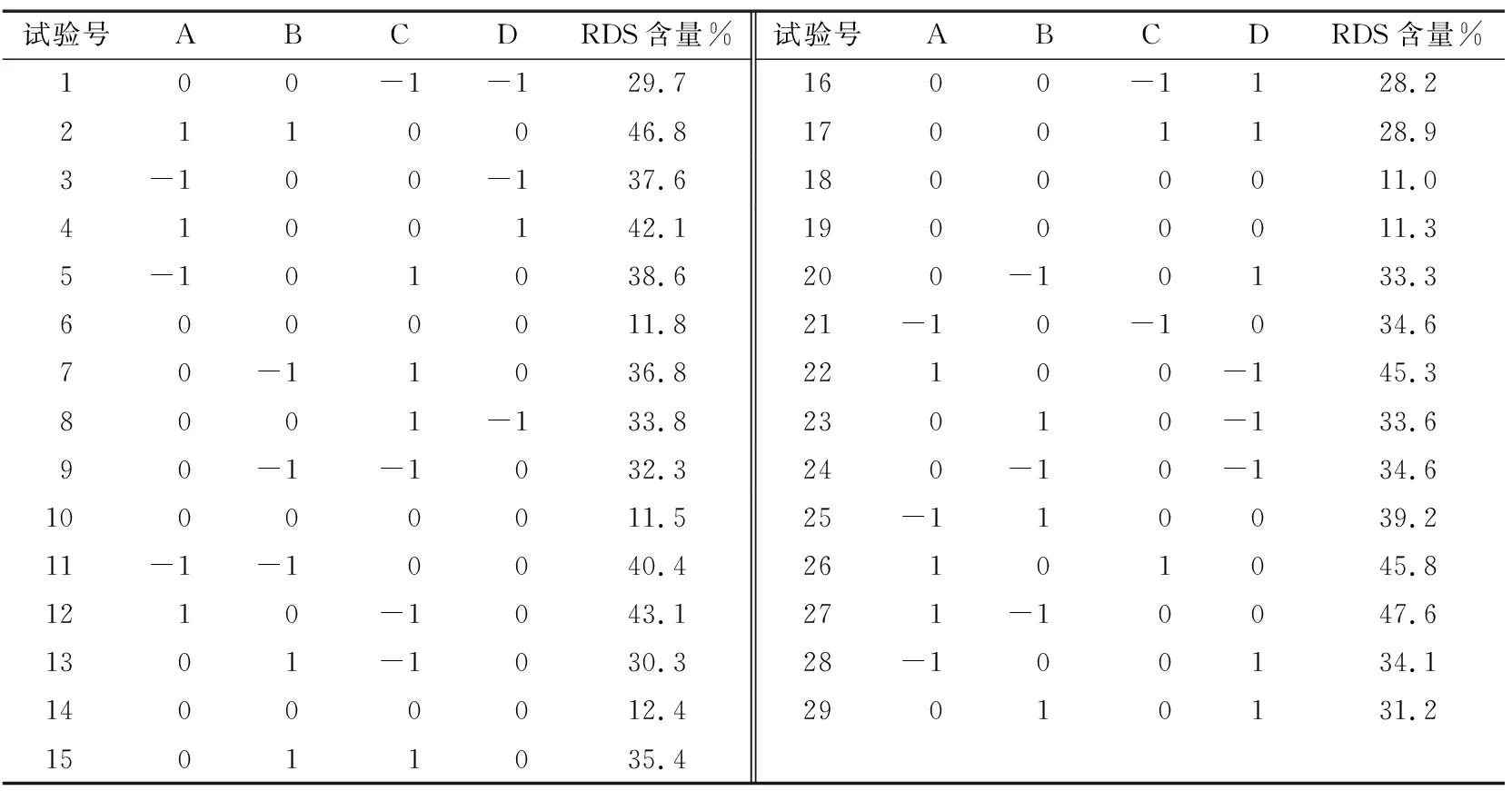
表2 响应面试验设计及结果
2.2.2 回归模型的建立与显著性分析 通过Box-Behnken试验对RDS含量进行多元线性回归拟合,得方程:
Y=11.59+3.85A-0.71B+1.76C-1.40D+0.10AB-0.33AC+0.075AD+0.15BC-0.27BD-0.85CD+19.30A2+12.59B2+9.59B2+8.95D2。
(7)
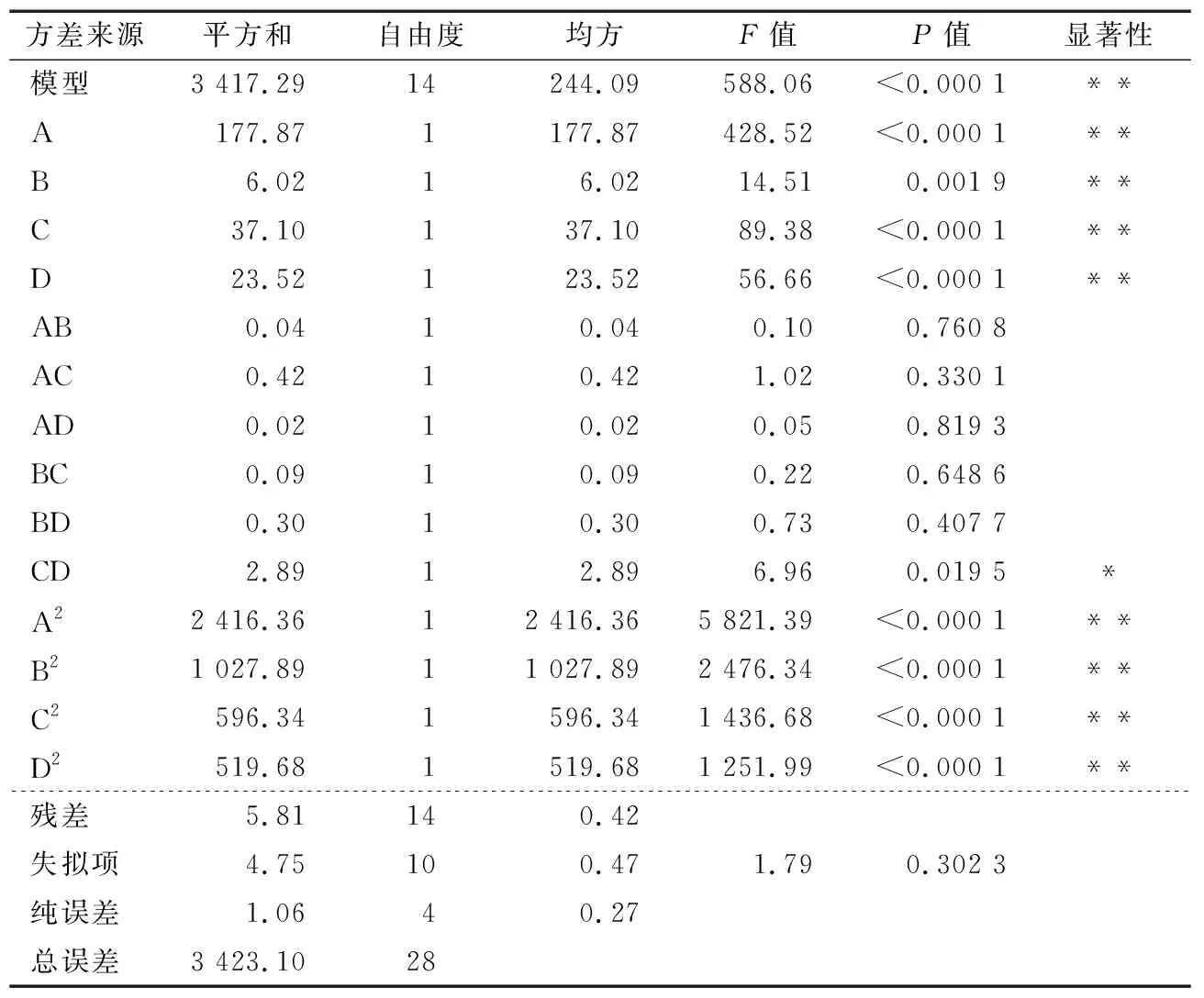
表3 方差分析表†
2.2.3 交互作用分析 由图5可知,酶解时间和酶解温度之间的交互作用对RDS含量影响最为显著。α-淀粉酶添加量和酶解时间、料液比和酶解温度、料液比和酶解时间之间的交互作用的曲线平滑,显著性差异较小;α-淀粉酶添加量和酶解温度之间的交互作用显著性最低。4个因素对青稞中RDS含量的影响均呈先降低后上升的趋势,且在4个因素所设定的范围内均存在最高值,CD、AC、BD的交互作用比BC、AB、AD的更为密集,说明RDS含量的显著性顺序为CD>AC>BD>BC>AB>AD,与方差分析结果相同。
2.2.4 验证实验 由Design-Expert软件分析得到黑青稞中降低RDS含量的最优工艺条件为α-淀粉酶添加量150 U/g、料液比为1∶10 (g/mL)、酶解温度为65 ℃、酶解时间为2 h,此时RDS含量为13.0%。为进一步验证实验结果的可靠及真实性,对酶解条件进行3次平行试验,测得RDS含量为13.7%,与预测值相差不大,说明建立的模型可靠。

图5 各因素交互作用对RDS含量的影响
2.2.5 降糖活性 由图6可知,与原粉相比,α-淀粉酶和α-葡萄糖苷酶的抑制率分别增加了52.7%和34.4%,可能是由于经过处理后的青稞淀粉结构发生了变化,减少了与消化酶的接触[16-17],从而使其抑制率得以增加,即青稞淀粉的体外降糖活性得到明显提高。并且由于淀粉等碳水化合物进入人体后,需在α-淀粉酶和α-葡萄糖苷酶的共同作用下分解为单糖后才能被人体小肠吸收,因此抑制α-淀粉酶和α-葡萄糖苷酶的活性可以抑制餐后血糖的升高。
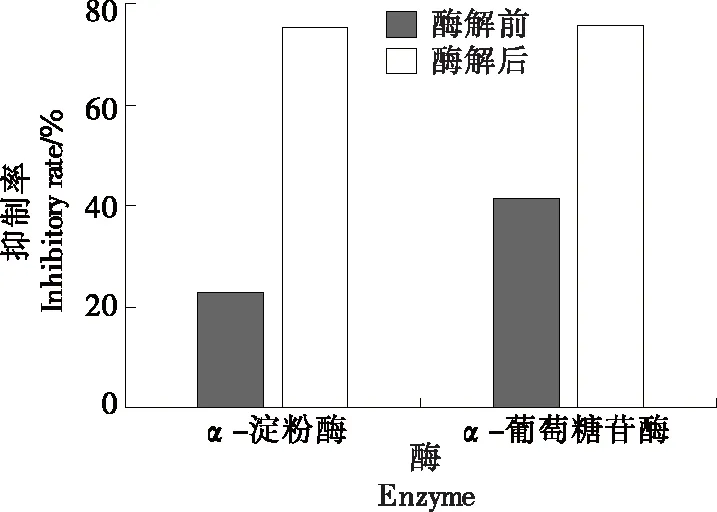
图6 α-淀粉酶和α-葡萄糖苷酶的抑制率
3 结论
采用响应面试验优化α-淀粉酶降低青稞快消化淀粉含量的工艺条件,最终筛选出了最佳酶解条件为α-淀粉酶添加量150 U/g、料液比1∶10 (g/mL)、酶解时间2 h、酶解温度65 ℃。此条件下快消化淀粉含量为11.6%,慢消化淀粉含量为13.0%,抗性淀粉含量为75.4%,α-葡萄糖苷酶抑制率为75.86%,α-淀粉酶抑制率为75.54%。酶解前后,快消化淀粉含量下降了50.8%,慢消化淀粉含量升高了10.4%,抗性淀粉含量升高了40.4%,α-葡萄糖苷酶和α-淀粉酶抑制率分别升高了34.4%和52.7%,说明α-淀粉酶改善了淀粉的消化性能。后续可对酶解后青稞淀粉的理化性质进行深入研究。
