Wenyingzhuangia属海洋细菌产β-紫菜多糖酶的克隆表达及性质研究
2022-03-04冯瑞方张玉莹申晶晶常耀光
冯瑞方, 张玉莹, 申晶晶, 常耀光,2*
(1 中国海洋大学食品科学与工程学院 山东青岛266003 2 青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室 山东青岛266237)
紫菜是一种大型经济海藻, 目前中国紫菜栽培产业年产量达11.4 万t[1],居世界首位。 紫菜多糖是紫菜的主要组成部分, 约占紫菜干重的40%[2]。 其存在于紫菜细胞壁及细胞间隙中[3],由(1→3)-O-β-D-吡喃半乳糖残基(G 残基)及(1→4)-O-α-L-吡喃半乳糖-6-硫酸基残基 (L6S 残基)交替组成[4]。 研究表明,紫菜多糖、低分子质量紫菜多糖及紫菜寡糖具有多种生物活性, 如清除活性氧自由基[5],抗神经炎症[6],抑制癌细胞生长[7]等,是潜在的功能食品的功能因子。
酶法降解相比物理法和化学法, 具有反应条件温和、特异性强等特点,是制备低分子质量降解产物及寡糖的重要手段。 紫菜多糖酶是一类糖苷水解酶, 可特异性识别和降解紫菜多糖中的糖苷键。 目前报道的序列仅有5 条,均为β-紫菜多糖酶, 催化紫菜多糖结构中β-1,4 糖苷键的断裂[4]。由法国团队发表的来源于海洋细菌Zobellia galactanivorans 中的PorA 和PorB[4]是最早被报道的紫菜多糖酶, 且该团队于人类肠道细菌Bacteroides plebeius 中挖掘到紫菜多糖酶BpGH16B和BpGH86A[8],提出了由饮食习惯引起的紫菜多糖酶基因转移至人类肠道细菌的新见解。此外,本实验室研究人员以前期自主筛选的海洋细菌Wenyingzhuangia fucanilytica 为基础,挖掘到紫菜多糖酶Por16A_Wf[9],并阐明该酶的生化性质及作用方式。 基于氨基酸序列分析,目前发现的β-紫菜多糖酶分别归属于2 个糖苷水解酶(Glycoside hydrolyase, GH)家族,即PorA、PorB、BpGH16B 及Por16A_Wf归属于GH16 家族[10],BpGH86A 归 属于GH86 家族。
本文从海洋细菌基因组出发, 通过生物信息学和分子生物学相结合的技术, 挖掘并克隆表达新型紫菜多糖酶,采用超高效液相色谱-质谱联用技术对作用方式进行解析。 课题组前期分离纯化得到1 株海洋细菌Wenyingzhuangia aestuarii OF219,并完成其全基因组测序。 前期的生物信息学分析表明,该细菌基因组中存在一条潜在的β-紫菜多糖酶基因por16Z(MN639876)。本文对该序列进行生物信息学分析、大肠杆菌异源表达,阐明重组蛋白Por16Z_Wa 的生化性质、动力学常数及作用方式, 为紫菜多糖这一重要藻类多糖的酶解及分子剪裁提供新型工具酶。
1 材料与方法
1.1 材料与试剂
干坛紫菜, 购自青岛水产市场; 海洋细菌Wenyingzhuangia aestuarii OF219, 实验室自主筛选及保藏;基因组DNA 抽提试剂盒,上海Sangon Biotech 公司; 高纯质粒小量快速提取试剂盒、BL21(DE3)感受态细胞,北京Biomed 公司;pET-28a(+)质粒,北京Annoron 公司;切胶回收试剂盒,Omega 公司;限制性内切酶BamHI/XhoI、预染蛋白分子质量标准,Thermo Fisher Scientific 公司;BCA 蛋白浓度测定试剂盒,Beyotime Biotech公司;OHpak LB-806M(8.0 mm×300 mm)色谱柱,日本Shodex 公司;HiPrepTM26/10 Desalting、His-TrapTMHP、Superdex 30 increase 3.2/300 GL 色谱柱,美国GE Healthcare Life Sciences 公司。
1.2 仪器与设备
JY92-IIN 超声波细胞粉碎机,宁波Scientz 公司;Agilent 1260 Infinity、Agilent 1290 Infinity 液相色谱仪、Aglient G6125B 质谱仪, 美国Agilent公司;ÄKTA Prime Plus 蛋白纯化系统, 美国GE Healthcare Life Sciences 公司 ;NANODROP 2000, 美国Thermo Fisher Scientific 公司;Dawn Heleos II MALLS 检测器,美国Wyatt Technology公司;iMark 酶标仪、T100TM PCR 仪, 美国Bio-Rad 公司。
1.3 方法
1.3.1 紫菜多糖的提取及纯化 紫菜多糖的提取及纯化参考文献[11]的方法。利用粉碎机将干坛紫菜磨粉备用。 紫菜粉末通过水提及乙醇沉淀法处理获得粗紫菜多糖。 利用ÄKTA Prime Plus 蛋白纯化系统, 以凝胶排阻色谱法 (色谱柱:HiPrepTM26/60 Sephacryl S-400)纯化多糖,以次甲基蓝法[12]对各收集管进行检测,收集显色的各管进行透析、冻干,所得多糖用于后续试验。 多糖的分子质量由高效凝胶排阻色谱(High performance size exclusion chromatography, HPSEC)法测定,检测器采用多角度激光光散射仪 (Multi-angle laser light scattering detector, MALLS) 及示差检测器(Refractive index detector, RID)联用方法。 本研究中使用的紫菜多糖分子质量测定为(194.0±2.1)ku。
1.3.2 生物信息学分析 使用SignalP 4.1[13]、db-CAN[14]、ExPASy[15]软件分别预测Por16Z_Wa 的 信号肽、 结构域组成、 分子质量及等电点。 利用ClustalX[16]进行多序列比对并使用MEGA6[17]基于邻接法建立进化树。 利用BLASTP[18]程序对Por16Z_Wa 与已报道的GH16 家族β-紫菜多糖酶序列的相似度进行预测。
1.3.3 克隆表达及蛋白纯化
1.3.3.1 克隆表达 利用磁珠法提取W. aestuarii OF219 基因组DNA。 通过无缝克隆技术扩增目的基因并构建质粒。 上下游引物分别为5’-GACACGGATCCATGATTGTATCATGTAGTAAAA AGAACACT-3’、5’- GACACCTCGAGTTATTGTT TGTCTTCTAATTTCCAAGTTCT-3’。酶切位点使用BamHI 及XhoI。 将目标序列进行PCR 扩增,纯化后得扩增产物片段与含有N 端His 标签的载体连接, 将构建的质粒进行检测, 回收构建成功的质粒,并将其转化至大肠杆菌BL21(DE3)感受态细胞中。 将转化成功的菌株使用Luria-Bertani 琼脂培养基于37 ℃、180 r/min 培养过夜, 添加异丙基β-D-硫代半乳糖苷(培养基中终浓度为0.5 mmol/L)并于17 ℃低温诱导过夜。 离心收集细胞沉淀并重悬于20 mmol/L 柠檬酸-NaH2PO4(pH 6.5)缓冲液中,通过超声破碎(400 W,共99 次循环)获取粗酶液。
1.3.3.2 蛋白纯化 使用亲和色谱对粗酶液进行纯化 (色谱柱为HisTrapTMHP), 以20 mmol/L Na2HPO4-NaH2PO4(含0.3 mol/L 氯化钠,pH 8.0)为流动相进行平衡,使用咪唑在0~0.5 mol/L 范围进行线性梯度洗脱, 观察紫外信号并收集有酶活的组分。 进一步以凝胶排阻色谱柱(HiPrepTM26/10 Desalting) 进行脱盐, 以20 mmol/L 柠檬酸-Na2HPO4(pH 6.5)为流动相进行平衡。收集有酶活组分并利用SDS-PAGE 测定蛋白分子质量及纯度,纯化后的蛋白用于酶学性质的研究。
1.3.4 β-紫菜多糖酶酶活测定 将紫菜多糖底物溶液(溶于20 mmol/L pH 6.5 柠檬酸-Na2HPO4缓冲液,质量浓度为2 mg/mL)与适量稀释的酶液混合,45 ℃孵育10 min,取出后立即置于100 ℃金属浴灭活5 min。 反应体系中的还原糖增量以pHBH法[19]测定。 酶活单位(U)定义为1 mL 酶液1 min内水解底物产生1 μmol 还原糖(即D-半乳糖)的活力[20]。 以BCA 法测定蛋白浓度。
1.3.5 生化性质研究
1.3.5.1 温度对Por16Z_Wa 的影响 酶与底物在4~50 ℃范围内反应, 测定酶活力以研究重组蛋白的最适反应温度。将酶液在不同温度下(4,25,35,45 ℃)放置24 h,探究温度对酶活稳定性的影响。
1.3.5.2 pH 值对Por16Z_Wa 的影响 酶与底物在不同pH 值缓冲体系 (pH 3.0~6.5: 柠檬酸-Na2HPO4缓冲液;pH 6.5~9.0:Na2HPO4-NaH2PO4缓冲液;pH 9.0~11.0:Na2CO3-NaHCO3缓冲液)中反应,测定酶活力以研究重组蛋白的最适反应pH值。 将酶液置于上述不同的pH 值条件下,在4 ℃下存放1 h 后调整至最适pH 值,探究pH 值对酶活稳定性的影响。
1.3.5.3 金属离子及化学试剂对Por16Z_Wa 的影响 向酶与底物的反应体系中添加终浓度为0~0.6 mol/L 的NaCl 和KCl,研究Na+、K+浓度对重组蛋白活力的影响。 向反应体系中添加终浓度1 mmol/L 的金属离子及化学试剂, 测定MgSO4、Ca-Cl2、CuSO4、MnSO4、HgCl2、β-巯基乙醇、SDS、EDTA存在时酶活力的变化情况。
1.3.5.4 动力学常数的测定 根据米氏方程,在底物质量浓度为0.1~1 mg/mL 时测定Por16Z_Wa的动力学常数Km、Vmax、Kcat及Kcat/Km。
1.3.6 作用方式及降解产物研究 以0.1 U Por16Z_Wa 酶解100 mg 紫菜多糖底物 (以20 mmol/L 柠檬酸-Na2HPO4缓冲液溶解至2 mg/mL,pH 6.5),添加缓冲液补足至体系中紫菜多糖底物终质量浓度为1 mg/mL,45 ℃下反应,并于不同时间间隔取样并灭活。 酶解产物利用高效凝胶排阻色谱, 以多角度激光光散射仪与示差检测器联用(HPSEC-MALLS-RID)测定分子质量。 色谱柱为Shodex OHpak LB-806M; 流动相为20 mmol/L Na2HPO4-NaH2PO4(含0.15 mol/L NaCl,pH 7.4)。
为探究Por16Z_Wa 的降解终产物, 以7.5 U Por16Z_Wa 与100 mg 紫菜多糖底物(2 mg/mL,超纯水溶解)混合,于最适条件下充分反应,以获取终产物。 利用超高效凝胶排阻色谱与质谱联用(UPSEC-MS)技术检测降解产物中的全部寡糖组分。 凝胶排阻色谱柱:Superdex 30 increase 3.2/300[21];流动相:10%乙腈,含50 mmol/L 甲酸铵;流速:0.075 mL/min;柱温:30 ℃;进样体积:10 μL;质谱条件: 气体流速12 L/min; 雾化压力241.32 kPa;干燥气温度300 ℃;碎裂电压110 V;扫描分子质量100~2 000 u;离子源负离子模式。
1.4 数据统计
试验设计3 个平行,利用统计分析软件SPSS 16.0 进行显著性分析,以P<0.05 作为差异显著性检验的标准。
2 结果与讨论
2.1 生物信息学分析
Por16Z_Wa 由313 个氨基酸组成, 其序列中含有一段GH16 家族结构域 (62~307)(如图1 所示)。
图1 Por16Z_Wa 结构域Fig.1 Domain architecture of Por16Z_Wa
GH16 家族是目前研究最为广泛的半乳聚糖降解酶家族之一, 该家族酶具有广泛的底物多样性[22-23],包括琼胶、紫菜多糖、地衣多糖、κ-卡拉胶以及海带淀粉。 将GH16 家族中已报道的糖苷水解酶与本研究的Por16Z_Wa 进行系统发育分析,发现不同底物的降解酶进化关系较近, 其中Por16Z_Wa 与GH16 家族中β-紫菜多糖酶的进化地位相近,预示该序列具有β-紫菜多糖酶活力。
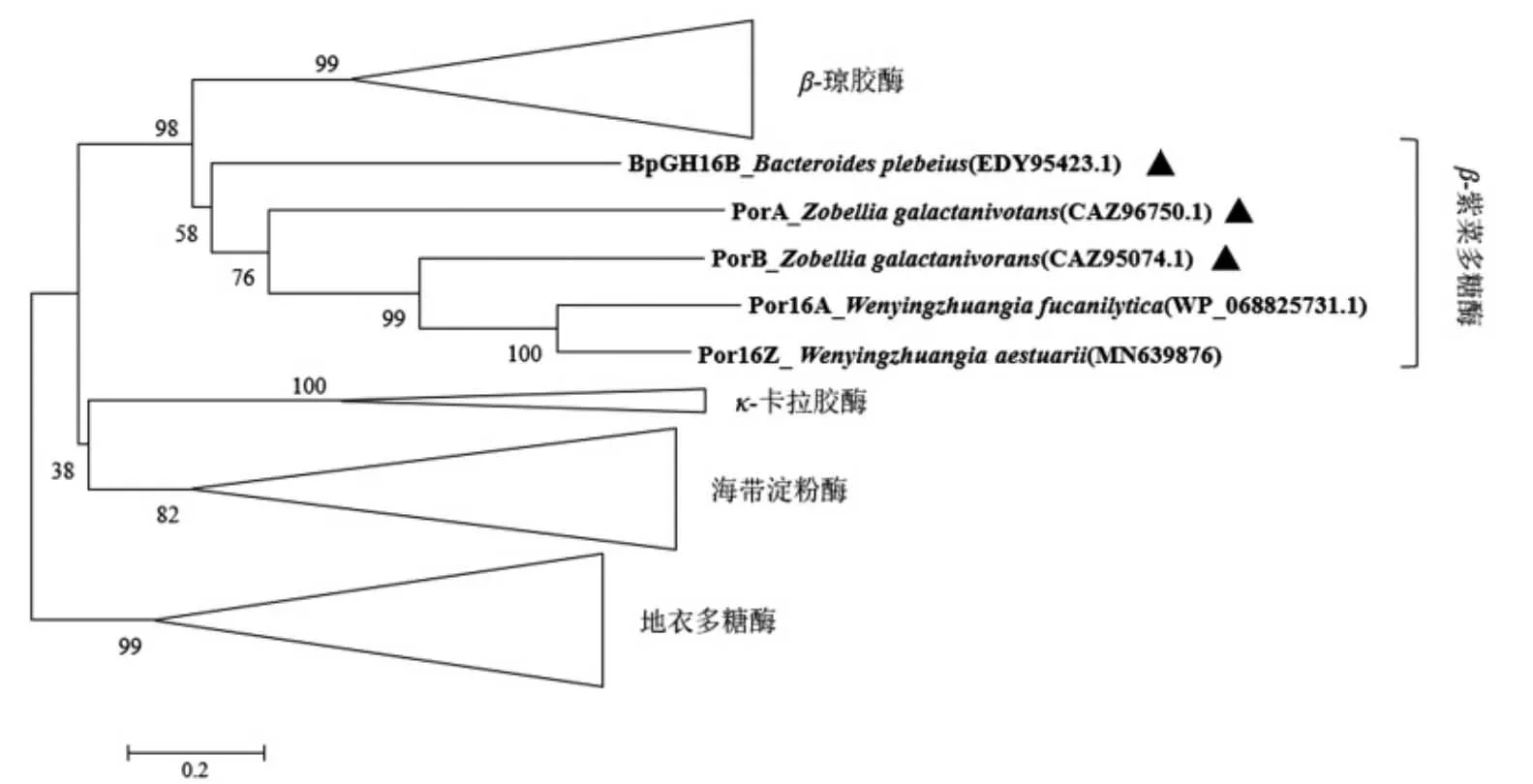
图2 Por16Z_Wa 与GH16 家族糖苷水解酶构建的进化树Fig.2 Evolutionary tree constructed by Por16Z_Wa and GH16 family glycoside hydrolases
GH16 家族β-紫菜多糖酶的关键位点已被报道。其中,PorB[4]的关键催化位点为E156 和E161,关键识别位点为W67 和R70。 目前, 已报道的4条GH16 家族β-紫菜多糖酶在上述位点均保守。多序列比对结果表明,Por16Z_Wa 在上述4 个位点与GH16 家族β-紫菜多糖酶具有一致性 (图3),进一步提示该酶具有潜在的β-紫菜多糖酶活力。同时,对Por16Z_Wa 以及已报道的GH16 家族的蛋白序列进行Blast 局部比对,发现序列相似度最高为67.4%,相似度最高的酶为W. fucanilytica产紫菜多糖酶Por16A_Wf[10](覆盖率为88%)。

图3 Por16Z_Wa 的多序列比对结果Fig.3 Multiple sequence alignment results of Por16Z_Wa
2.2 功能验证
Por16Z_Wa 实现了在大肠杆菌BL21(DE3)中的表达,超声破碎后的上清液经镍柱亲和纯化后,在咪唑浓度为0.2 mol/L 时,洗脱组分显示出β-紫菜多糖酶活力,酶活为(11.02±0.12)U/mg。 纯化后的蛋白在电泳谱图中呈现单一条带, 证明其纯度较高(图4)。 利用蛋白分子质量Marker 计算得出重组蛋白的分子质量为37.4 ku, 与预测分子质量(39.6 ku)吻合。 上述结果证实Por16Z_Wa 为β-紫菜多糖酶。

图4 纯化后Por16Z_Wa 的SDS-PAGE 图谱Fig.4 SDS-PAGE of purified Por16Z_Wa
2.3 酶学性质
2.3.1 温度对酶活的影响 反应温度对Por16Z_Wa 酶活的影响如图5a 所示,该酶的最适反应温度为45 ℃。 15 ℃和20 ℃时的活力分别为最适温度的63.0%和86.7%, 说明此酶具有适冷性; 相比于已阐明生化性质的Por16A_Wf,Por16Z_Wa 可以在低温下反应同时保持较高的酶解速率, 有利于降低实际应用时的热能消耗。Por16Z_Wa 的热稳定性如图5b 所示,Por16Z_Wa在4 ℃放置24 h 时酶活基本保持不变。 此外,25℃放置6 h 酶活残余率为95.2%, 然而该酶在35℃及45 ℃下的酶活稳定性较差,这一现象与多数海洋来源的糖苷水解酶性质相似[24-26]。
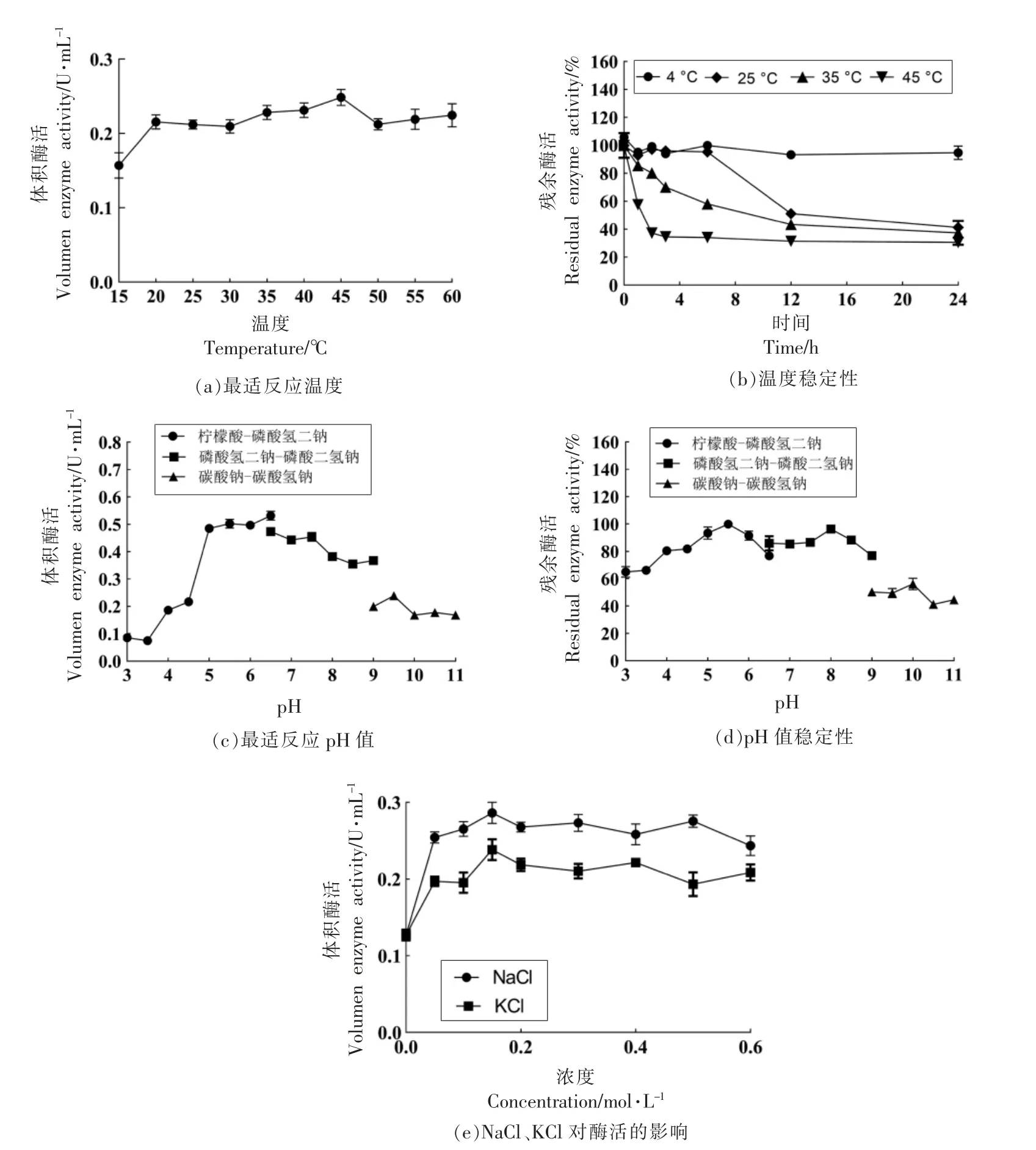
图5 Por16Z_Wa 酶学性质Fig.5 Enzymatic properties of Por16Z_Wa
2.3.2 pH 值对酶活的影响 反应体系pH 值对Por16Z_Wa 酶活的影响如图5c 所示,该酶的最适反应pH 值为6.5, 并在pH 5~9 范围展现出较高活力, 说明该酶具有较广泛的pH 适用范围。Por16Z_Wa 的pH 值稳定性如图5d 所示,Por16Z_Wa 在pH 4.0~9.0 条件下酶活保持稳定(酶活残余率大于75%)。
2.3.3 NaCl、KCl、 金属离子及化学试剂 对Por16Z_Wa酶活的影响 NaCl 和 KCl 对Por16Z_Wa 酶活的影响如图5e 所示。 与未经处理的反应体系相比,0.15 mol/L NaCl 和0.15 mol/L KCl 可分别使Por16Z_Wa 的酶活提高1.2 倍和0.9 倍,Na+和K+显著提高酶活的现象与Por16A_Wf 以及多种海洋来源的酶相一致[27],此时底物的物理状态可能发生了改变, 导致相对酶活的提高[28]。然而在不添加Na+和K+的条件下,Por16Z_Wa 仍然具有酶活, 证明该酶活力的启动不依赖盐离子。在工业生产中,酶解产物中不含有盐离子可以避免后续繁琐的脱盐步骤, 降低生产成本。
Ca2+、Mg2+、Cu2+、EDTA、β-巯基乙醇及SDS 均对酶活无显著影响, 而Mn2+与Hg2+对酶活具有显著性抑制作用(图6)。

图6 金属离子和化学试剂对Por16Z_Wa 酶活的影响Fig.6 Effects of metal ions and chemicals on the activity of Por16Z_Wa
2.3.4 动力学常数 控制反应体系中底物质量浓度 为0.1 ~1 mg/mL,于最适反应条件下测定Por16Z_Wa的动力学常数,Km、Vmax、Kcat和Kcat/Km分别为1.09 mg/mL、105.26 U/mg、69.44 s-1、12.36×103L/(mol·s)。 已报道的Por16A_Wf,其Km、Kmax、Kcat和Kcat/Km分别为0.54 mg/mL、17.54 U/mg、13.41 s-1、4.25×103L/(mol·s),Por16Z_Wa 的Vmax及Kcat 高于Por16A_Wf,证明该酶的催化效率较高。
2.4 作用方式和反应产物研究
将0.1 U Por16Z_Wa 与100 mg 底物反应,反应产物经凝胶色谱柱分离后检测,MALLS 检测器检测得到在反应10 min 及30 min 后样品分子质量分别由初始的(194.0±2.1)ku 降至(89.9±1.3)ku和(47.6±1.5)ku,这种短时间内分子质量急剧下降的现象证明Por16Z_Wa 为内切酶。

图7 HPSEC-MALLS-RID 分析Por16Z_Wa 的酶解产物Fig.7 HPSEC-MALLS-RID analysis of the hydrolysis products of Por16Z_Wa
为探究降解终产物, 利用UPSEC-MS 对7.5 U Por16Z_Wa 酶解100 mg 底物所得的终产物进行在线分离及检测, 终产物组成如图8 所示。Por16Z_Wa 的降解终产物由1 种二糖、3 种四糖及3 种六糖组成。 碳水化合物是一类非模板合成的生物大分子,其结构存在异质性,紫菜多糖也表现出相同性质[29]。 据文献报道,紫菜多糖是琼脂糖的生物前体物, 因此在紫菜多糖的糖链中含有琼脂糖的二糖单元的取代,约占30%。 其中,琼脂糖结构由G 残基及LA 残基 ((1-4)-O-3,6-内醚-α-L-吡喃半乳糖残基)交替连接构成[4]。 此外,多糖链的G 残基的C6 位氧原子容易被甲基化修饰,修饰程度可高达50%[30]。 Por16Z_Wa 的二糖产物仅有一种,即紫菜二糖(L6S-G),且高聚合度的紫菜四糖(L6S-G)2及紫菜六糖(L6S-G)3均未被检测到, 证明Por16Z_Wa 能够识别并切割G 与L6S 之间的β-1,4 糖苷键, 并将所有的紫菜二糖重复单元完全水解, 具有高效制备紫菜二糖的潜力。此外,所有的四糖及六糖产物均为LA-G 取代或者甲基化修饰的结构, 而二糖产物中未发现相应的结构单元LA-G 及L6S-GMe 的生成, 证明Por16Z_Wa 严格识别G-L6S 之间的糖苷键。 因此,Por16Z_Wa 是一种紫菜多糖酶解的新工具,可以用于紫菜寡糖及紫菜二糖的高效、定向制备。

图8 Por16Z_Wa 降解产物的提取离子流色谱图Fig.8 EIC chromatogram of the end products of Por16Z_Wa
3 结论
本研究从海洋细菌Wenyingzhuangia aestuarii OF219 的基因组克隆并异源表达了一条新型的GH16 家族β-紫菜多糖酶, 对其进行了生物信息学分析并研究了其生化性质及作用方式。 45 ℃、pH 6.5 是Por16Z_Wa 的最适反应条件, 其在pH 4.0~9.0 及4 ℃的环境中具有较好的稳定性,20℃下仍能保持80%以上的酶活性。 作用方式结果表明Por16Z_Wa 为内切酶。 Por16Z_Wa 的降解终产物主要由紫菜二糖构成, 并含有少量的四糖及六糖, 且四糖、 六糖均为被取代或修饰的紫菜寡糖。Por16Z_Wa 作为紫菜多糖的新型工具酶,可以用于低分子质量紫菜多糖的制备及紫菜二糖的高效、定向制备,该酶的研究有利于紫菜及紫菜多糖的高值化开发及利用。
