小鼠骨髓源性巨噬细胞极化的体外诱导方法探究*
2022-03-04辛嘉萁许小凡段丽芳范建伟吴楠张红
辛嘉萁, 许小凡, 段丽芳, 范建伟, 吴楠, 张红,2△
·实验技术·
小鼠骨髓源性巨噬细胞极化的体外诱导方法探究*
辛嘉萁1, 许小凡1, 段丽芳1, 范建伟1, 吴楠3, 张红1,2△
(1陕西中医药大学,陕西 咸阳 712046;2陕西省免疫炎症相关疾病中医药防治国际联合研究中心,陕西 咸阳 712046;3慕尼黑工业大学伊莎河右岸医院胰腺病研究所,德国 慕尼黑 81675)
探究小鼠骨髓前体细胞体外诱导成为不同极化状态(M1和M2)巨噬细胞的优化方法。健康C57BL/6小鼠麻醉处死,收集其股骨和胫骨腔内容物,经筛网过滤、红细胞裂解后,在RPMI-1640完全培养基中培养16h,收集未贴壁的骨髓前体细胞重新接种于6孔板。根据培养基中所加刺激剂的种类、剂量不同进行实验分组,于不同时点收集细胞,光镜下观察各组细胞形态学变化,流式细胞术及RT-qPCR检测不同极化状态巨噬细胞的相应标志物。(1)小鼠骨髓前体细胞经50 μg/L巨噬细胞集落刺激因子(M-CSF)刺激72 h后,CD11b阳染率达到90%以上;刺激96 h后,F4/80的阳染率达到95%以上。40 μg/L的粒-巨噬细胞集落刺激因子(GM-CSF)刺激96 h后,CD11b阳染率也达到了90%以上,F4/80阳染率至144 h达到峰值(58.2%);(2)在M-CSF刺激所得单核-巨噬细胞的基础上,给予M1型巨噬细胞诱导剂(25 μg/L LPS和10 μg/L IFN-γ)刺激24 h,可见CD86的阳染率大于90%;给予M2型巨噬细胞诱导剂(20 μg/L IL-4和IL-13)刺激后CD206的阳染率始终处于较低水平(10%左右);(3)在GM-CSF刺激的基础上,给予M1型巨噬细胞诱导剂刺激24 h,可见CD86的阳染率大于90%;而当细胞接受M2型巨噬细胞诱导剂刺激96 h,CD206的阳染率达68.98%;(4)RT-qPCR结果显示在给予相应极化诱导剂刺激后,M1型巨噬细胞标志物诱导型一氧化氮合酶(iNOS)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、IL-12,以及M2型巨噬细胞标志物:几丁质酶3样蛋白3(Chi3l3/Ym1)、甘露糖受体(MR)和精氨酸酶1(Arg-1)的mRNA表达均明显高于对照组(<0.01)。(1)C57BL/6小鼠骨髓前体细胞受到M-CSF或GM-CSF诱导后90%以上细胞均可向单核细胞分化,M-CSF可诱导90%以上的细胞为成熟巨噬细胞,GM-CSF可诱导58%的细胞为成熟巨噬细胞;(2)在M-CSF前期诱导的基础上,联合LPS和IFN-γ易于诱导出M1型巨噬细胞,但联合IL-4和IL-13难以获得M2型巨噬细胞;(3)在GM-CSF前期诱导的基础上,联合LPS和IFN-γ易于诱导出M1型巨噬细胞,联合IL-4和IL-13也可将大部分细胞诱导成为M2型巨噬细胞。
小鼠骨髓前体细胞;巨噬细胞极化;M1型巨噬细胞;M2型巨噬细胞
巨噬细胞是人体重要的免疫细胞,在生命活动中具有重要的生理和病理功能。近年来的研究发现,巨噬细胞在不同组织微环境中表型和功能会发生相应改变,这种现象被称为巨噬细胞的极化[1-2]。极化后的巨噬细胞主要分为M1型和M2型巨噬细胞两种表型[3-4]。大量实验证实,不同极化状态的巨噬细胞由于分泌的细胞因子不同,在疾病进展中发挥着不同的作用,深入认识不同极化类型巨噬细胞的作用已经成为多种疾病发病机制的研究热点[5-10]。
然而,如何获得足量、确切的极化巨噬细胞是保障大量相关研究顺利进展的基础。目前已有几种体外分离诱导巨噬细胞极化的方法,但是尚未形成确切且统一的结论,不同文献所提供的巨噬细胞极化诱导的方法存在较大差异[11-16]。这一现状使相关科研人员无法参照稳定的实验方法,增加了极化巨噬细胞相关研究的难度。因此,当前寻找一种稳定可靠的极化巨噬细胞体外诱导方法具有十分重要的意义。本实验通过体外分离培养C57BL/6小鼠骨髓前体细胞,使用不同的刺激剂,观察鉴定各个刺激剂作用不同时间后巨噬细胞表型的变化,进而优选出C57BL/6小鼠骨髓源性巨噬细胞极化的体外诱导方法,为巨噬细胞极化相关的实验研究奠定基础。
材料和方法
1 主要药品及试剂
巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF; #315-02-10UG)、粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF; #315-03-50UG)、干扰素γ(interferon-γ,IFN-γ; #315-05-20UG)、白细胞介素4(interleukin-4,IL-4; #081449)和IL-13(#1111207)均购于PeproTech;脂多糖(lipopolysaccharide,LPS; 大肠杆菌055:B5,L6529)购于Sigma-Aldrich;各种鉴定用抗体,包括抗F4/80-IgG(4342459)、F4/80抗体(4329362)、抗CD11b-IgG(7194822)、CD11b抗体(7187553)、抗CD86-IgG(2234523)、CD86抗体(7075951)、CD206-IgG(7173965)和CD206(7195936)抗体均购于BD。
2 实验方法
2.1C57BL/6小鼠骨髓前体细胞的分离培养健康的雄性C57BL/6小鼠20只,6~8周龄,体重20~25 g,购于四川成都达硕实验动物有限公司[SCXK(川)2020-030],在(22±2)℃的环境中自由取食饮水,适应性饲养1周后,进行以下操作:麻醉小鼠,浸泡于75%的乙醇中5 min。随后将小鼠固定于无菌鼠板(注意不要破坏小鼠的胫骨和股骨),使用无菌剪刀和镊子将小鼠腿部外皮剪开,剔除部分肌肉组织,将胫骨和股骨完整取下,置于RPMI-1640培养基中剔除残余组织后将胫骨和股骨两端剪开,用RPMI-1640培养基冲洗其内腔,收集冲洗液200目无菌筛网过滤,收集液体离心(1 000×,5 min),在沉淀中加入3 mL红细胞裂解液混匀,室温静置3~5 min,加入3 mL完全1640培养基(含10%胎牛血清)终止裂解。经RPMI-1640清洗两遍(1 000×,5 min),用完全RPMI-1640培养基重悬细胞,接种于细胞培养皿,置于37 ℃、5% CO2培养箱16 h后,收集培养皿中未贴壁的细胞,以5×105/mL密度接种于6孔板中用于后续实验。
2.2C57BL/6小鼠骨髓前体细胞诱导极化实验分组及操作参照已有的相关文献[13,15-16],初步选定了诱导剂的类型、剂量和刺激时间进行实验。
2.2.1诱导C57BL/6小鼠骨髓前体细胞向单核-巨噬细胞分化首先采用含有M-CSF(50 μg/L)或GM-CSF(40 μg/L)的完全RPMI-1640培养基刺激小鼠骨髓前体细胞,于不同时点收集细胞,流式细胞术检测小鼠单核细胞表面标志物CD11b和小鼠成熟巨噬细胞的表面标志物F4/80,确定体外诱导小鼠骨髓前体细胞分化为单核-巨噬细胞的最优方法。
2.2.2诱导C57BL/6小鼠骨髓来源的单核-巨噬细胞向M1或M2型巨噬细胞极化在成功得到由M-CSF或GM-CSF诱导分化的单核-巨噬细胞的基础上,给予M1型巨噬细胞的诱导剂(25 μg/L LPS和10 μg/L IFN-γ)及M2型巨噬细胞的诱导剂(20 μg/L IL-4和20 μg/L IL-13)刺激,于不同时点收集细胞,流式细胞术检测小鼠不同极化类型巨噬细胞的表面标志物(M1型CD86、M2型CD206)。进一步使用RT-qPCR的方法检测不同极化类型巨噬细胞标志物mRNA的表达,M1型标志物诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、IL-6、TNF-α和IL-12,M2型标志物几丁质酶3样蛋白3(chitinase 3-like protein 3,Chi3l3/Ym-1)、甘露糖受体(mannose receptor,MR)和精氨酸酶1(arginase 1,Arg-1)。
2.3流式细胞术鉴定细胞表型在相应时点使用PBS清洗孔内细胞2遍,每孔加入2%的胰蛋白酶消化液,于37 ℃培养箱中消化2 min后收集各组细胞,加入相应的流式抗体,于4 ℃避光孵育0.5 h。PBS清洗2遍,鞘液重悬细胞,200目滤网过滤后上机检测。
2.4RT-qPCR检测M1及M2型巨噬细胞相关基因的mRNA表达提取各组细胞总RNA进行逆转录,以GAPDH为内参照、cDNA为模板进行PCR,采用2-ΔΔCt法定量比较Ct值,计算目的基因的相对表达量。M1及M2型巨噬细胞相关引物序列如表1所示。

表1 RT-qPCR鉴定不同极化类型巨噬细胞的引物序列
3 统计学处理
所有实验数据均采用SPSS 13.0统计软件进行处理,计量数据采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,以<0.05表示差异有统计学意义。
结果
1 M-CSF和GM-CSF诱导C57BL/6小鼠骨髓前体细胞向单核-巨噬细胞分化
1.1M-CSF和GM-CSF刺激C57BL/6小鼠骨髓前体细胞的形态变化如图1所示,分离出的小鼠骨髓前体细胞在未加入M-CSF和GM-CSF培养24 h后,大部分呈悬浮生长,形状为不规则或圆形透明状。随着培养时间不断延长,于培养48 h后发现细胞碎片逐渐增多。至96 h仅有少部分细胞贴壁生长,细胞形态呈不规则形;采用50 μg/L的M-CSF刺激48 h即可见到部分细胞呈贴壁生长,但与最初分离出的细胞形态差异不大。培养72 h后大部分细胞贴壁生长,细胞形态发生明显变化,由最初的圆形逐渐转化成不规则多边形、长梭形,细胞开始增殖;采用40 μg/L GM-CSF刺激48 h后,部分细胞贴壁生长,细胞形态仍维持在圆形或类圆形,培养至72 h后,大部分细胞呈不规则形,且出现成团生长的情况。

Figure 1.Phenotypic changes of bone marrow precursor cells from C57BL/6 mice stimulated with M-CSF or GM-CSF at different time points (×200).
1.2M-CSF和GM-CSF刺激小鼠骨髓前体细胞流式鉴定结果如图2、3所示,50 μg/L M-CSF刺激小鼠骨髓前体细胞72、96和120 h后,流式细胞术检测小鼠单核细胞表面标志物CD11b,发现刺激72 h后,90%以上的细胞呈现CD11b阳性表达;而成熟小鼠巨噬细胞表面标志物F4/80的阳性表达率随着时间的延长不断增高,于刺激96 h后达到峰值(≥90%)。

Figure 2.Flow cytometry results of CD11b and F4/80 in C57BL/6 mouse bone marrow precursor cells induced by M-CSF at different time points. Mean±SD. n=3. **P<0.01 vs control group.

Figure 3.Flow cytometry results of F4/80 and CD11b in mouse bone marrow precursor cells stimulated with M-CSF after 96 h.
如图4、5流式细胞术检测结果所示,小鼠骨髓来源的前体细胞经40 μg/L GM-CSF刺激96 h后,CD11b阳染率始终维持在90%以上,但F4/80阳染率仅为8.86%,进一步延长刺激时间,F4/80阳染率在120 h略有升高、至144 h达到峰值(58.2%),随后呈下降趋势。

Figure 4.Flow cytometric results of CD11b and F4/80 in bone marrow precursor cells from C57BL/6 mice induced by GM-CSF at different time points. Mean±SD. n=3. **P<0.01 vs control group.

Figure 5.Flow cytometry result of CD11b and F4/80 in mouse bone marrow precursor cells after GM-CSF stimulation (representative result of 144 h).
2 不同刺激剂诱导单核-巨噬细胞向M1、M2型极化
2.1M-CSF诱导的单核-巨噬细胞经LPS & IFN-γ或IL-4 & IL-13刺激后极化表型改变收集M-CSF刺激96 h后的单核-巨噬细胞,分别给予M1诱导剂(25 μg/L的LPS和10 μg/L的IFN-γ)和M2诱导剂(20 μg/L的IL-4和IL-13),观察细胞的形态学及用流式细胞术检测阳染率的变化。
如图6所示,单核-巨噬细胞经M1诱导剂刺激24 h,发现大部分细胞形态呈长梭形,与文献报道的M1型巨噬细胞形态基本吻合;但M2诱导剂刺激24 h,大部分细胞的形态变化不大,没有呈现出文献报道的M2型巨噬细胞所特有的荷包蛋形。进一步延长刺激时间至48 h,细胞形态依然未发生明显变化,72 h和96 h少量细胞呈现类荷包蛋型,但是细胞数量明显减少。

Figure 6.The morphological changes of M-CSF-induced monocyte-macrophages at different time points after stimulation with LPS & IFN-γ or IL-4 & IL-13 (×200).
如图7、8所示,进一步采用流式细胞术检测发现,M1诱导剂刺激24 h后大部分细胞表达小鼠M1型巨噬细胞的表面标志物CD86,阳染率可达到96.81%,与对照组相比存在显著差异。而M2诱导剂于不同时点刺激后,小鼠M2型巨噬细胞的表面标志物CD206阳染率均低于15%,除了72 h,其余时点与对照组相比没有明显变化。
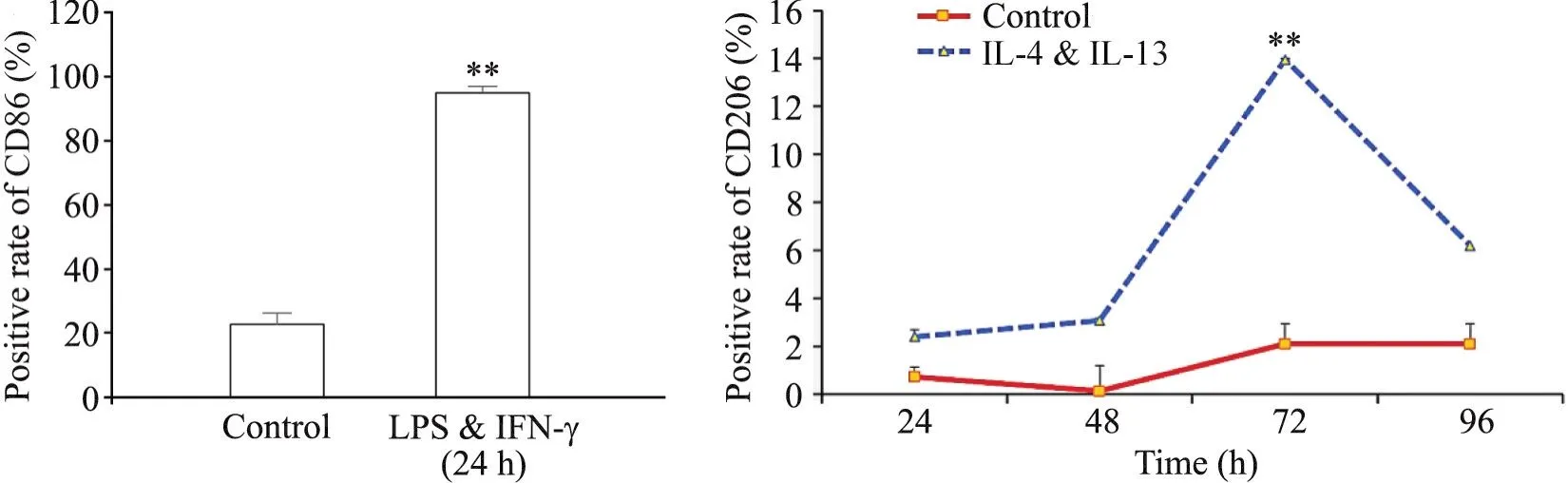
Figure 7.Flow cytometry results of M-CSF-induced mouse monocyte-macrophages stimulated with LPS & IFN-γ for 24 h or IL-4 & IL-13 for 24 to 96 h. MeanSD. n=3. **P<0.01 vs control group.

Figure 8.Representative images of flow cytometry for analyzing M-CSF-induced monocyte-macrophages stimulated with LPS & IFN-γ for 24 h (A) or IL-4 & IL-13 for 72 h (B).
2.2GM-CSF诱导的单核-巨噬细胞经LPS & IFN-γ或IL-4 & IL-13刺激后,极化表型改变收集GM-CSF刺激96 h后的单核-巨噬细胞,分别给予M1诱导剂和M2诱导剂,观察细胞的形态并用流式细胞术检测细胞阳染率的变化。
如图9所示,M1诱导剂刺激24 h,发现细胞逐渐变为不规则形,部分细胞转化为多边形或长梭形;M2诱导剂刺激24~120 h后,发现细胞形态逐渐改变,呈圆形或类圆形贴壁生长。

Figure 9.The morphological changes of GM-CSF-induced monocyte-macrophages at different time points after stimulation with LPS & IFN-γ or IL-4 & IL-13 (×200).
进一步采用流式细胞技术检测发现,M1诱导剂刺激24 h后,大部分细胞表达M1型巨噬细胞表面标志物CD86(≥90%)。而M2诱导剂刺激96 h后,大部分细胞表达CD206阳性(68.98%),继续延长IL-4&IL-13刺激时间至120 h,发现CD206的阳性比例没有明显增加(68.03%)。结果见图10、11。
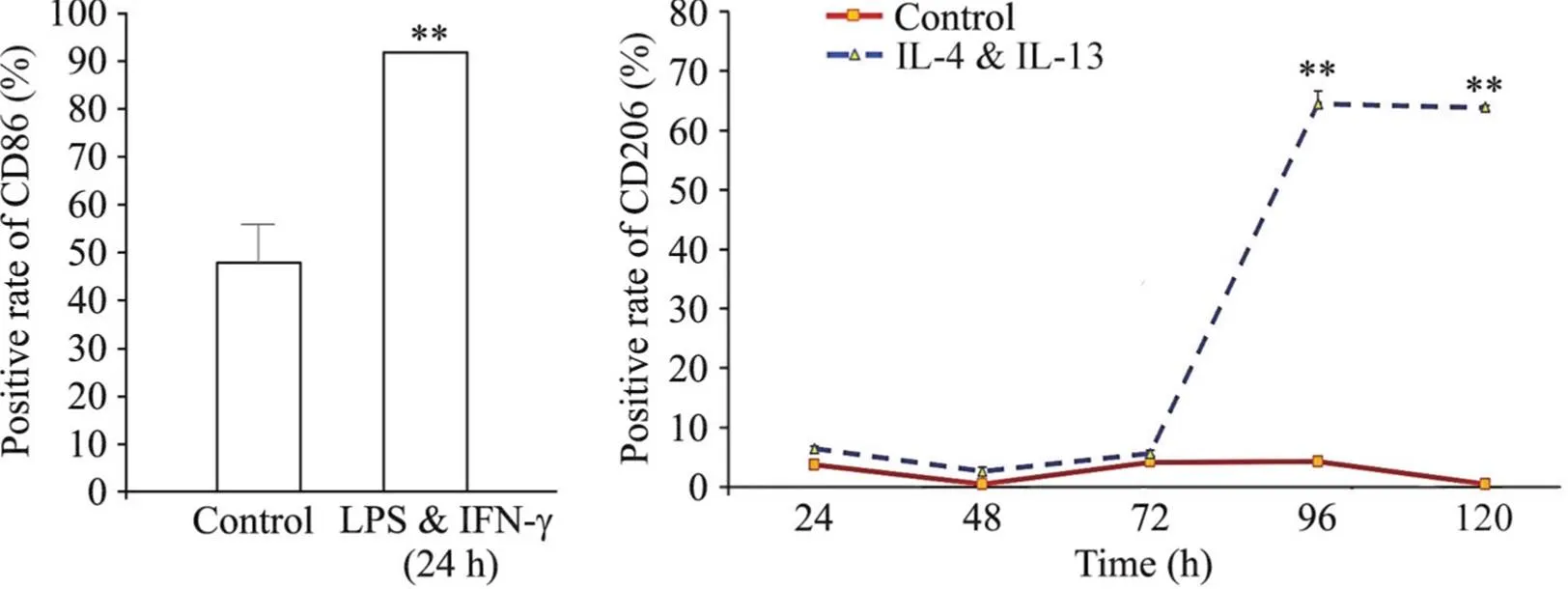
Figure 10.Flow cytometry results of GM-CSF-induced mouse monocyte-macrophages stimulated with LPS & IFN-γ for 24 h or IL-4 & IL-13 for 24 to 120 h. MeanSD. n=3. **P<0.01 vs control group.
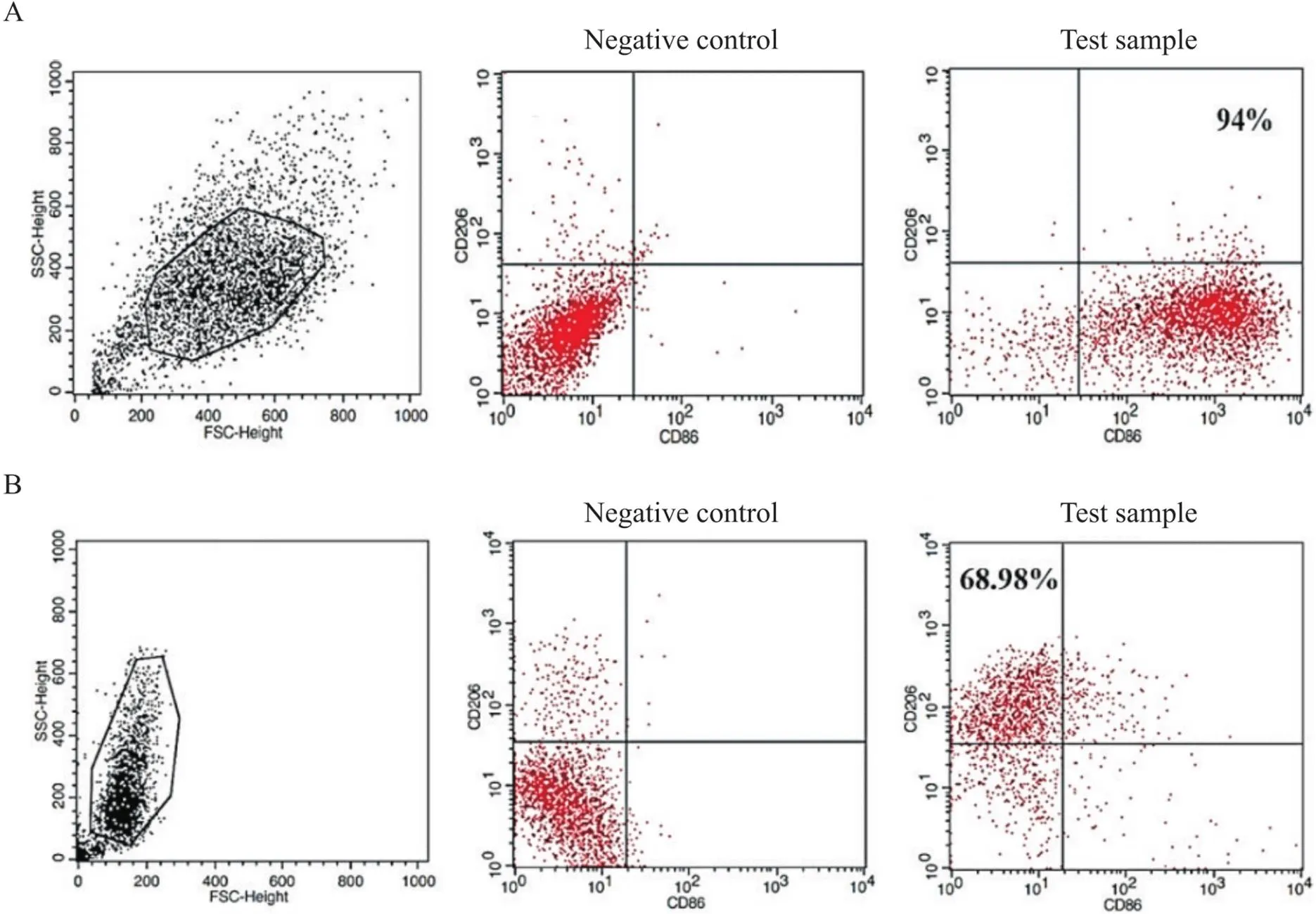
Figure 11.Representative results of flow cytometry of GM-CSF-induced monocyte-macrophages stimulated with LPS & IFN-γ for 24 h (A) or IL-4 & IL-13 96 h (B).
3 PCR鉴定巨噬细胞表型
经过上述实验探究,我们基本确定出可靠的M1及M2型巨噬细胞极化诱导方法,将诱导完成的不同极化类型的巨噬细胞收集,进行RT-qPCR鉴定。如图12所示,经M1刺激剂诱导后M1型巨噬细胞相关基因如iNOS、IL-6、TNF-α和IL-12的mRNA表达显著增加,与对照组相比差异具有统计学意义(<0.01),而M2刺激剂诱导后巨噬细胞相关基因如Ym-1、MR和Arg-1的mRNA表达增加,与对照组相比差异具有统计学意义(<0.01)。

Figure 12.RT-qPCR was used to detect the mRNA expression of M1 and M2 macrophage-related molecules. A: the M1 macrophage-related mRNA expression in GM-CSF-induced monocyte-macrophages stimulated with LPS & IFN-γ for 24 h; B: the M2 macrophage-related mRNA expression in GM-CSF-induced monocyte-macrophages stimulated with IL-4 & IL-13 for 24 h. Mean±SD. n=3. *P<0.05,**P<0.01 vs control group.
讨论
巨噬细胞在人体中承担着重要的生理和病理功能,近来研究发现[17-18],巨噬细胞不仅在病变组织中发生浸润,其表型和功能在不同微环境也会发生相应改变,即巨噬细胞的极化。极化后的巨噬细胞主要分为M1和M2两种表型[19-20]。两种极化类型的巨噬细胞在形态和功能等方面均有明显差异。M1型巨噬细胞主要由脂多糖和γ干扰素诱导形成,能够分泌促炎症细胞因子如IL-1β、IL-6和TNF-α等,在炎症的早期发挥主要作用[21-22]。M2型巨噬细胞主要通过IL-4和IL-13诱导生成,能够分泌促纤维化细胞因子,如TGF-β和IL-10等,在炎症反应的中后期发挥主要作用[23-24]。
近年来的大量研究表明,巨噬细胞极化参与多种疾病的发生和发展[8,11-12,25],调控巨噬细胞的极化或回输不同极化类型的巨噬细胞,在许多疾病都展示出了不同的效果[8,11-12,15-16]。然而,体外诱导巨噬细胞极化的方法目前尚未形成确切且统一的共识,难以收获足量、确切的极化巨噬细胞已经成为阻碍相关研究顺利进展的瓶颈。
目前巨噬细胞极化诱导多采用骨髓来源的前体细胞,但是具体的诱导方法,如刺激剂的选择、刺激浓度和培养时间等方面存在较大差别[11-13,15-16]。多数学者[11,13,15-16]采用M-CSF或GM-CSF作为前期诱导剂将骨髓前体细胞诱导成为单核-巨噬细胞后,在此基础上进一步采用极化刺激剂诱导出M1或M2型巨噬细胞,也有部分研究采用L929细胞条件培养基诱导单核-巨噬细胞[26]。但在少数研究中[27]没有采用前期诱导剂,直接采用极化刺激剂将骨髓来源的前体细胞诱导成M1或M2型巨噬细胞。然而,我们的研究发现,对照组(未加前期诱导剂)在培养72h后细胞的增殖状态明显欠佳。而经M-CSF或GM-CSF诱导后的细胞增殖活跃,有利于下一步的极化诱导。
目前,巨噬细胞的极化诱导剂已基本形成共识,即M1诱导剂为LPS/IFN-γ,M2诱导剂为IL-4/IL-13[28]。但是,前期诱导剂的选择是否对巨噬细胞的极化结果也有一定影响呢?有学者采用40 μg/L 的GM-CSF作为前期诱导剂,继而联合100 μg/L LPS和20 μg/L IFN-γ诱导24 h,经PCR检测发现M1型标志物iNOS、IL-12和TNF-α的mRNA表达升高;联合20 μg/L IL-4诱导24 h,发现M2型标志物Arg-1、MR、Ym-1的mRNA表达升高。该课题组继而在另一项研究中以20 μg/L M-CSF作为前期诱导剂,联合50 μg/L LPS和20 μg/L IFN-γ诱导24 h得到M1型巨噬细胞;联合20 μg/L IL-4诱导24 h得到M2型巨噬细胞[15-16]。由于这两项研究中极化巨噬细胞的鉴定均是采用PCR的鉴定方法,我们课题组使用了流式细胞术对单核巨噬细胞表面标志物(CD11b&F4/80)和M1、M2型巨噬细胞的表面标志物(CD86/CD206)进行鉴定。结果发现,C57BL/6小鼠的骨髓前体细胞,经M-CSF或GM-CSF前期诱导作用后,向单核-巨噬细胞分化的效应及进一步极化结果存在一定差异。
我们的研究显示,50 μg/L M-CSF刺激小鼠骨髓前体细胞后,CD11b和F4/80的阳性表达均大于90%;而GM-CSF诱导后F4/80的阳染率为58%,但CD11b的阳染率始终维持在90%以上,提示M-CSF和GM-CSF均可将骨髓前体细胞诱导成为单核-巨噬细胞,但是M-CSF更易诱导出成熟的巨噬细胞。
在进一步的巨噬细胞极化诱导实验中我们发现,由50 μg/L M-CSF诱导得到的巨噬细胞进一步接受25 μg/L LPS和10 μg/L IFN-γ刺激24 h后,M1型巨噬细胞表面标志物CD86阳染率≥90%。随后,我们采用20 μg/L IL-4和IL-13将巨噬细胞向M2型诱导,但是经过多次实验发现,M2型巨噬细胞的阳染率不理想(CD206阳染率<15%)。提示以M-CSF作为前期诱导剂易于诱导出M1型巨噬细胞,但难以诱导出M2型巨噬细胞。采用GM-CSF作为前期诱导剂得到的巨噬细胞,进一步联合M1刺激剂培养24 h发现CD86阳染率大于90%;联合M2刺激剂培养96 h后CD206阳染率大于65%。提示,以GM-CSF作为前期诱导剂能成功诱导出M1型巨噬细胞,也可成功诱导M2型巨噬细胞。虽然本研究得到的M2型巨噬细胞诱导比例只有68%左右,但回顾同类研究发现:多数研究未使用流式细胞术鉴定M2型巨噬细胞的具体诱导比例,仅采用RT-qPCR的方法进行巨噬细胞极化鉴定[15-16]。少数使用流式细胞术鉴定巨噬细胞极化的实验,M2型巨噬细胞诱导比例没有显示或低于50%[12-13,29]。
综上所述,我们认为骨髓前体细胞经前期诱导剂M-CSF或GM-CSF刺激后,有利于单核细胞的分化和增殖。M-CSF相较于GM-CSF更易诱导出成熟的小鼠巨噬细胞;当以M1型巨噬细胞作为研究对象时,M-CSF或GM-CSF均可作为前期诱导剂;而以M2型巨噬细胞作为研究对象时,建议选用GM-CSF作为前期诱导剂。
[1] Xue J,Schmidt SV,Sander J,et al. Transcriptome-based network analysis reveals a spectrum model of human macrophage activation[J]. Immunity,2014,40(2):274-288.
[2]唐俭,陈旭昕,韩志海. 巨噬细胞极化及极化调控的研究进展[J]. 转化医学志,2019,8(6):373-376.
Tang J,Chen XX,Han ZH. The research progress of macrophage polarization and its regulatory mechanisms[J]. Transl Med J,2019,8(6):373-376.
[3] Drewes AM. Understanding and treatment of chronic pancreatitis[J]. World J Gastroenterol,2013,19(42):7219-7221.
[4] Atri C,Guerfali FZ,Laouini D. Role of human macrophage polarization ininflammation during infectious diseases[J]. Int J Mol Sci,2018,19(6):1801.
[5] Muñoz J,Akhavan NS,Mullins AP,et al. Macrophage polarization and osteoporosis: a review[J]. Nutrients,2020,12(10):2999.
[6] Yao Y,Xu XH,Jin L. Macrophage polarization in physiological and pathological pregnancy[J]. Front Immunol,2019,10:792.
[7] Orliaguet L,Dalmas E,Drareni K,et al. Mechanisms of macrophage polarization in insulin signaling and sensitivity[J]. Front Endocrinol (Lausanne),2020,11:62.
[8] Xue J,Sharma V,Hsieh MH,et al. Alternatively activated macrophages promote pancreatic fibrosis in chronic pancreatitis[J]. Nat Commun,2015,6:7158.
[9] Qin H,Holdbrooks AT,Liu Y,et al. SOCS3 deficiency promotes M1 macrophage polarization and inflammation[J]. J Immunol,2012,189(7):3439-3448.
[10] Essandoh K,Li Y,Huo J,et al. MiRNA-mediated macrophage polarization and its potential role in the regulation of inflammatory response[J]. Shock,2016,46(2):122-131.
[11] Ma PF,Gao CC,Yi J,et al. Cytotherapy with M1-polarized macrophages ameliorates liver fibrosis by modulating immune microenvironment in mice[J]. J Hepatol,2017,67(4):770-779.
[12] Ying W,Cheruku PS,Bazer FW,Safe SH,Zhou B. Investigation of macrophage polarization using bone marrow derived macrophages[J]. J Vis Exp,2013,76:50323.
[13] 任凯夕,赵诣林,金超,等. 小鼠骨髓来源巨噬细胞体外培养及极化相关实验方法的建立[J]. 细胞与分子免疫学杂志,2013,29(3):310-313.
Ren KX,Zhao YL,Jin C,et al. Establishment of in vitro culture and polarization methods of mouse bone marrow-derived macrophages[J]. Chin J Cell Mol Immunol,2013,29(3):310-313.
[14] Zomer HD,Jeremias TDS,Ratner B,et al. Mesenchymal stromal cells from dermal and adipose tissues induce macrophage polarization to a pro-repair phenotype and improve skin wound healing[J]. Cytotherapy,2020,22(5):247-260.
[15] 马鹏飞. 巨噬细胞ly6Chigh向ly6Clow亚群转变在肝损伤修复中的调控作用与机制研究[D]. 西安: 第四军医大学,2017.
Ma PF. The role and mechanism of the ly6Chighto ly6Clowmacrophage transition during the liver injury and repair[D]. Xi'an: Fourth Military Medical University,2017.
[16] 马鹏飞. 回输不同极化类型的巨噬细胞对小鼠肝纤维化的治疗作用和机制的研究[D]. 西安: 第四军医大学,2014.
Ma PF. Study on the mechanism of transplantation of differently activated macrophages for murine liver fibrosist treatment[D]. Xi'an: Fourth Military Medical University,2014.
[17] Murray PJ. Macrophage polarization[J]. Annu Rev Physiol,2017,79:541-566.
[18] Sica A,Erreni M,Allavena P,et al. Macrophage polarization in pathology[J]. Cell Mol Life Sci,2015,72(21):4111-4126.
[19] Liu PS,Ho PC. Determining macrophage polarization upon metabolic perturbation[J]. Methods Mol Biol,2019,1862:173-186.
[20] Martinez FO,Gordon S,Locati M,et al. Transcriptional profiling of the human monocyte-to-macrophage differentiation and polarization: new molecules and patterns of gene expression[J]. J Immunol,2006,177(10):7303-7311.
[21] Yunna C,Mengru H,Lei W,et al. Macrophage M1/M2 polarization[J]. Eur J Pharmacol,2020,877:173090.
[22] Shapouri-Moghaddam A,Mohammadian S,Vazini H,et al. Macrophage plasticity,polarization,and function in health and disease[J]. J Cell Physiol,2018,233(9):6425-6440.
[23] Rőszer T. Understanding the mysterious M2 macrophage through activation markers and effector mechanisms[J]. Mediators Inflamm,2015,2015:816460.
[24] Zhang F,Wang H,Wang X,et al. TGF-β induces M2-like macrophage polarization via SNAIL-mediated suppression of a pro-inflammatory phenotype[J]. Oncotarget,2016,7(32):52294-52306.
[25] Lu H,Wu L,Liu L,et al. Quercetin ameliorates kidney injury and fibrosis by modulating M1/M2 macrophage polarization[J]. Biochem Pharmacol,2018,154:203-212.
[26] 王伟,秦贻,王亚茹,等. L929细胞条件培养基诱导培养的小鼠原代巨噬细胞生物学特性对比[J]. 生物工程学报,2020,36(7):1431-1439.
Wang W,Qin Y,Wang YR,et al. Characteristic comparison of mouse primary macrophages cultured in L929 cell conditioned medium[J]. Chin J Biotech,2020,36(7):1431-1439.
[27] 张颖. 肾纤维化中巨噬细胞参与淋巴管新生的作用和机制研究[D]. 武汉: 华中科技大学,2016.
Zhang Y. The roles and mechanisms of macrophages participating lymphangiogenesis[D]. Wuhan: Huazhong University of Science and Technology,2016.
[28] 辛嘉萁,许小凡,张红. 巨噬细胞极化与胰腺炎症及纤维化的相关研究进展[J]. 生命科学,2019,31(2):190-194.
Xin JQ,Xu XF,Zhang H. New insight into macrophage polarization in the development of pancreatic inflammation and fibrosis[J]. Chin Bull Life Sci,2019,31(2):190-194.
[29] 李康,郭强,王翠妮,等. M1和M2型巨噬细胞表型的比较分析[J]. 现代免疫学,2008,28(3):177-183.
Li K,Guo Q,Wang CN,et al. Comparative analysis of phenotypes of classically (M1) and alternatively (M2) activated macrophages[J]. Curr Immunol,2008,28(3):177-183.
Methods ofinduction of polarization from mouse bone marrow-derived macrophages
XIN Jia-qi1,XU Xiao-fan1,DUAN Li-fang1,FANG Jian-wei1,WU Nan3,ZHANG Hong1,2△
(1,712046,;2,712046,;3,,81675,)
To explore the optimal method for isolation of mouse bone marrow precursor cells and induction into different polarization states (M1 and M2).The contents of femur and tibia were collected from C57BL/6 mice. After filtering through meshes and erythrocyte lysis,cells were cultured in RPMI-1640 complete medium for 16 h. Non-adherent cells were collected and re-seeded in culture plates. The cells were collected at different time points. The morphological changes of the cells were observed under light microscope. The corresponding markers of macrophages in different polarization states were detected by flow cytometry and RT-qPCR.(1) After stimulation with 50 μg/L M-CSF for 72 h,the positive staining rate of CD11b was more than 90%. The positive staining rate of F4/80 was over 95% after stimulation for 96h. After 96 h of stimulation with 40 μg/L GM-CSF,the positive staining rate of CD11b also reached more than 90%. The positive staining rate of F4/80 reached the peak at 144 h (58.2%). (2) On the basis of pre-induction of M-CSF,followed by 25 μg/L LPS and 10 μg/L IFN-γ stimulation for 24 h,the positive staining rate of CD86 was greater than 90%. Under the same circumstances,20 μg/L IL-4 and IL-13 were given at different time points which showed that the positive staining rate of CD206 was always low (<10%). (3) On the basis of pre-induction of GM-CSF,followed by 25 μg/L LPS and 10 ng/mL IFN-γ stimulation for 24 h,the positive staining rate of CD86 was greater than 90%. When the cells were stimulated with 20 μg/L IL-4 and IL-13 for 96 h,the positive staining rates of CD206 were 68.98%. (4) RT-qPCR results showed that after simulation the mRNA expression of the markers for M1 macrophages (iNOS,IL-6,TNF-α and IL-12) and M2 macrophages (Ym1,MR and Arg-1) were significantly higher than that in the control group (<0.01).(1) Both M-CSF and GM-CSF induce more than 90% of bone marrow precursor cells from C57BL/6 mouse into monocytes. 90% of bone marrow precursor cells differentiate to mature macrophages by M-CSF,and 58% of bone marrow precursor cells induced by GM-CSF become mature macrophages. (2) On the basis of pre-induction of M-CSF,LPS joint with IFN-γ is easy to induce M1 macrophages. However,it is difficult to obtain M2 macrophages by combination of IL-4 and IL-13. (3) On the basis of pre-induction of GM-CSF,LPS joint with IFN-γ is easy to induce M1 macrophages. Combined stimulation of IL-4 and IL-13 induces most cells to M2 macrophages.
Mouse bone marrow precursor cells; Macrophages polarize; M1 macrophages; M2 macrophages
R363; R329.2+5
A
10.3969/j.issn.1000-4718.2022.02.024
1000-4718(2022)02-0375-10
2021-09-07
2021-12-24
[基金项目]国家自然科学基金资助项目(No. 81673816; No. 82174201; No. 82104815);陕西中医药大学创新团队项目(No. 2019-YL14);陕西省特支计划(No. 303/141020047)
Tel: 029-38183453; E-mail: zhangh1227@163.com
(责任编辑:余小慧,罗森)
