Gasdermin E多肽抑制剂对卵巢癌化疗诱导肠道损伤的 改善作用
2022-03-04李婷婷刘申平
李婷婷,刘申平,杜 明
复旦大学附属妇产科医院妇产科,上海 200011
卵巢癌是目前致死率最高的妇科肿瘤[1],化疗对于延长患者生存和减少卵巢癌复发有重要作用[2]。而有80%~90%的卵巢癌患者在接受顺铂化疗后出现消化道不良反应[3],常表现为恶心、呕吐、体质量下降、食欲减退及腹泻等[4]。目前针对化疗相关肠道损伤,仍以止吐、补液、抑制消化道炎症及给予益生菌等对症支持治疗为主[5-6],尚无针对化疗相关肠道损伤的特异性药物。
近年来研究发现顺铂、博来霉素等化疗药物可通过半胱氨酸天冬氨酸特异性蛋白酶3(caspase-3)/gasdermin E(GSDME)途径诱导细胞焦亡而导致化疗相关不良反应,如体质量降低、肺部炎症与肠道绒毛组织破坏等[7]。细胞焦亡是一种新发现的细胞程序性死亡方式[8],而GSDME 可被活化的caspase-3 切割并释放具有造孔性的 GSDME N-末端结构域进而诱发细胞焦亡[7]。 GSDME在多数肿瘤细胞中表达量很低,但是在正常细胞中广泛高表达[9]。因此,GSDME可作为改善化疗相关肠道损伤,而不影响化疗疗效的潜在治疗靶点。目前已有关于在正常细胞或其他肿瘤中进行GSDME基因敲除或应用caspase抑制剂的研究[10-13],但尚鲜见在卵巢癌模型中应用GSDME特异性抑制剂的报道。
因此,本研究针对caspase-3在GSDME的剪切位点设计多肽抑制剂,应用正常小鼠和卵巢癌移植小鼠,研究GSDME抑制剂对顺铂抗肿瘤效果和诱导肠道损伤的影响,为临床研发既不影响顺铂化疗效果又能减轻化疗相关肠道损伤的药物提供新思路。
1 材料与方法
1.1 实验动物与主要试剂采用雌性C57BL/6小鼠(6~7周龄,体质量17~21 g),将其饲养于上海南方模式生物科技股份有限公司SPF级动物房。卵巢癌细胞株 ID8获赠于复旦大学附属妇产科医院刘海鸥实验室。顺铂购于Sigma公司;GSDME多肽抑制剂Z-DMLD-FMK由GLS公司构建(图1);GSDME抗体购于Abcam公司;HRP标记的β-actin抗体购于Bioworld公司。转染细胞的带嘌呤霉素抗性luciferase过表达慢病毒购于吉凯基因。实时荧光定量PCR试剂盒购于TaKaRa公司,RMPI 1640培养液、胎牛血清、胰酶溶液购于Gibco公司,D-荧光素钾盐购于启维益成,嘌呤霉素购于Clontech公司。

图1 GSDME的caspase-3剪切位点(A)及化学结构(B)
1.2 稳定表达荧光素酶的ID8细胞株构建ID8细胞用含10%胎牛血清的RMPI 1640培养液,于5% CO2、37℃恒温培养箱中培养。将稳定传代培养的ID8细胞以3×104个/mL的密度接种于6孔板,每孔接种体积为2 mL,使其细胞密度次日能达到30%,以备慢病毒感染。按感染复数(MOI)为50的比例用带嘌呤霉素抗性luciferase过表达的慢病毒感染ID8细胞,将感染基更换为1 mL含感染增强试剂HitransG A的培养基。感染72 h后,用浓度为4 μg/mL的嘌呤霉素筛选48 h,当细胞荧光密度达到80%时,将嘌呤霉素浓度至少降低至 2 μg/mL。收集细胞,经qPCR鉴定luciferase的表达情况,将转染成功的细胞冻存。
1.3 qPCR检测ID8-luc细胞中luciferase表达情况用TRIzol提取细胞RNA,用TaKaRa反转录试剂盒进行反转录。PCR引物由吉凯基因设计,以GAPDH为内参,引物序列见表1。PCR扩增条件:95℃预变性15 s,95℃ 5 s、60℃ 34 s重复40个循环。采用公式F=2-ΔΔCt计算目的基因的相对表达量。

表1 引物序列
1.4 小鼠分组及处理将20只6~7周龄雌性C57BL/6小鼠(健康组),随机分为对照组、顺铂组、GSDME抑制剂组和顺铂+GSDME抑制剂组,每亚组5只。以分组当天为实验第0天,两顺铂亚组小鼠于实验第0天、第14天分别腹腔注射顺铂(10 mg/kg)1次;两GSDME抑制剂亚组小鼠于实验第0天开始连续腹腔注射Z-DMLD-FMK(每只200 μg/d),注射18 d;对照组连续注射0.9%氯化钠液,注射18 d。实验第19天处死小鼠。
将另20只6~7周龄雌性C57BL/6小鼠(卵巢癌组)随机分为上述4个亚组。实验第0天对所有小鼠腹腔注射3×106个ID8-luc细胞[14]。两顺铂亚组小鼠于第15天、第29天分别腹腔注射顺铂(10 mg/kg)1次;两GSDME抑制剂亚组小鼠于实验第15天开始连续腹腔注射Z-DMLD-FMK (每只200 μg/d),共18 d;对照组连续注射0.9%氯化钠液,注射18 d。实验第34天处死小鼠。动态监测并记录两组小鼠的体质量。
1.5 卵巢癌小鼠活体荧光成像将卵巢癌小鼠在处死前进行活体荧光成像。每只小鼠腹腔注射 150 μL荧光素酶底物D-荧光素钾盐(15 g/L), 10 min后用异氟烷将其麻醉,利用活体荧光成像仪记录小鼠卵巢癌的成瘤情况,获得每只小鼠腹腔肿瘤的荧光值。
1.6 小鼠肠道组织取材及病理分析将小鼠以3%戊巴比妥(80 mL/kg)腹腔注射麻醉后,颈椎脱臼处死,取完整的小鼠小肠组织。剪取部分小肠组织用液氮速冻后-80℃保存;部分固定于4%多聚甲醛。
小鼠肠道组织经甲醛固定过夜后,进行脱水、石蜡包埋切片,常规苏木精-伊红(H-E)染色,在光镜下观察小鼠肠道组织损伤程度,并拍照。取小鼠组织切片,在100倍视野下随机观察5个绒毛和5个隐窝结构,用ImageJ软件测量小鼠肠道绒毛长度及隐窝深度,并计算二者的比值(V/C)。
1.7 Western印迹检测小鼠肠道中GSDME的表达采用RIPA提取小鼠肠道组织蛋白,取约20 μg蛋白样品进行聚丙烯酰胺凝胶电泳,湿转法转膜、封闭后加入GSDME一抗(1∶1 000)及内参β-actin一抗(1∶1 000),4℃孵育过夜;加入二抗、洗膜,利用ECL工作液进行曝光。用ImageJ软件进行图像分析。
1.8 统计学处理采用GraphPad Prism 9.0进行统计学数据分析,结果以±s表示。组内比较采用单因素方差分析,两两间比较采用Tukey检验。检验水准(α)为0.05。
2 结 果
2.1 稳定表达荧光素酶的ID8细胞株验证将冻存的ID8-luc细胞复苏后在显微镜下观察,发现细胞无污染,生长状态良好且存活率高(图2A)。与对照组相比,转染细胞中luciferase基因表达增加(P<0.000 1,图2B),表明ID8-luc稳定细胞株构建成功。

图2 稳定表达荧光素酶的ID8细胞及luciferase基因检测
2.2 GSDME抑制剂对顺铂诱导的小鼠体质量改变的影响结果(表2)表明:在健康组中,顺铂组小鼠第19天体质量明显低于对照组(P< 0.001);GSDME抑制剂组小鼠体质量与对照组差异无统计学意义;顺铂+GSDME抑制剂组小鼠体质量较顺铂组明显增加(P<0.05)。在卵巢癌组中,顺铂组小鼠第34天平均体质量明显低于对照组(P<0.001);GSDME抑制剂组小鼠体质量与对照组差异无统计学意义;顺铂+GSDME抑制剂组小鼠体质量较顺铂组明显增加(P<0.001)。

表2 各组小鼠处理前后体质量变化n=5, g
2.3 GSDME抑制剂对顺铂抗卵巢癌作用的影响结果(图3)表明:在卵巢癌组中,与对照组相比,顺铂组小鼠卵巢肿瘤负荷明显减小(P< 0.05),GSDME抑制剂组小鼠肿瘤负荷无明显改变;与顺铂组相比,顺铂+GSDME抑制剂组小鼠肿瘤负荷无明显改变。
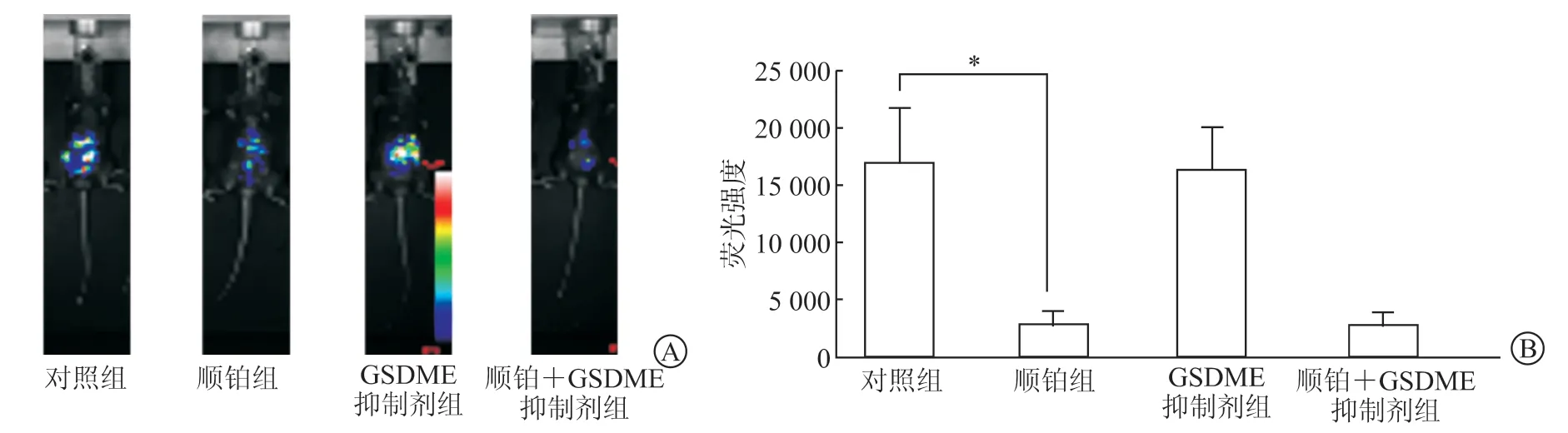
图3 GSDME抑制剂对卵巢癌肿瘤负荷的影响
2.4 小鼠肠道损伤结果(图4)表明:在健康组中,与对照组相比,顺铂组小鼠肠道明显萎缩、隐窝结构被破坏、肠壁变薄、肠绒毛形态不规则,绒毛长度及V/C值减小(P<0.000 1);与对照组相比,GSDME抑制剂组肠道组织无明显改变;与顺铂组相比,顺铂+GSDME抑制剂组小鼠肠道损伤减轻,绒毛长度及V/C值增加(P<0.05)。

图4 GSDME抑制剂对顺铂诱导的小鼠肠道损伤的影响
在卵巢癌组中,与对照组相比,顺铂组小鼠肠道明显萎缩、肠壁变薄、结构被破坏,肠道绒毛长度及V/C值减小(P<0.000 1);与对照组相比,GSDME抑制剂组小鼠肠道组织、绒毛长度和V/C值无明显变化;与顺铂组相比,顺铂+GSDME抑制剂组小鼠肠道损伤减轻,绒毛长度及V/C值增加(P<0.000 1)。
2.5 GSDME抑制剂对顺铂诱导小鼠肠道组织GSDME表达的影响结果(图5)表明:与对照组相比,顺铂组小鼠肠道组织中GSDME蛋白表达增加(P<0.001);与顺铂组相比,顺铂+GSDME抑制剂组小鼠肠道组织中GSDME表达降低(P<0.05)。
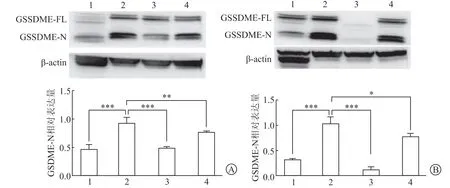
图5 小鼠肠道组织中GSDME蛋白表达情况
3 讨 论
近年来,随着细胞焦亡相关研究的深入,发现其与肿瘤、炎症损伤、代谢性疾病及免疫性疾病相关[15-17]。不同于细胞凋亡,细胞焦亡是伴随着细胞内容物和一系列炎症因子级联式释放的细胞程序性死亡方式。而GSDME是细胞焦亡的关键执行分子,其铰链区有一段caspase-3的四肽切割位点“DMPD”。化疗药物、肿瘤坏死因子(TNF-α)或病毒感染后可以通过激活caspase-3而高效切割GSDME,形成具有磷脂亲和力的GSDME-N端蛋白,并转移至细胞膜寡聚打孔,引起细胞胀大、胞膜破裂、释放其内容物及乳酸脱氢酶(LDH)[7,18]。通过多种细胞系与组织发现,GSDME在人体正常组织中广泛高表达,尤其是胎盘、心脏、肾脏、肠道及耳蜗组织中,而在肿瘤细胞中由于过度甲基化而呈低表达[9]。化疗药物可以诱导高表达GSDME的细胞发生焦亡,而诱导低表达GSDME的细胞发生凋亡。GSDME的活化水平决定了caspase-3激活后的细胞是焦亡还是凋亡。既往研究[7,19]证实,GSDME活化是化疗药物引起不良反应的重要原因。
因此,通过调控 GSDME 的表达水平治疗肿瘤主要体现在以下两个方面:(1)提高肿瘤组织中GSDME的表达水平,从而增加肿瘤细胞对化疗药物的敏感性,增强化疗药物对肿瘤细胞的杀伤作用;(2)通过降低正常组织中GSDME的表达水平或通过应用GSDME特异性抑制剂,减轻或避免化疗过程中正常组织受到的损伤。本研究聚焦于后者,即通过在小鼠卵巢癌模型中应用GSDME抑制剂,探索其能否改善化疗相关肠道不良反应。
GSDME在正常组织中,尤其是肠道组织中表达水平高,这可能是化疗相关不良反应最常发生于肠道的原因。本研究进一步证实,顺铂明显引起小鼠肠道损伤、体质量下降,并增加小鼠肠道组织中GSDME的表达;而且,在健康和卵巢癌移植瘤模型小鼠中,GSDME抑制剂均可缓解顺铂诱导的小鼠消化道损伤和体质量下降,提示化疗药物诱导的消化道损伤可能与高表达GSDME的细胞发生焦亡相关。而GSDME在肿瘤细胞中表达量很低,因此GSDME抑制剂不影响化疗效果。本研究通过活体荧光成像证实,GSDME抑制剂对小鼠卵巢癌负荷无影响,即GSDME抑制剂不影响顺铂的抗肿瘤 作用。
综上所述,化疗药物能通过激活caspase-3/GSDME介导细胞焦亡,导致化疗相关不良反应。本研究在健康和卵巢癌小鼠模型中证实,GSDME抑制剂能减轻顺铂诱导的肠道损伤,其可能通过竞争性抑制caspase-3对GSDME的剪切作用,阻断细胞焦亡通路而发挥作用。这一结果可为临床上治疗卵巢癌化疗诱导的消化道损伤提供新的思路与方向。后续研究将通过特异性敲除肠道GSDME基因,构建GSDME-/-小鼠,进一步探讨顺铂引起的消化道损伤与GSDME介导的细胞焦亡的关系。
利益冲突:所有作者声明不存在利益冲突。
