具核梭杆菌通过靶向lncRNA NEAT1促进结肠癌细胞增殖的机制研究
2022-03-03陈渊文张捷沈火剑朱宏毅沈志勇
陈渊文,张捷,沈火剑,朱宏毅,沈志勇
上海交通大学医学院附属仁济医院,上海 200120
结肠癌是全球第三大常见癌症,也是癌症相关死亡的第二大原因[1]。目前,结肠癌的治疗方案仍以手术、放疗和化疗为主[2]。近年来,随着内镜及各种辅助技术的发展,结肠癌患者的死亡率有所下降,但仍没有有效的方法预防结直肠癌的复发和转移[3]。为了探索有效的治疗方案,人们亟须剖析结肠癌发生的新机制。
人体肠道内定植了丰富多样的微生物群落(古菌、真菌、原生动物和病毒),统称为肠道微生物群[4]。越来越多的证据表明,微生物群与结直肠癌的发生存在潜在的联系[5-6]。最近,在结直肠癌微生物组研究中,具核梭杆菌(Fusobacteriumnucleatum)引起了学者的关注。梭杆菌是革兰氏阴性厌氧杆菌,存在于人的口腔、胃肠道和其他具有物种特异性的宿主中[7]。与正常结肠组织相比,具核梭杆菌在结肠腺瘤和结直肠癌组织中特别富集[8-9]。有研究表明,结直肠癌组织中具核梭杆菌的DNA数量与患者预后相关,有可能作为一种预测结肠癌预后的生物标记[10]。此外,有报道发现与化疗后未复发的结直肠癌患者相比,化疗后复发的结直肠癌患者体内具核梭杆菌的数量明显增加[11]。然而,有关具核梭杆菌促进结肠癌发病的具体机制还有待进一步的深入研究。
本研究采用具核梭杆菌感染结肠癌细胞,探索具核梭杆菌对结肠癌细胞的影响,并研究其对长链非编码RNA(long-stranded non-coding RNA,lncRNA)的作用,期望为结肠癌治疗提供新的研究方向。
1 材料与方法
1.1 材料
人结肠癌HCT116和SW480细胞株购自中国科学院细胞库;具核梭杆菌购自美国ATCC细胞库;脑心浸液琼脂购自湖南汇百侍生物科技有限公司;显色基质法鲎试剂盒购自北京伊塔生物科技有限公司;细菌内毒素工作标准品购自中国药品生物制品检定所;Lipofectamine 2000转染试剂购自美国Thermo公司;TRIzol试剂购自美国Invitrogen公司;CCK-8试剂购自上海碧云天生物技术有限公司;Annexin V-FITC细胞凋亡检测试剂盒购自瑞士Roche公司;RIPA裂解溶液购自美国MedChemExpress公司;caspase-3、Bcl-2、Bax、GAPDH一抗及山羊抗兔IgG二抗购自美国Abacm公司;小干扰核富集转录体1(small interfering nuclear-enriched abundant transcript 1,si-NEAT1)及阴性对照品由生工生物工程(上海)股份有限公司设计及合成。
1.2 主要仪器
HF240细胞培养箱购自上海力申科学仪器有限公司;DG250厌氧培养箱购自英国Don Whitley Scientific公司;Applied Biosystems 7500荧光实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪购自美国Thermo公司;CyFlow Counter流式细胞仪购自德国Partec公司;PowerPacTM基础电泳仪购自美国Bio-Rad公司;多功能酶标仪购自美国BioTek公司。
1.3 细胞及细菌培养
将人结肠癌HCT116和SW480细胞株解冻复苏,重悬后接种于RPMI 1640 培养基(含10%胎牛血清、100 U/mL青/链霉素),置于5% CO2、恒温37 ℃、饱和湿度的细胞培养箱中培养,48 h换培养液1次,取对数生长期的细胞进行实验。在37 ℃厌氧条件下,将具核梭杆菌置于含有血红素、磷酸氢二钾、维生素K1和L-半胱氨酸的脑心浸液琼脂培养基中培养48 h,然后4 ℃、2 000 r/min 离心10 min。收集菌液,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗3次,无抗生素RPMI 1640培养液重悬,用紫外分光光度计检测波长600 nm处的吸光度值(A600),将菌悬液密度调至1×108CFU/mL备用。
1.4 实验分组
取对数生长期的人结肠癌HCT116细胞,设置对照组(不进行细菌感染)、菌液对照组(加入过滤后的菌液)、具核梭杆菌组(采用具核梭杆菌感染)、si-NEAT1组(转染si-NEAT1)和具核梭杆菌+si-NEAT1组(转染si-NEAT1后采用具核梭杆菌感染)。具核梭杆菌组处理时,提前24 h将细胞以2×105个/孔的密度接种于6孔板,按感染复数(multiplicity of infection,MOI)为100∶1加入用无抗体培养基重悬的具核梭杆菌,并将细胞培养板移至细胞恒温培养箱中培养。然后,用PBS洗细胞2次,于含0.01 g/mL甲硝唑的完全培养基中培养,去除细菌,并于特定时间收获,用于不同实验。菌液对照组处理时,将细胞以2×105个/孔的密度接种于6孔板,加入用0.22 μm滤膜过滤后的菌液,将细胞培养板移至细胞恒温培养箱中培养。si-NEAT1及阴性对照组按照说明书使用Lipofectamine 2000转染试剂进行转染。
1.5 定量鲎试验(显色基质法)
按照鲎试剂盒说明书步骤进行实验,用分光光度计于波长545 nm处比色读数获得测定管(s)的吸光度值(As),并测试剂对照管(b)和试剂空白管(bb)吸光度值Ab、Abb,按计算公式A=As-(Ab-Abb),计算得待测物A值,再查对内毒素标准曲线求得内毒素含量。
1.6 qRT-PCR检测结肠癌细胞中RNA表达
按照说明书在细胞内添加TRIzol以提取细胞总RNA,用PrimeScript RT试剂盒将RNA反转录为cDNA,然后进行qRT-PCR。反应体系如下:1 μL 上游引物、1 μL下游引物、10 μL 2×FastStart Universal SYBR Green Master、1 μL cDNA模板,于50 ℃孵育2 min,95 ℃孵育10 min,95 ℃孵育 15 s,40个循环。根据每个反应得到的循环阈值(cycle threshold,Ct)值,以GAPDH为内参,按照2-ΔΔCt法计算NEAT1的表达水平。NEAT1正向引物为5’-GTGTGATCTGAAAACCCTGCT-3’,反向引物为5’-CCCAGAAGACAGAAAGATC-CCA3’。 GAPDH正向引物为5’-AGGRGG-AGGAGTGGGTGTCGCTGTT-3’,反向引物为5’-CCGGGAAACTGTGGCGTGATGG-3’。
1.7 CCK-8法检测细胞增殖
选取生长状态良好的结肠癌HCT116细胞,接种于96孔板,密度为3×104个/mL。将细胞置于37 ℃培养箱中培养24 h、48 h和72 h后,取出培养板,每孔添加10 μL CCK-8溶液,于振荡仪中反应混合1 min,继续将培养板置于37 ℃培养箱中结合2 h。然后,将培养板置于酶标仪,于450 nm处测定细胞A450值。
1.8 流式细胞术检测细胞凋亡
取对数生长期的人结肠癌HCT116细胞,经0.25% 胰酶消化后,收集细胞,于细胞内添加冰预冷的PBS,反复洗2次,1 500 r/min 离心5 min,弃上清液,加入300 μL结合缓冲液,制备单细胞悬浮液。按照Annexin V-FITC凋亡检测试剂盒操作说明书,避光染色30 min,通过流式细胞仪分析细胞凋亡状况,并计算凋亡率。
1.9 蛋白免疫印迹法检测结肠癌细胞中的蛋白表达
用RIPA裂解液提取细胞总蛋白,采用BCA法(bicinchoninic acid method)测定蛋白浓度。在蛋白样品中添加等量体积上样缓冲液,于100 ℃水浴中变性5 min。按照常规配制方法制备10%分离胶以及5%浓缩胶,观察胶凝固后,添加电泳缓冲液。每孔加入30 μg蛋白样品上样,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。将分离的蛋白质转聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,加入已配制好的含5%脱脂奶粉的TBST 封闭液,于室温、20 r/min 摇床孵育1 h。用TBST洗3次,加入以1∶1 000 稀释的一抗反应液,于脱色摇床4 ℃过夜。取出PVDF膜,用TBST洗3次,置于以1∶4 000 稀释的二抗孵育袋,于室温、20 r/min摇床孵育1 h。最后,采用增强化学发光法(enhanced chemiluminescence,ECL)显色。根据目的条带灰度值,以GAPDH作为内参,分析目的蛋白表达水平的变化。
1.10 统计学分析

2 结果
2.1 具核梭杆菌对结肠癌细胞增殖能力的影响
采用定量鲎试验分别检测对照组、过滤后的菌液和具核梭杆菌菌液中的内毒素含量,结果表明,具核梭杆菌中的内毒素含量显著高于对照组和过滤后的菌液(P<0.001,见图1A)。采用CCK-8法检测具核梭杆菌感染后的结肠癌细胞HCT116和SW480的增殖能力,结果显示,与对照组和菌液对照组相比,具核梭杆菌处理后的结肠癌细胞增殖能力显著升高(P<0.05,见图1B、1C),而菌液对照组与对照组之间细胞增殖率无明显差异。因此, 后续实验只使用对照组作为对照。
2.2 具核梭杆菌对结肠癌细胞凋亡的影响
流式细胞凋亡实验结果显示,与对照组相比,具核梭杆菌处理后的HCT116细胞凋亡率降低(P<0.01,见图2)。采用蛋白免疫印迹法进一步检测凋亡相关蛋白caspase-3、Bcl-2和Bax的表达,结果显示,具核梭杆菌处理后2种结肠癌细胞中的caspase-3(P<0.001)和Bax(P<0.05)表达量显著降低,而Bcl-2含量显著上升(P<0.001,见图3)。结果表明,具核梭杆菌能够调节凋亡相关蛋白并抑制结肠癌细胞的凋亡。
2.3 具核梭杆菌对结肠癌细胞中NEAT1表达的影响
NEAT1能够促进结肠癌的发生和发展,为进一步探讨其具体机制,本研究检测了结肠癌细胞HCT116和SW480中的NEAT1表达量。结果表明,具核梭杆菌处理后结肠癌细胞中NEAT1的表达量显著升高(P<0.001,见图4A)。因此,后续实验以NEAT1作为研究对象探索具核梭杆菌促进结肠癌发展的机制。
2.4 抑制NEAT1可逆转具核梭杆菌对结肠癌细胞增殖能力的影响
将结肠癌细胞HCT116和SW480转染si-NEAT1后,与对照组相比,NEAT1的表达量显著降低(P<0.001,见图4B),表明转染成功。采用CCK-8法检测2种结肠癌细胞的增殖情况, 结果显示,转染si-NEAT1后的细胞增殖能力显著下降(P<0.05),但与对照组相比,具核梭杆菌+si-NEAT1组中细胞增殖能力没有显著差异(P>0.05,见图5)。结果表明,si-NEAT1逆转了具核梭杆菌促进结肠癌细胞增殖的效果。
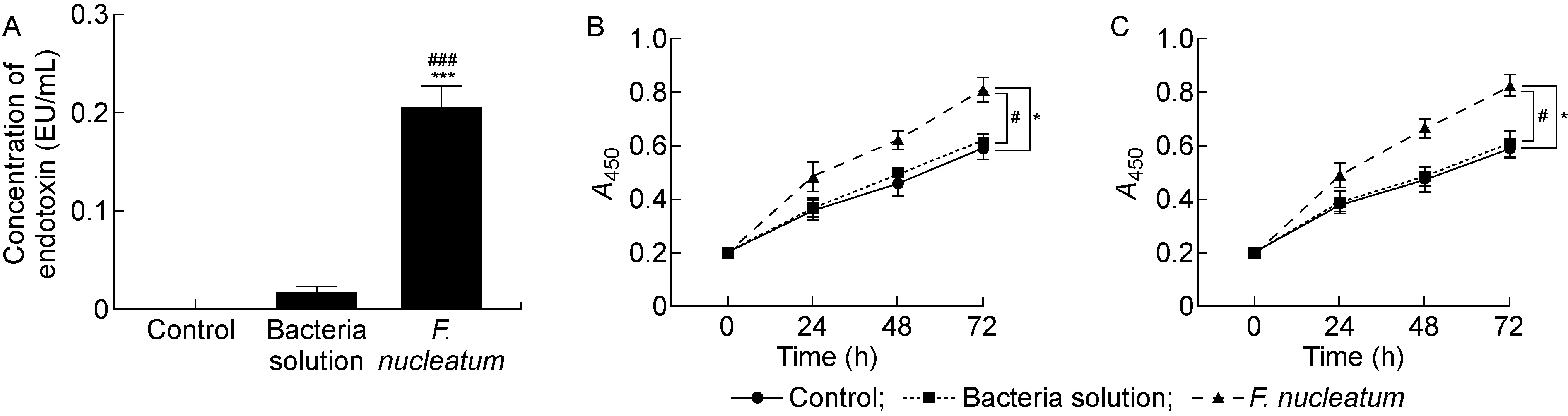
A: Quantitative limulus test. B: Effect of F. nucleatum on proliferation of HCT116 cells. C: Effect of F. nucleatum on proliferation of SW480 cells. *P<0.05, ***P<0.001 compared with the control group; #P<0.05, ###P<0.001 compared with the bacteria solution group.
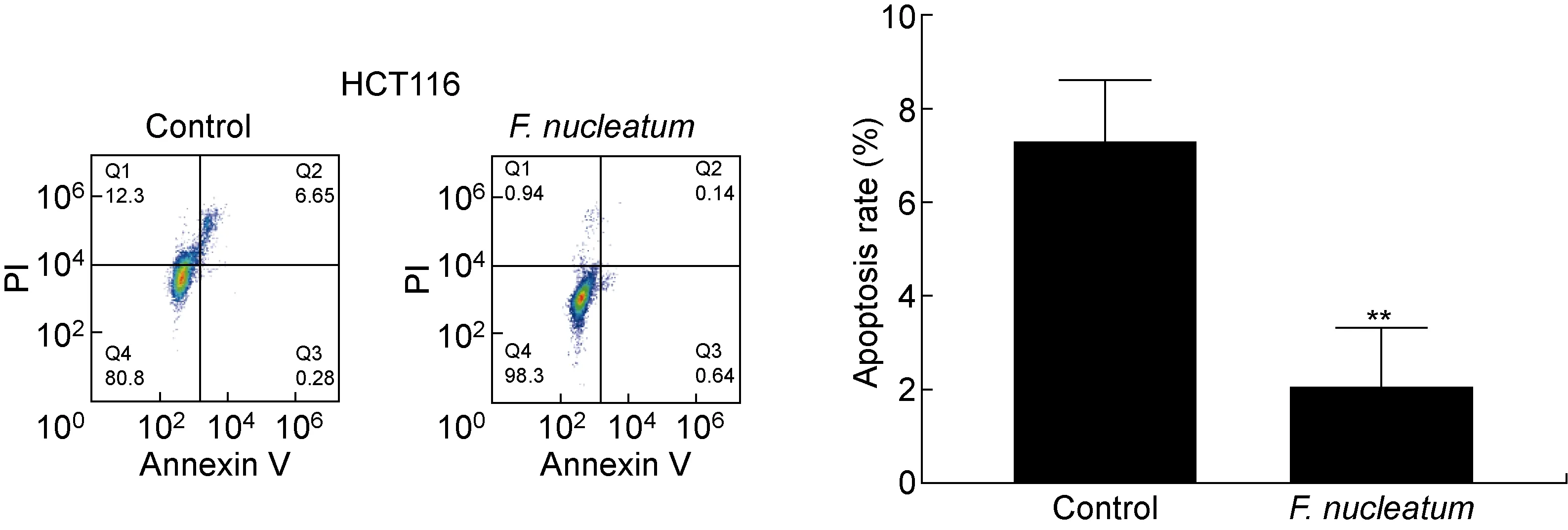
**P<0.01.

*P<0.05, ***P<0.001 compared with the control group.
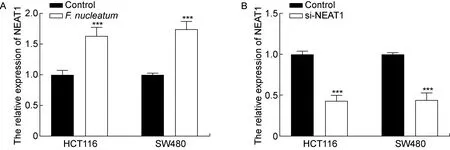
A: Relative expression of NEAT1 in colorectal cancer cells after F. nucleatum infection. B: Relative expression of NEAT1 in colorectal cancer cells after si-NEAT1 transfection. ***P<0.001 compared with the control group.
2.5 抑制NEAT1可逆转具核梭杆菌对结肠癌细胞凋亡的影响
流式细胞术结果显示,转染si-NEAT1后2种结肠癌细胞凋亡率显著升高(P<0.01),但与si-NEAT1组相比,si-NEAT1+具核梭杆菌组细胞凋亡率降低(P<0.05,见图6)。蛋白免疫印迹结果显示,转染si-NEAT1后,结肠癌细胞凋亡相关蛋白caspase-3及Bax表达量升高(P<0.001),而Bcl-2表达量降低(P<0.01,见图7)。再次用具核梭杆菌感染后,caspase-3及Bax表达量降低(P<0.01),Bcl-2表达量升高 (P<0.01), 但si-NEAT1+具核梭杆菌组与对照组之间凋亡相关蛋白表达无显著性差异(P>0.05)。结果表明,下调NEAT1表达能够促进结肠癌细胞凋亡,且逆转具核梭杆菌对结肠癌细胞的抗凋亡作用。
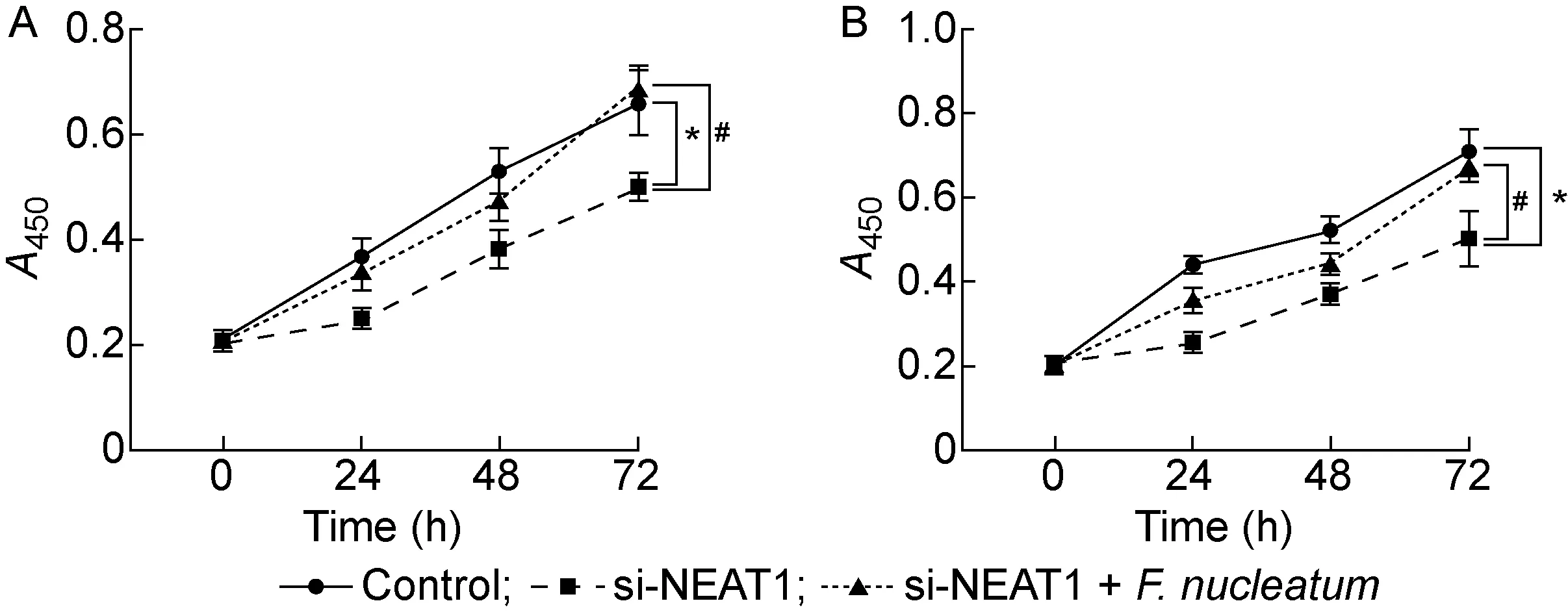
A: HCT116 cells. B: SW480 cells.*P<0.05 compared with the control group. #P<0.05 compared with si-NEAT1 group.

**P<0.01, #P<0.05.
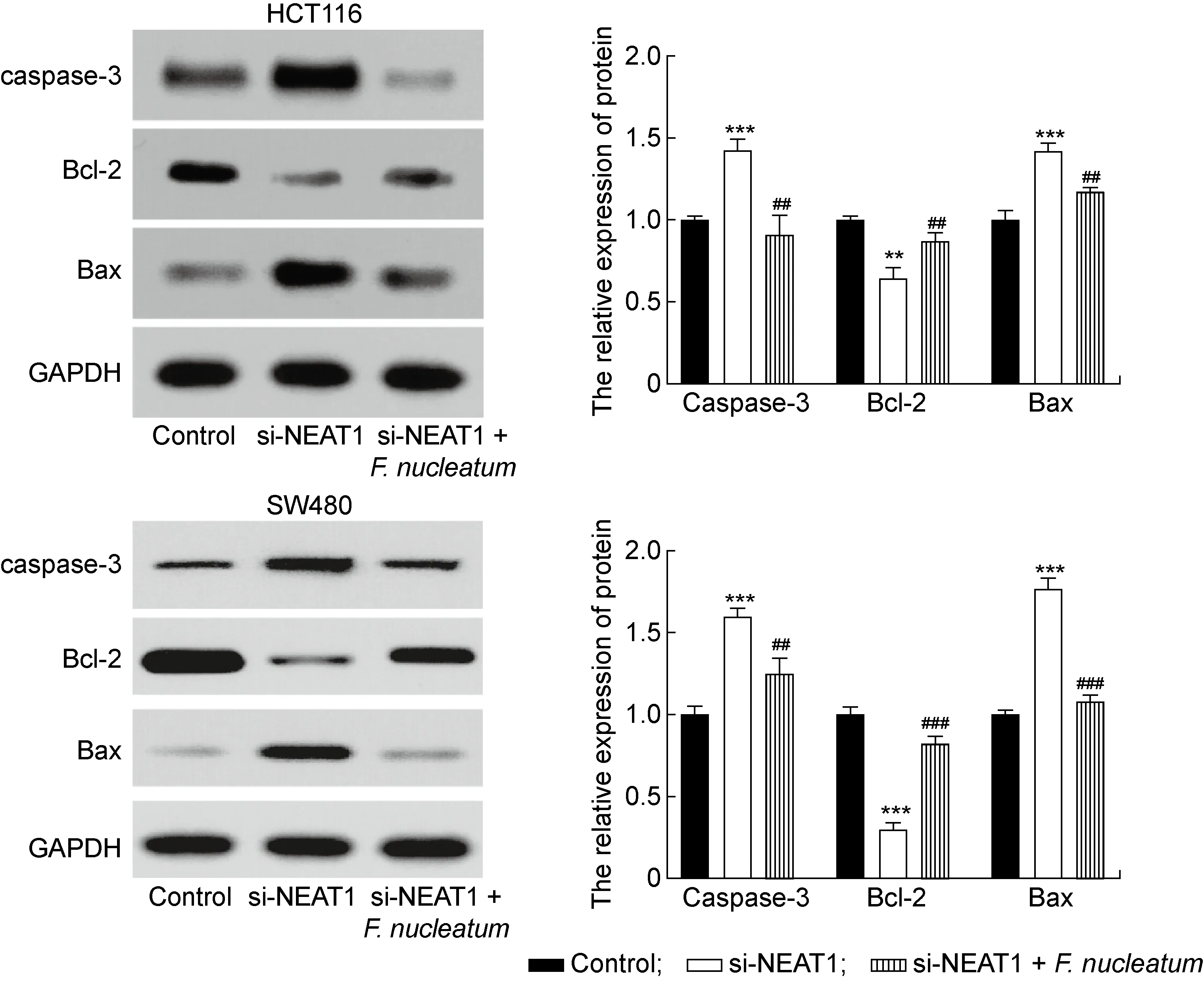
**P<0.01, ***P<0.001 compared with the control group. ##P<0.01, ###P<0.001 compared with si-NEAT1 group.
3 讨论
人类肠道微生物群包含至少100万亿个微生物,在人体健康和疾病中发挥着重要作用,包括结直肠癌[12]。本研究使用具核梭杆菌感染两种结肠癌细胞,发现具核梭杆菌可促进结肠癌细胞增殖并抑制细胞凋亡,这种作用可能是通过靶向激活lncRNA NEAT1产生的。
具核梭杆菌是一种常见的口腔非孢子形成革兰氏阴性厌氧菌,长期以来被认为与牙周病的发展有关[13]。然而,最近的基因组研究提供的证据表明,具核梭杆菌也可能在结直肠癌组织中普遍存在[14]。已有研究发现,具核梭杆菌可通过调节自噬促进结直肠癌的化疗耐药[11]。此外,使用抗生素处理带有结肠癌异种移植的小鼠以消除具核梭杆菌,结果发现在具核梭杆菌减少的同时能抑制癌细胞的增殖和整体肿瘤的生长[15]。本研究采用具核梭杆菌感染结肠癌细胞,发现结肠癌细胞的增殖率上升,凋亡率下降,且能调节凋亡相关蛋白的表达,表明具核梭杆菌对结肠癌有促进作用,与之前的研究结论一致。
lncRNA是一类转录长度超过200个核苷酸但不能进行编码蛋白的RNA[16],参与染色质修饰、转录干扰、转录激活、核转运、选择性剪接、调控原癌基因激活等调控过程,从而在表观遗传、转录或转录后水平调控基因表达[17-18]。lncRNA的功能和异常表达与许多疾病特别是恶性肿瘤的发生和发展有关[19]。例如,lncRNA CYTOR能通过Wnt/β-Catenin信号通路促进结肠癌的转移[20]。lncRNA HOTAIR通过下调miRNA-34a促进结肠癌发展[21]。已有研究表明,NEAT1通过调节miR-495-3p和激活CDK6促进结肠癌的发生[22]。因此,本研究以NEAT1作为研究对象,发现采用具核梭杆菌感染结肠癌细胞后,结肠癌细胞中NEAT1的表达量上升,而沉默NEAT1的表达能够抑制结肠癌细胞增殖并促进结肠癌细胞凋亡。此外,沉默NEAT1表达还可逆转具核梭杆菌对结肠癌细胞的调控作用,表明具核梭杆菌可能是通过靶向激活NEAT1,从而促进结肠癌的发展。
综上所述,本研究发现具核梭杆菌通过靶向激活lncRNA NEAT1促进了结肠癌细胞的增殖,并抑制结肠癌细胞的凋亡,为结肠癌的临床研究提供了理论依据和基础。
