基于聚类分析和主成分分析的不同产地龙船花全草质量评价*
2022-03-03任赛赛张志清潘为高张玉倩解伟伟杨珍珍延雨濛靳怡然
任赛赛,张志清,潘为高,刘 剑,张玉倩,解伟伟,杨珍珍,延雨濛,靳怡然**
(1.河北医科大学第二医院 石家庄 050000;2.河北医科大学药学院 石家庄 050017;3.广西中医药大学药学院 南宁 530001)
龙船花(Ixora chinensisLam.)为茜草科龙船花属植物。龙船花又称卖子木,在《雷公炮炙论》、《新修本草》、《本草纲目》、《千金翼方》等历代古籍中均有记载,其花、叶、茎、根皆可入药,具有清热凉血、活血散瘀、止痛的功效,用于治疗高血压、月经不调、闭经、跌打损伤、疮疡疖肿等[1]。龙船花原产于中国、缅甸和马来西亚。在中国主要分布于福建、广东、中国香港、广西壮族自治区、海南[2]。现代研究表明龙船花具有抗炎镇痛作用[3]。龙船花中含有黄酮类化合物表儿茶素、槲皮素-3-O-α-L-鼠李吡喃糖苷、山萘酚-3-O-α-L-鼠李糖苷、儿茶素、异鼠李素、槲皮素和山柰酚等[4-6];环烯醚萜类化合物京尼平苷酸、ixoroside、ixoside(7,8-dehydroforsythide)等[7];苯丙素类化合物绿原酸和东莨菪内酯等[5-6]。绿原酸具有清除自由基、抗菌消炎、保肝利胆、抑制肿瘤、降血压、降血脂及兴奋中枢神经系统等多种药理作用[8]。东莨菪内酯具有降糖作用[9]。龙船花中主要的药效物质有可能是挥发油、黄酮类、苯丙素类、有机酸类、环烯醚萜类、酚类等成分,包括龙船花脂酸[10]、山柰酚、异鼠李素、东莨菪内酯、熊果酸、齐墩果酸、绿原酸等。这些天然产物不仅结构复杂相似,一些化合物彼此间在双键、羟基、甲基组成上仅存在位置或数量上的细微差异,有的还包含多对同分异构体。目前,龙船花的成分分析方法主要采用滴定分析法、薄层分析法和高效液相色谱法、气相色谱-质谱法(Gas Chromatography-Mass Spectrometer,GCMS)等。通过气相色谱-质谱(GC-MS)联用技术,陈丽君等[11]研究发现,抱茎龙船花挥发油的脂溶性成分主要包含脂肪酸、酯类、芳香酸酯、烷烃类及芳香类化合物。任赛赛等[12]分析了龙船花全草挥发油部分的化学成分。蒋珍藕等[13]分析了龙船花花朵中挥发油的化学成分。李文琪等[14]建立了可以同时鉴别和测定龙船花中的熊果酸和齐墩果酸的薄层色谱方法和高效液相色谱法。罗统勇[15]建立了东莨菪内酯作为壮药龙船花药材含量测定指标的高效液相色谱法。综上所述,已报道的测定龙船花药材的高效液相色谱法大多只能测定其中1-2种成分的含量,不能准确反映药材的质量,而对于龙船花药材质量的研究也多以挥发油为主。为保证用药的安全有效,建立一个能准确反映药材全草质量的检测方法非常重要。
中药具有复杂的化学成分,并且配伍药物较多,经常是复方使用,药物作用的特点是多靶点、多层次以及多环节[16]。康念欣等[17]运用多元统计学方法进行了聚类分析和主成分分析,合理地评价了各产地酒黄连药材的质量。课题组前期已开展龙船花全草化学成分及龙船花根的炮制品质量标准研究[10,18]。在此基础上,本研究根据含量测定[19-21]的方法,基于聚类分析和主成分分析方法,选择京尼平苷酸、绿原酸、东莨菪内酯、槲皮素和山柰酚这5种成分作为指标性成分,比较广东、广西壮族自治区、福建、江苏等不同产地间龙船花全草的5种指标性成分的含量差异,以期为龙船花的质量控制,野生与栽培品种的资源拓展及药理作用的物质基础的阐述提供参考。
1 实验材料
1.1 仪器
高效液相色谱仪(Waters e2695型,包括UV型紫外检测器,美国Waters公司);涡旋混合器(XW-80A型,上海医科大学仪器厂);超声波清洗器(RKQ-300型,昆山市超声仪器有限公司,功率300 W,频率40 kHz);高速离心机(R18型,北京白洋医疗器械有限公司);电子分析天平(CPA225D型,德国Sartorius公司);低温冰箱(MDF-U2086S型,日本三洋公司);高速多功能粉碎机(HC-800Y型,武义海纳电器有限公司)。
1.2 材料
18批龙船花全草药材为2020年10月-2021年4月采购自广西壮族自治区防城港、广东广州、江苏宿迁等地,采购地点及编号详见表1。经广西中医药大学韦松基教授和朱意麟实验师鉴定为茜草科龙船花属植物龙船花Ixora chinensisLam.的全草。槲皮素对照品(中国食品药品检定研究院,批号:100081-200907),绿原酸、京尼平苷酸、山柰酚、东莨菪内酯对照品(南京广润生物制品有限公司,批号分别为GR-137-200303、GR-137-200319、GR-137-200526、GR-137-200702)。
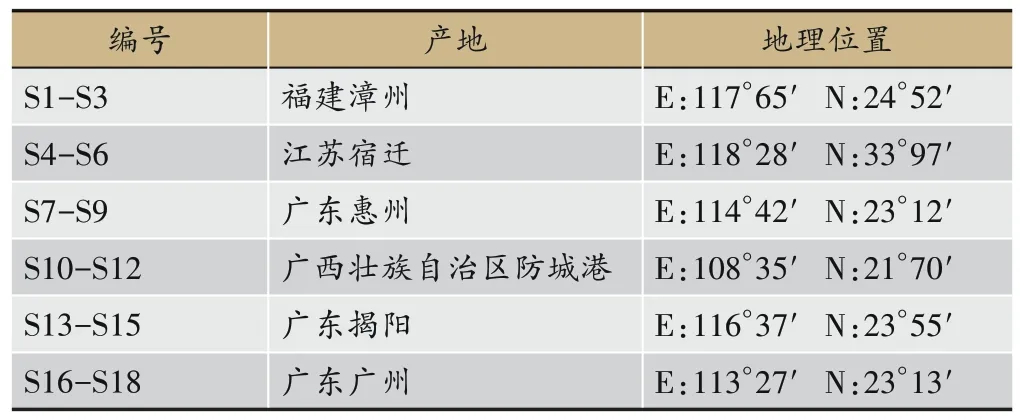
表1 样品信息
1.3 试剂
甲醇(美国Fisher公司,色谱纯);乙腈(美国Fisher公司,色谱纯);甲酸(上海阿拉丁生化科技有限公司,色谱纯);蒸馏水(屈臣氏)。其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件
Diamonsil-C18柱(4.6 mm×250 mm,5 µm);流动相:0.05%甲酸水溶液(A)-乙腈(B)溶液,梯度洗脱,梯度洗脱(0-18 min,95%-84% A;18-22 min,84%-80% A;22-33 min,80%-65% A;33-45 min,65%-50% A;45-47 min,50%-70% A;47-50 min,70%-95% A)。检测波长268 nm(0-12 min,检测京尼平苷酸)、344 nm(12-37 min,检测绿原酸、东莨菪内酯)、350 nm(37-41 min,检测槲皮素)、254 nm(41-50 min,检测山柰酚),柱温25℃;体积流量1.0 mL·min-1;进样量20 µL。龙船花药材供试品及对照品色谱图,如图1所示。
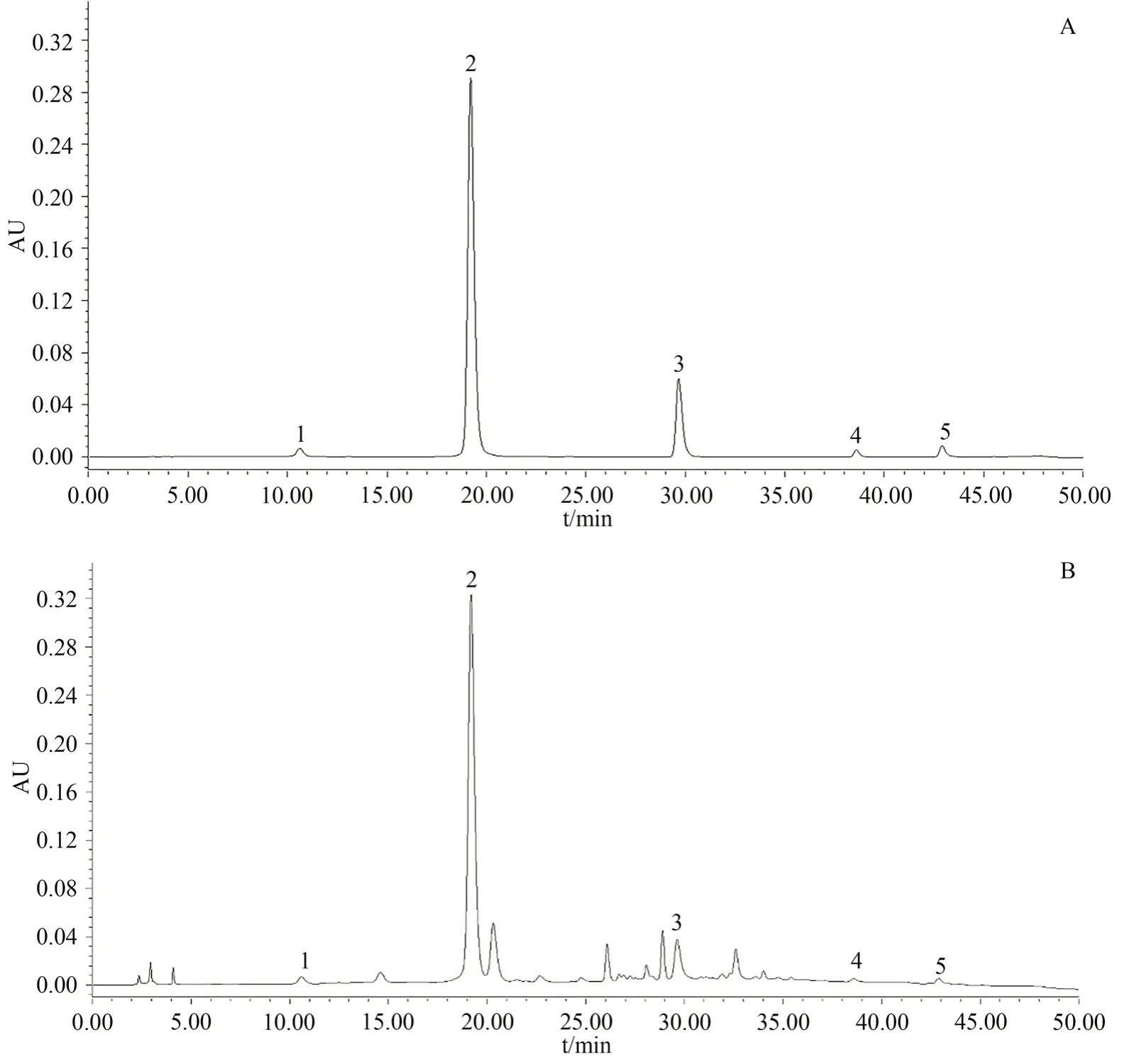
图1 混合对照品(A)及龙船花供试品(B)色谱图
2.2 对照品溶液的制备
精密称定干燥至恒重的京尼平苷酸、绿原酸、东莨菪内酯、槲皮素、山柰酚对照品适量,置于10 mL量瓶中,加甲醇定容,制得质量浓度依次为218、364、44、10、20 µg·mL-1的对照品母液。取对照品母液,逐级稀释,得到各系列浓度混合对照品溶液,于4℃冰箱保存备用。
2.3 供试品溶液的制备
称取干燥的龙船花粉末约1.0 g(精密称定至所取重量的千分之一),精密加入100%甲醇25 mL,称重,密塞,静置30 min,超声40 min(功率300 W,频率40 kHz),放置冷却后,用甲醇补足减失的重量,摇匀,进样前经0.22 µm微孔滤膜滤过,制得供试品溶液。
2.4 方法学考察
2.4.1 线性关系考察
精密吸取各系列浓度的混合对照品溶液。在“2.1”项色谱条件下进样20 µL,记录色谱峰面积。以峰面积为纵坐标(Y),对照品质量浓度为横坐标(X),进行线性回归,结果见表2。

表2 各成分线性关系
2.4.2 精密度试验
称取龙船花粉末1份(S8),按“2.3”项下制备供试品溶液,在“2.1”项色谱条件下,连续进样6次,测得京尼平苷酸、绿原酸、东莨菪内酯、槲皮素、山柰酚峰面积RSD分别为1.7%、1.9%、2.3%、2.4%、1.8%,表明仪器精密度良好。
2.4.3 重复性试验
称取龙船花粉末6份(S8),按“2.3”项下制备供试品溶液,按照“2.1”项色谱条件进样,记录京尼平苷酸、绿原酸、东莨菪内酯、槲皮素、山柰酚的峰面积。计算京尼平苷酸、绿原酸、东莨菪内酯、槲皮素、山柰酚质量浓度的RSD分别为2.8%、2.9%、2.9%、2.1%、2.7%。
2.4.4 稳定性试验
称取龙船花粉末(S8)约1 g,按“2.3”项下制备供试品溶液,室温下放置0、2、4、8、12、24 h,在“2.1”项色谱条件下进样测定,测得京尼平苷酸、绿原酸、东莨菪内酯、槲皮素、山柰酚的峰面积RSD分别为1.6%、1.8%、1.7%、1.8%、1.5%。表明该龙船花样品24 h内稳定性良好。
2.4.5 加样回收率试验
称取6份已知成分含量的龙船花粉末(S8),每份约0.5 g,精密加入混合对照品适量,按“2.3”项下制备供试品溶液,在“2.1”项色谱条件下进样,计算得到京尼平苷酸、绿原酸、东莨菪内酯、槲皮素、山柰酚的平均加样回收率分别为98.54%、93.76%、99.54%、97.98%、99.91%,RSD分别为0.66%、1.29%、1.24%、1.47%、0.78%,表明该方法准确可靠。
2.5 含量测定
分别取18批样品,按“2.3”项下制备供试品溶液,在“2.1”项色谱条件下进行含量测定,记录京尼平苷酸、绿原酸、东莨菪内酯、槲皮素、山柰酚的峰面积,计算5种成分的含量。结果见表3。
表3 各成分含量测定结果(±s,n=3,mg·g-1)

表3 各成分含量测定结果(±s,n=3,mg·g-1)
产地S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 S12 S13 S14 S15 S16 S17 S18京尼平苷酸2.193±0.008 2.148±0.013 2.165±0.017 1.817±0.004 1.601±0.017 1.792±0.009 2.072±0.023 2.813±0.031 2.746±0.005 2.759±0.003 3.413±0.049 2.831±0.065 2.642±0.032 2.965±0.021 2.807±0.018 2.991±0.007 3.362±0.039 3.281±0.004绿原酸4.862±0.027 4.261±0.020 4.462±0.024 4.358±0.027 3.576±0.098 4.323±0.082 2.014±0.020 1.789±0.041 1.894±0.029 3.999±0.025 4.151±0.050 4.067±0.046 2.829±0.055 3.149±0.044 3.152±0.053 2.786±0.070 3.165±0.030 2.943±0.070东莨菪内酯0.623±0.015 0.593±0.014 0.618±0.019 0.429±0.010 0.313±0.009 0.364±0.005 0.228±0.003 0.160±0.003 0.192±0.004 0.287±0.002 0.221±0.005 0.242±0.004 1.001±0.023 1.081±0.030 1.013±0.030 0.599±0.001 0.667±0.015 0.620±0.009槲皮素0.017±0.001 0.016±0.000 0.013±0.000 0.010±0.000 0.013±0.000 0.014±0.000 0.011±0.000 0.010±0.000 0.013±0.000 0.013±0.000 0.011±0.000 0.011±0.000 0.029±0.001 0.042±0.001 0.043±0.001 0.023±0.000 0.021±0.000 0.025±0.001山柰酚0.051±0.001 0.091±0.002 0.070±0.001 0.059±0.001 0.053±0.001 0.058±0.001 0.107±0.001 0.090±0.002 0.105±0.003 0.107±0.002 0.101±0.002 0.111±0.003 0.048±0.001 0.039±0.001 0.040±0.001 0.050±0.000 0.053±0.002 0.051±0.001
2.6 不同产地龙船花全草聚类分析
使用SPSS 20.0软件,对18批不同产地龙船花全草样品的京尼平苷酸、绿原酸、东莨菪内酯、槲皮素、山柰酚的含量进行了系统聚类分析,结果见图2。18批样品一共分为3大类,其中S7-S12为第1大类,主要为广西壮族自治区防城港和广东惠州产样品,该2产地各批次药材均为野生品种,主要生长于山地,其受到日照、温度、生长年限、土壤等影响,与其他产地的栽培品种含量产生了差异,其总体含量不如栽培品种含量高;S1-S6为第2大类,主要为福建漳州和江苏宿迁产地样品,该2产地主要位于中亚热带季风常绿阔叶林地带,较其他产地纬度偏高,其中绿原酸和山柰酚含量较高,以福建漳州产地(S1)绿原酸含量最高为4.862 mg·g-1。S13-S18为第3大类,主要集中在广东揭阳和广东广州地区,属于南亚热带季风常绿阔叶林地带,其中京尼平苷酸、东莨菪内酯和槲皮素含量较高。聚类后不同类群的龙船花全草中各成分平均含量比较见表4。结果表明各类群的含量均存在显著性差异(P〈0.05)。
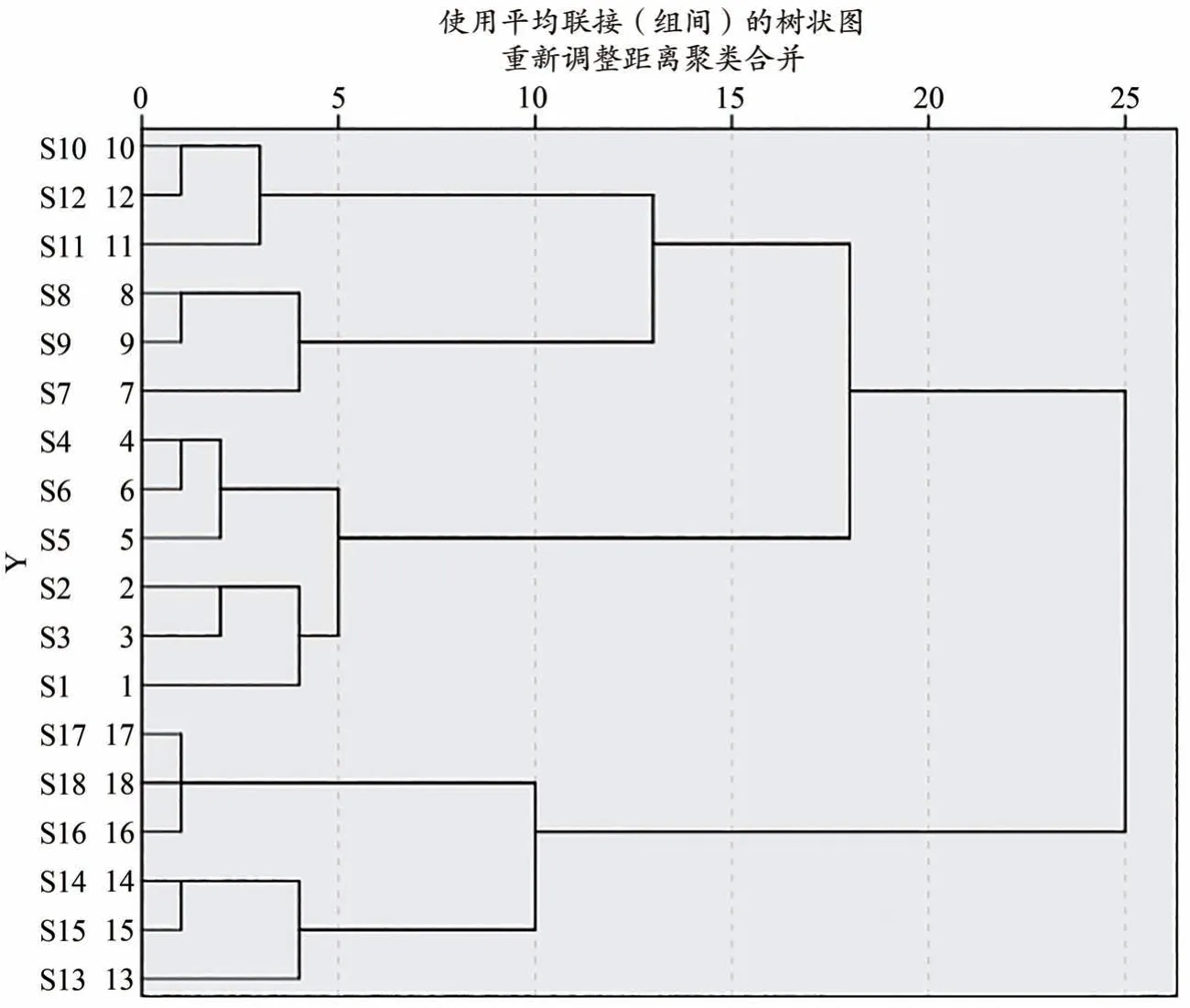
图2 不同产地龙船花全草的聚类分析图
表4 聚类后3类产区全草中各成分平均含量比较(±s)

表4 聚类后3类产区全草中各成分平均含量比较(±s)
注:同一行不同小写字母表示P〈0.05差异显著。
化合物京尼平苷酸绿原酸东莨菪内酯槲皮素山柰酚含量(mg·g-1)第1类(S7-S12)2.772±0.426a 2.986±1.934b 0.222±0.043c 0.012±0.001b 0.104±0.007a第2类(S1-S6)1.952±0.249b 4.307±0.417a 0.490±0.138b 0.014±0.002b 0.637±0.015b第3类(S13-S18)3.008±0.274a 3.004±0.174b 0.830±0.223a 0.030±0.010a 0.047±0.006c
综上所述,药材质量较好的为广东揭阳和广东广州地区,与传统认为的道地产地一致,福建和江苏产龙船花质量次之。通过含量测定及聚类分析结果可以看出,第1类地区的样品有效成分含量较低,有些有效成分可能随着药材生长年限的增加反而逐渐降低,提示龙船花药材并非生长年限越长质量越好,其需要合适的采收时间。
2.7 不同产地龙船花全草主成分分析
2.7.1 特征值和方差贡献率
采用SPSS 20.0软件,依据主成分的特征值和贡献率,对不同产地的18批龙船花药材进行主成分分析。KMO检验和Bartlett检验用于验证数据是否适合进行主成分分析[22],结果得到不同产地龙船花全草的KMO度量值为0.602,Bartlett检验法结果P〈0.001,均符合要求。由表5可知,前3个主成分的累积方差贡献率达到93.916%(〉80%),可代表龙船花药材中5个有效成分的大部分信息内容。因此可将这3个作为主成分用于18批龙船花样品进行质量评价。5个有效成分含量的碎石图见图3。各变量对前3个主成分的贡献可用初始因子载荷矩阵和公共因子载荷散点图来表示(表6,图4),东莨菪内酯、槲皮素在第一主成分上有着较高的载荷,这说明第一主成分主要反映东莨菪内酯、槲皮素的信息;京尼平苷酸、山柰酚在第二主成分上有着较高的载荷,这说明第二主成分主要反映京尼平苷酸、山柰酚的信息;绿原酸主要在第三主成分上有着较高的载荷,这说明第三主成分主要反映绿原酸的信息。

表5 不同产地龙船花全草的主成分特征值和方差贡献率
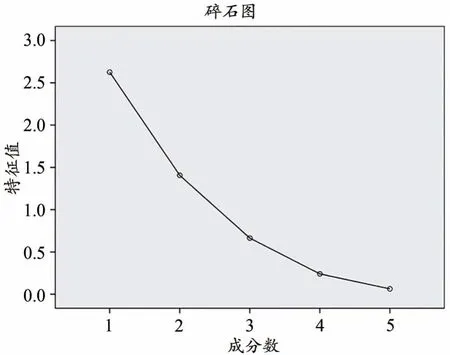
图3 不同产地龙船花全草的主成分碎石图

表6 不同产地龙船花全草的初始因子载荷矩阵
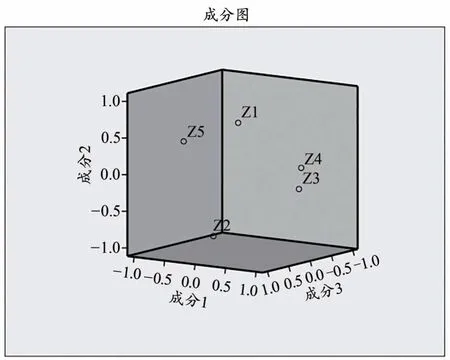
图4 不同产地龙船花全草的主成分载荷散点图
2.7.2 龙船花全草药材综合评价
将龙船花全草5种药效成分含量的标准化值代入以下公式,用3个主成分对各样品进行综合评价,其综合评价函数为:
Z1、Z2、Z3、Z4、Z5分别为京尼平苷酸、绿原酸、东莨菪内酯、槲皮素、山柰酚标准化后的变量,以F1、F2、F3三个主成分的得分贡献率为标准,对主成分得分进行加权平均,得到综合得分(F),综合得分排序结果详见表7(综合得分反应龙船花药材中有效成分的统计质量,得分越高表明统计质量越好)。排名第一者为S14,排名第二者为S15,排名第三者为S13,排名第四到第十分别为S18、S17、S16、S1、S8、S9、S11,可见排名前十中80%的供试品为广东地区龙船花药材。总体来说,属于南亚热带季风常绿阔叶林地带的广东各地区的龙船花全草质量较好,与其他地区的龙船花有一定差异,这与上述聚类分析的差异性结果相一致。
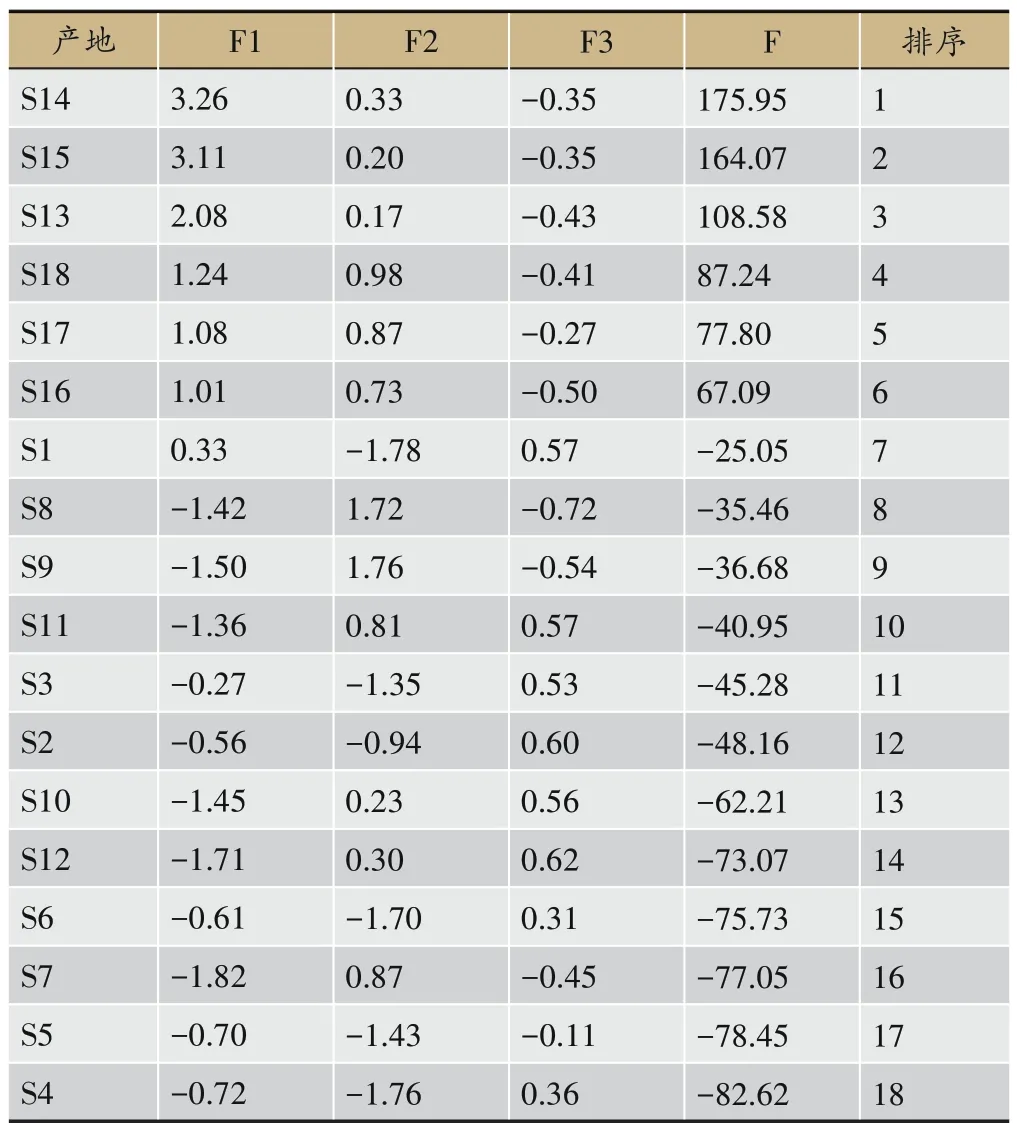
表7 不同产地龙船花全草的主成分值、综合得分及排序表
3 讨论
中药的显著特点是其成分具有多样性和复杂性,无论是单味药还是复方,都是多种化学成分的一个集合体,故以单一指标成分控制中药质量显然不足以表明其整体信息。而多指标成分同时进行定量,可准确控制其质量,以保证有效性成分的稳定性和其药理活性[22]。本研究分别对0.05%甲酸水、0.1%磷酸水、0.1%甲酸水等多种流动相进行了比较研究,发现当流动相为乙腈-0.05%甲酸水时,梯度洗脱,各色谱峰在较短的时间达到完全分离。通过对不同的提取溶剂100%乙醇、100%甲醇、70%甲醇、80%甲醇进行了考察对比,乙醇作提取溶剂时,所得色谱峰与甲醇提取色谱峰差距不太大,考虑到乙醇比甲醇易挥发,所以选择不易挥发的甲醇为提取溶剂;不论选择100%、80%、70%甲醇作为提取溶剂,有效成分含量均较高、差异不明显。基于100%甲醇在-20℃冰箱易于存放,解冻迅速,操作简便,便于保存样品,故选择100%甲醇为提取溶剂。对于龙船花全草药材用回流提取和超声提取时,甲醇溶液回流提取1 h比超声提取效果略优,但整体差别不大,考虑到操作简单,节省资源等方面,选择了超声提取。检测波长均选择了各物质的最强吸收波长,并且基线平稳,268 nm(0-12 min,检测京尼平苷酸)、344 nm(12-37 min,检测绿原酸、东莨菪内酯)、350 nm(37-41 min,检测槲皮素)、254 nm(41-50 min,检测山柰酚)。
本项研究中,我们对福建漳州、江苏宿迁、广东惠州、广西壮族自治区防城港、广东揭阳、广东广州6个产地从2020年10月-2021年4月的18批次龙船花全草进行了检测。运用HPLC法测定了18批样品药材中京尼平苷酸、绿原酸、东莨菪内酯、槲皮素、山柰酚5种活性成分的含量,并使用聚类分析和主成分分析方法分析了5个有效成分的含量测定结果。通过主成分分析得到各批样品的综合得分排名,得分越高,表明药材质量越好。由各药材的综合排名可知,在排名前十的样品中,南亚热带季风常绿阔叶林地带的广东地区的样品占80%,相对于来自其他产地的市售龙船花全草药材,质量总体较好。这与聚类分析所得结果一致,提示药材生产应考虑产地的影响。综上所述,基于聚类分析方法和主成分分析法测定不同产地龙船花全草中有效成分的含量,可为龙船花种植、栽培和质量评价提供依据。
