母牛分枝杆菌疫苗联合生长激素改善AIDS患者免疫重建不良的效果研究*
2022-03-03曾琬舒贾露露罗舒文何茂锐
曾琬舒,贾露露,廖 兵,罗舒文,黄 敏,潘 菁,何茂锐△
(1.重庆市第九人民医院全科医学科,重庆 400700;2.重庆医科大学第二临床学院,重庆 400010;3.重庆市第九人民医院检验科,重庆 400700;4.重庆市第九人民医院感染科,重庆 400700)
获得性免疫缺陷综合征(AIDS)主要的治疗方式为高效抗逆转录病毒治疗(HAART),HAART通过提高机体免疫细胞CD4+T细胞数量,降低患者体内的病毒复制量,从而改善AIDS患者免疫缺陷功能,提高生活质量,延长生命。前期研究显示,经HAART治疗后,AIDS患者CD8+及调节性T细胞(Treg)比例均显著降低[1]。但是,不同个体存在一定差异性。过去有报道称,在规律接受HAART治疗的患者中,约20%病毒抑制(<50 copies/mL)的患者体内CD4+T细胞数量增加不明显,免疫功能不能有效重建,这种现象称为免疫重建不良[2-3]。免疫重建不良患者会增加机会性感染、心血管疾病、肿瘤等疾病的发生率和致死率[4-7]。对于改善AIDS患者的免疫重建不良状态,临床上还没有成熟有效的治疗方法。已提出的干预措施包括:生长激素疗法[8]、免疫抑制剂疗法[9]、细胞因子疗法[10-11]等。生长激素疗法存在一定疗效,但费用贵;免疫抑制剂疗法、细胞因子疗法在安全性、疗效上尚待确认。母牛分枝杆菌的菌苗富含与结核分枝杆菌相似的共同抗原,是一种良好的免疫调节剂,具有双向免疫调节功能,能促进T淋巴细胞转化、增殖,释放出各种淋巴因子,显著改善患者的细胞免疫功能,增强机体抵抗力,且能有效抑制结核分枝杆菌等感染引起的病理性损伤[12-13]。前期研究已发现,母牛分枝杆菌疫苗能提高无症状期人类免疫缺陷病毒(HIV)感染者体内CD4+、CD4+/CD8+,从而增强其细胞免疫功能[14]。本研究采用母牛分枝杆菌疫苗来提高AIDS患者免疫功能,改善其免疫重建不良。现报道如下。
1 资料与方法
1.1一般资料 选取2018年7—12月重庆市第九人民医院感染科门诊就诊的AIDS患者160例作为研究对象。患者年龄18~70岁,平均年龄为(23.0±2.5)岁。随机将患者分为A~D组,每组40例,其中25例试验对象在随访过程中因出现严重不良反应、更改治疗方案、随访脱落、HIV-RNA定量大于103 copies/mL等原因退出研究,试验最终纳入135例患者(A组35例、B组33例、C组32例、D组35例)。研究方案获得医院伦理委员会批准,伦理审查批文批号为院2018(002)号,患者均知情同意。纳入标准:不限男女、职业、婚否,文化程度初中及以上;HAART治疗3年后HIV-RNA定量小于103 copies/mL,CD4+T细胞计数小于500/μL,CD4+T细胞计数大于50/μL。排除标准:(1)正在或入组前1个月内参加其他药物临床试验者;(2)合并未控制的严重机会性感染;(3)合并颅内进行性损伤,合并血糖异常、自身免疫性或血液系统疾病、早期肝硬化或恶性肿瘤;(4)处于备孕、孕期或哺乳状态;(5)肝、肾功能异常;(6)存在语言沟通不畅或者智力不全;(7)不能良好配合或理解治疗内容。
1.2方法
1.2.1治疗方法 4组患者均给予48周治疗。A组采用母牛分枝杆菌疫苗(安徽龙科马生物制药有限公司,国药准字S20010003)22.50 μg肌肉注射治疗,2周1次;B组采用重组人生长激素(长春金赛药业有限公司,国药准字S20050024)15 IU肌肉注射治疗,每周1次;C组采用安慰剂治疗;D组采用母牛分枝杆菌疫苗(同A组)+重组人生长激素(同B组)肌肉注射治疗。
1.2.2观察指标 分别于治疗前、治疗后、疗程结束后12周通过流式细胞仪及酶联免疫吸附试验(ELISA)检测患者静脉血纯真T细胞、调节性T细胞(Treg)、总CD4+T细胞、Th1细胞、Th2细胞、白细胞介素-7(IL-7)细胞因子水平变化,并跟踪随访每个患者继发感染情况,如卡氏肺孢子虫肺炎(PCP)、结核、真菌感染等。

2 结 果
2.14组治疗前后各免疫细胞水平比较 A组、B组、D组患者治疗后体内CD4+T细胞、Th1细胞、纯真T细胞水平增加,IL-7细胞因子、Treg、Th2细胞水平下降,差异均有统计学意义(P<0.05);A组疗程结束后12周未出现反弹。与C组比较,A组患者治疗后体内CD4+T细胞、Th1细胞、纯真T细胞水平增加,Treg、Th2细胞、IL-7细胞水平下降,差异均有统计学意义(P<0.05);与B组比较,A组患者治疗后仅Th1细胞水平比较差异有统计学意义(P<0.05);A组与D组治疗后各项指标比较差异均无统计学意义(P>0.05)。见表1、2。
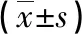
表1 各组治疗前后体内CD4+T细胞、Th1、Th2水平比较
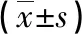
续表1 各组治疗前后体内CD4+T细胞、Th1、Th2水平比较
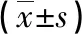
表2 各组治疗前后体内Treg、纯真T细胞、IL-7水平比较
2.2各组随访情况 对每例患者跟踪随访至疗程结束后12周,发现A组、D组无继发感染(PCP、真菌、结核),B组继发感染1例,C组继发感染5例。
3 讨 论
免疫重建不良与HAART治疗前AIDS患者体内CD4+T水平有关,其水平越低越容易导致免疫重建不良发生。本研究结果显示,母牛分枝杆菌疫苗可能提升AIDS患者CD4+T水平,改善患者免疫重建功能,且停药后CD4+T水平不会下降,还有一定程度的提升,但其具体作用机制目前尚不清楚。
在T细胞稳态的维持中,IL-7具有较为关键的作用,而IL-7受体决定了IL-7的反应性。相关研究发现,AIDS患者体内IL-7水平越高,其体内CD4+T细胞水平越低,并进一步使IL-7受体水平下降、IL-7水平升高,高水平的IL-7和低表达的IL-7R致使纯真CD4+T细胞数量下降,从而引起免疫重建不良[15]。根据上述研究,作者推测母牛分枝杆菌疫苗可能通过降低IL-7水平来提升患者体内CD4+T细胞水平,从而改善AIDS患者免疫重建不良情况。
有研究发现,AIDS免疫重建不良患者中,HIV特异性免疫抑制功能降低,Treg比例较高。Treg水平越高,其纯真CD4+T细胞水平越低,两者比值越高[16]。由此推测,Treg不是抑制纯真CD4+T细胞的免疫活化,而是对其增殖起到较大的抑制作用。根据上述研究,作者推测母牛分枝杆菌疫苗可能降低Treg水平,导致其抑制CD4+T细胞增殖作用减弱,从而改善AIDS患者免疫重建不良。
胸腺输出CD4+T细胞功能越好,经HAART治疗后患者CD4+T细胞恢复效果越佳[8]。已有研究证实,高比例纯真T细胞会减少CD4+T细胞再生不良[17-19]。研究中通常以纯真T细胞数目、CD31、TREC等代表胸腺输出功能评价指标。成人患者经HAART治疗后,其纯真CD4+T细胞数目逐渐恢复,胸腺输出功能快速而持续地增加,表明成人胸腺对其免疫重建具有辅助功能[8]。治疗前纯真T细胞比例越高,其亚群恢复越快,CD31表达水平稳步上升,免疫重建效果越佳[20]。根据上述研究,作者推测母牛分枝杆菌疫苗可能提升AIDS患者体内纯真T细胞水平,增加CD4+T细胞水平,从而改善AIDS患者免疫重建不良情况。
目前公认Th1/Th2细胞比例的动态平衡维持着机体的正常状态,一旦发生失衡可能会使机体向疾病状态发生偏移。一旦机体感染HIV,会造成体内CD4+T淋巴细胞减少,产生异常抗体,从而导致机体细胞免疫和体液免疫失衡。Th2型细胞因子在AIDS患者体内比例较高,提示AIDS发展可能与机体免疫应答由Th1型向Th2型的转变有关。根据上述研究,作者推测母牛分枝杆菌疫苗可能通过降低AIDS患者Th2比例,提升Th1水平,使Th1/Th2向正常的动态平衡趋势发展,从而调节机体AIDS患者体内Th1/Th2细胞平衡,改善其免疫重建不良。但具体下调Th2细胞、上调Th1细胞作用机制不清楚。
综上所述,母牛分枝杆菌疫苗可一定程度改善AIDS患者的重建免疫功能不良,疗效与生长激素相当,但价格更便宜,故而为改善AIDS患者免疫重建功能不良提供了一种新的治疗方法,值得进一步探索其改善免疫重建的具体机制及常规治疗方法。
