花烟草NaD1基因的表达及其启动子序列分析
2022-03-03龚伟伟赵懿琛罗显麟杨玲玲赵德刚
龚伟伟,赵懿琛,*,罗显麟,杨玲玲,赵德刚
(1.贵州大学 茶学院,山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳 550025; 2.贵州大学 药学院,山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳 550025; 3.贵州大学 生命与科学学院,山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳 550025; 4.贵州省农业科学院 国家DUS中心贵阳分中心,贵州 贵阳 550006)
花烟草()是茄科,烟草属有限的多年生草本植物,其植株紧凑,连续开花,常被用作绿化植物。NaD1(defensin 1)蛋白是一类最先在花烟草中发现的植物防御素,与大多数防御素不同,它是作为前体产生的,除了具有典型的分泌信号肽和47~49个氨基酸的中央防御素结构域外,还含有27~33个氨基酸的C-末端结构域,其表达主要是花特异的,并且在花发育的早期阶段最为活跃,防止花烟草生殖组织免受病原菌的侵害。研究发现,茄科类植物中的栽培烟草的花防御素FST和番茄的TPP3也具有类似的C-末端结构域,可引导蛋白至液泡中沉积,然后在分泌途径的运输过程中或之后被移除,而矮牵牛的花防御素PPT和番茄的TGAS118缺乏此结构域。成熟的NaD1蛋白具有47个氨基酸残基,在极端的pH和温度下也保持稳定,因为其富含半胱氨酸,且含有由3个反向平行的β-折叠和1个α-螺旋组成的αβ基序(CSαβ基序)。NaD1蛋白属于阳离子抗菌肽(CAPs)家族的一员,研究发现,其可通过二聚作用和依赖细胞壁途径渗透菌丝,进入细胞质并诱导ROS和NO产生,从而对尖孢镰刀菌()、黄萎病菌()、白色念珠菌()和新型隐球菌()等真菌产生杀伤作用;也可特异地与细胞质膜的PIP2结合形成一个拱形的低聚复合物,通过非凋亡的膜溶解过程诱导人上皮宫颈癌(HeLa)、白血病T细胞(Jurkat)、恶性黑色素瘤(MM170)等哺乳动物肿瘤细胞死亡,并且不会对人体细胞产生伤害,有望开发为抗癌药物。
启动子是位于结构基因5′端上游的DNA序列,能活化RNA聚合酶,使之与模板DNA准确地结合并具有转录起始的特异性。真核生物启动子分为核心启动子区和上游序列区两个区域,核心启动区含有转录起始位点和TATA-box 等顺式作用元件;上游序列区含有不同的调控表达元件,对基因转录的效率、特异性和活性起关键作用,确保基因转录的有效性和精确性。启动子是基因的重要元件,对于调控基因转录和表达非常关键,也是DNA重组技术中构建表达载体的重要组成部分。热不对称交错PCR(TAIL-PCR)、基因组DNA步移、反向PCR等是常见的几种启动子克隆方法。如今,越来越多的启动子分析数据库和软件为我们研究启动子功能提供了便利,通过在线软件预测启动子顺式作用元件,组织化学染色、5′端缺失分析、荧光分析、酵母单杂交和染色质免疫共沉淀等是研究启动子功能的常用方法。
目前对于1的研究主要涉及蛋白的功能和作用机制,而对其基因表达和启动子功能的研究却鲜有报道。本研究对1基因在花烟草不同组织部分、不同发育阶段叶片以及光胁迫处理后的表达水平进行了分析;对花烟草1基因的上游调控序列进行了克隆,得到其启动子基本元件的完整序列,对其进行生物信息学分析;通过构建连接缺失启动子片段启动GUS基因表达的植物表达载体,遗传转化至花烟草,从而验证启动子的活性,以期为研究1基因的表达调控模式奠定基础。
1 材料与方法
1.1 材料
花烟草()植株来自贵州大学农业生物工程研究院温室。DH5α感受态细胞、农杆菌LBA4404细胞由实验室保存。DNA聚合酶、Fruit-matefor RNA purification、RNAiso Plus、DL2000 Marker、Genome Walking Kit购自TaKaRa公司;High Capacity cDNA Reverse Transcription Kit、SYBR Select Master Mix购自Applied Biosystems公司。
1.2 NaD1基因的表达模式分析
提取花烟草根、嫩茎、嫩叶、花及伸根期、旺长期、成熟期发育阶段的花烟草叶片的总RNA,分别在3株植株取样,用ABI反转录试剂盒反转录成cDNA。以N-actin-F/R引物为对照(引物序列见表1),利用Real-time PCR技术对1基因进行表达量分析。PCR反应体系为:SYBR Premix Ex酶5.0 μL,上下游引物各0.5 μL,cDNA 1.0 μL,ddHO 3.0 μL,终体系为10.0 μL。反应程序为50 ℃孵育2 min;95 ℃预变性2 min;95 ℃变性30 s,60 ℃退火30 s,40个循环,添加熔解曲线。导出数据后,利用绝对定量法对1基因的相对表达量进行统计分析。
1.3 NaD1基因启动子的克隆
本实验参照魏胜华等的CTAB法对花烟草DNA进行提取。根据NCBI上公布的1基因的DNA序列设计引物Na-NaD1-D-F和Na-NaD1-D-R(GeneID:109219036),扩增得到1基因的DNA序列。根据克隆得到的1基因的DNA序列,按照Genome Walking Kit说明书设计3条特异性引物,分别为Na-sp1、Na-sp2和Na-sp3,引物序列见表1。引物合成由英潍捷基(上海)贸易有限公司完成。根据杨玲玲论文中的反应体系和反应条件,通过热不对称交错PCR克隆1基因上游片段。将PCR产物连接至pMDTM19-T Vector上,转化至DH5α进行扩增,经蓝白斑筛选、PCR和d Ⅲ及Ⅰ双酶切鉴定后,送交北京华大基因科技有限公司进行测序。

表1 引物序列
1.4 NaD1基因启动子序列的鉴定和分析
根据测序结果设计特异性引物Na-p-644-F:5′-TCAGGTTATTTACTTTTTGGGG-3′和Na-p-644-R:5′-TGAAGCACAAGGAGCGAG-3′(下划线分别代表Ⅰ和RⅠ酶切位点),引物合成由英潍捷基(上海)贸易有限公司完成。根据Platinum®DNA Polymerase High Fidelity Kit,扩增1基因的上游启动子序列。PCR反应体系为:Platinum酶1.0 μL,10×High Fidelity PCR Buffer 2.5 μL,50 mmol·LMgSO1.0 μL,10 mmol·LdNTP mix 0.5 μL,上下游引物各0.5 μL,花烟草基因组DNA 1.0 μL,ddHO 18.0 μL,终体系为25.0 μL。PCR反应程序为:94 ℃预变性 2 min;94 ℃ 15 s,60 ℃ 30 s,68 ℃ 1 min,5个循环;94 ℃ 15 s,59 ℃ 30 s,68 ℃ 1 min,5个循环;94 ℃ 15 s,58 ℃ 30 s,68 ℃ 1 min,25个循环;68 ℃延伸10 min,12 ℃保存。
将扩增产物胶回收并连接至pTMD-19T载体上,送交北京六合华大基因科技有限公司进行测序。使用Blast、DNAMAN软件将两次测序得到的启动子序列进行比对,然后对序列进行Plant CARE在线分析启动子元件,确定其含有的启动子元件。
1.5 NaD1基因对光元件的响应
根据Lay等的描述,1基因的表达在花发育早期最为活跃。以花始开期的花烟草花为材料,对其进行光照处理0、12、24、48和72 h,暗处理0、12、24、48和72 h,采取不同时间段的花利用Trizol法提取RNA,根据High Capacity cDNA Reverse Transcription Kit反转录为cDNA,以实验室前期筛选出的NaD1-F-60、NaD1-R-177引物(序列见表1)对1基因的表达量进行Real-Time PCR分析。反应体系和程序如1.2节。
1.6 植物表达载体构建
根据得到的启动子序列,委托上海旭冠生物科技发展有限公司合成pNaD1-644和pNaD1-310启动子片段,pNaD1-310包含启动子基本元件TATA-box、CAAT-box及转录因子结合元件。将两段片段分别连接至植物表达载体pCAMBIA1391z的GUS报告基因前,用于驱动其表达。连接产物转入DH5α菌株进行扩增,利用碱裂解法提取质粒进行Ⅰ、RⅠ双酶切验证,用琼脂糖凝胶进行检测。
1.7 农杆菌介导的遗传转化
采用冻融法将两种植物表达载体分别转入农杆菌LBA4404感受态细胞中,通过农杆菌介导的叶盘法分别遗传转化至花烟草中,在筛选培养基中添加的激素有1.0 mg·L的6-BA和0.1 mg·L的NAA,抗生素为20 mg·L的潮霉素(Hyg)。通过筛选得到了抗性幼苗。
1.8 GUS组织化学染色
取抗性幼苗的叶片浸泡于GUS染色液中,37 ℃染色12 h,GUS染色液包括0.1 g X-gluc,2 mL 0.5 mol·LEDTA-Na,39 mL 0.2 mol·LNaHPO,61 mL 0.2 mol·LNaHPO,100 μL 1% Triton X-100,450 μL β-巯基乙醇,ddHO 定容至100 mL。用75%乙醇脱色至浸泡液中没有绿色后拍照记录。
2 结果与分析
2.1 NaD1基因的表达模式分析
对1基因在花烟草不同组织器官及不同生长发育阶段的表达量进行荧光定量分析(图1-A)。结果表明,1基因在花始开期花烟草植株不同组织器官中的表达量差异明显,其在花中的表达量显著高于根、嫩茎、嫩叶中的表达量,约是根的2 000倍,嫩茎的80倍,嫩叶的10倍;在叶中的表达量也达到了根中表达量的近128倍和茎中表达量的近5倍。说明1基因的表达具有组织特异性,在花发育期间,1基因主要在花蕾中表达。1基因在不同发育阶段的叶片中的表达也存在差异,如图1-B所示,叶片中的表达量随着植物的生长发育阶段先增加后下降,在烟草旺长期其表达量达到最大。推测NaD1蛋白可能与保护生殖组织免受一系列潜在病原体的侵害有关。
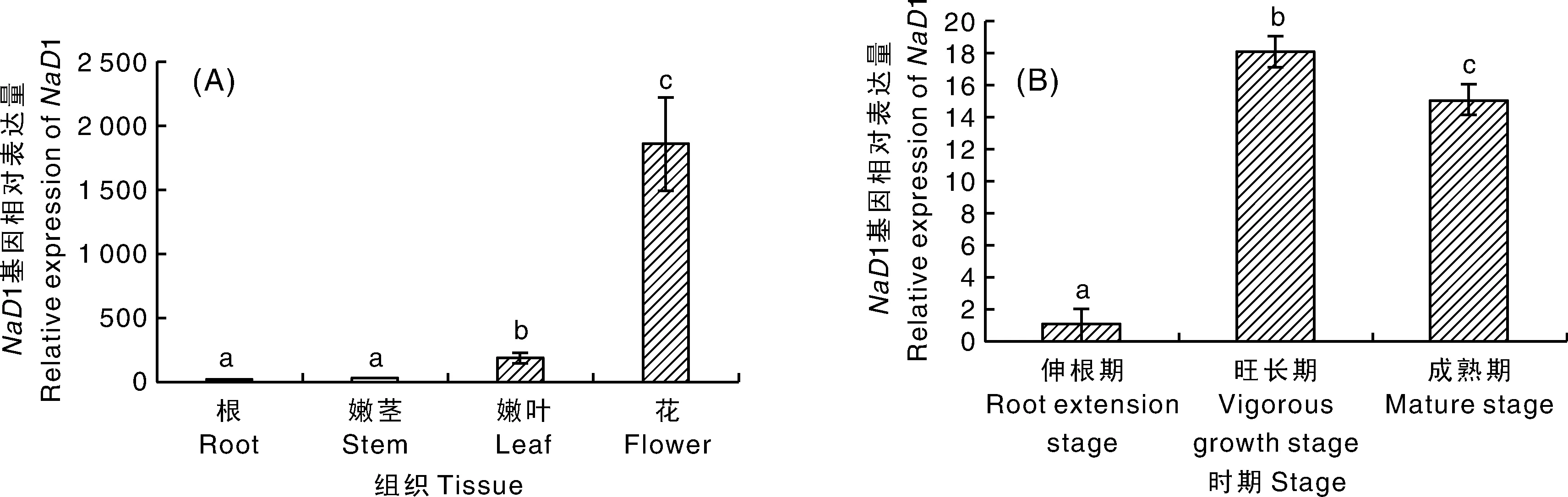
不同数据间没有相同小写字母表示差异显著(P<0.05)。下同。
2.2 NaD1基因启动子的克隆及分析
克隆得到一条大小为644 bp的1基因上游序列,经过与以花烟草基因组DNA为模板扩增的上游序列进行比对,并通过鉴定发现成功扩增1基因启动子序列。利用PlantCARE数据库预测了1基因上游644 bp序列的顺式作用元件,结果如图2和表2所示。1基因启动子元件包含基础启动子区域TATA-box和CAAT-box,还包括MBS和TC-rich repeats等与植物逆境胁迫相关元件;Box Ⅰ和Ⅰ-box等光响应元件;5′UTR Py-rich stretch等高转录水平顺式作用元件。推测该启动子可能具有逆境胁迫的诱导表达特性和光周期诱导表达特异性,为了验证这一推测,对1基因进行了光胁迫响应分析。

表2 NaD1基因5′端调控区顺式作用元件

图2 NaD1基因5′端调控区顺式作用元件
2.3 NaD1基因对光胁迫响应分析
在不同光处理的条件下测定了1基因在花烟草花中的表达量,结果表明(图3):光照条件对1基因在花烟草花中的表达量有显著影响,随着光处理时间的增长而显著增加,随着暗处理时间增长而显著减少,与PlantCARE预测结果相符,说明在光胁迫条件下,1基因的表达受上游启动子元件的调控。
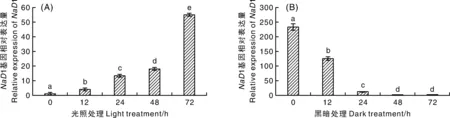
图3 不同光照处理(A)和黑暗处理(B)下NaD1基因在花烟草花中的表达量
2.4 NaD1基因启动子转录活性验证
将构建得到的两个植物表达载体pCAMBIA1391z-pNaD1-644∶∶GUS和pCAMBIA1391z-pNaD1-310∶∶GUS进行双酶切验证,电泳结果显示得到大小在650 bp和300 bp左右的条带(图4-A),与预期得到的644 bp和310 bp条带大小相符,说明所构建的载体为阳性。将两个植物表达载体遗传转化花烟草,对抗性幼苗叶片进行GUS染色分析显示都为阳性(图4-B),说明启动子核心元件TAAT-box、CAAT-box位于片段pNaD1-310中,即-310~-1 bp。
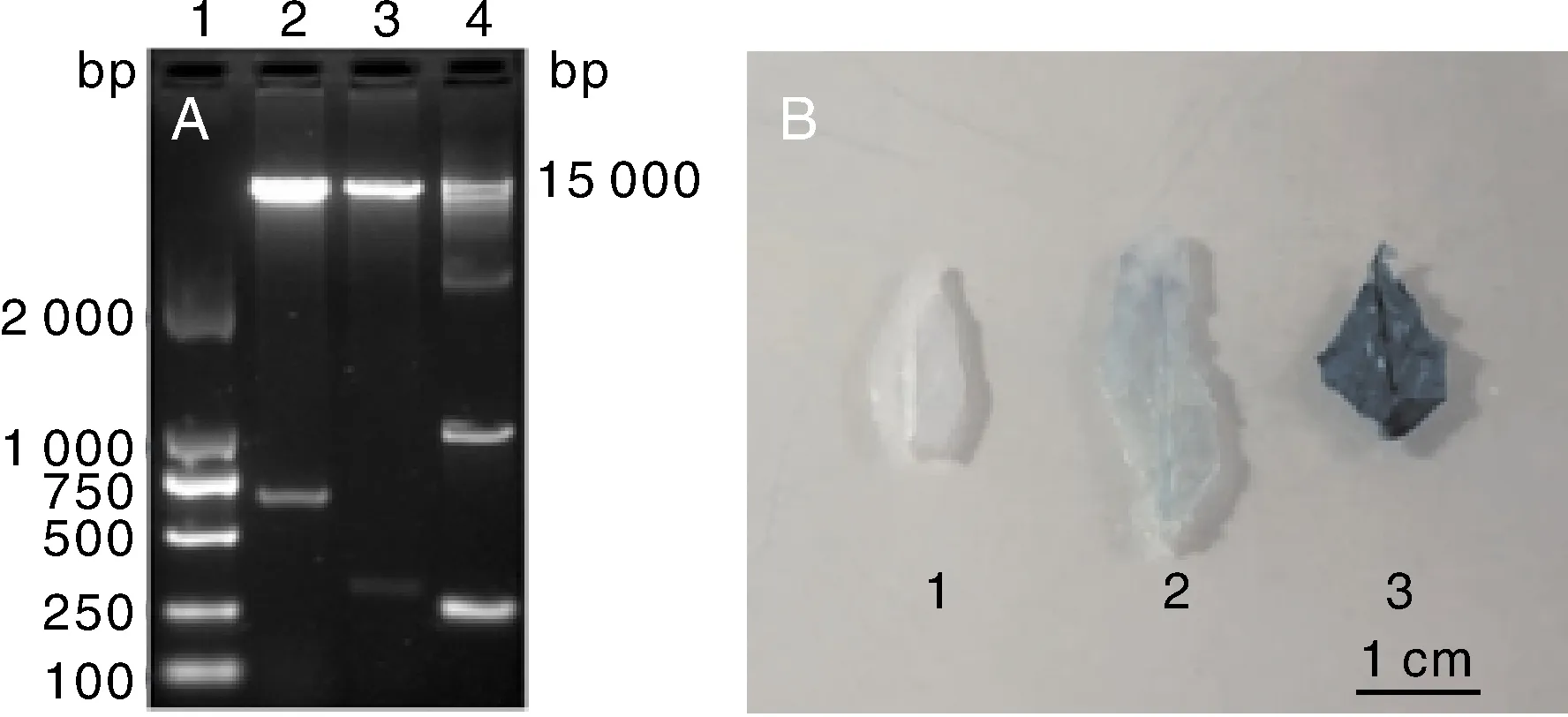
A,重组质粒双酶切琼脂糖凝胶电泳图:1,DL2000 Marker;2,pNaD1-644;3,pNaD1-310;4,15 000 Marker;B,抗性幼苗叶片GUS组织化学染色:1,野生型;2,pCAMBIA1391z-pNaD1-310∶∶GUS;3,pCAMBIA1391z-pNaD1-644∶∶GUS。
3 讨论
NaD1分别与烟草的FST和番茄的TPP3具有98%和63%的氨基酸序列同源性,研究表明,二者在发育早期的花芽中表达量最高,随着花的成熟而大幅降低。本研究基于qRT-PCR技术对1基因在花烟草根、茎、叶和花中的表达量进行了分析,结果表明花中1基因的表达量显著高于根、茎和叶中的表达量,与前期研究相符。Lay等还检测了1基因在花烟草花的不同部位的表达量,发现在花药、雌蕊(柱头和花柱)、子房和花瓣中含量较高,而在花药和花柱的绒毡层、花粉母细胞、传递组织或维管束中未检测到转录本。对1基因在花烟草不同发育阶段的叶片进行表达量分析,结果发现,在叶片中的表达量随着生长发育呈先上升后下降的趋势,在旺长期和成熟期1基因的表达量显著高于伸根期。根据以上研究推测NaD1蛋白主要作为一种保护花蕾免受侵害的植物防御素,开花期前主要在叶片中起到一定的保护作用,而为了了解该基因详细的调控模式,需更深入地对1基因启动子整体结构以及在真菌或昆虫侵染下的表达调控进行探索分析。
启动子中含有重要的顺式作用元件,研究启动子的结构和功能有助于了解该基因的表达调控模式,可在遗传转化调控外源基因表达中起到重要作用。朱鹤等通过PCR克隆了半滑舌鳎结蛋白基因不同长度的启动子片段,并对其进行启动活性分析。结果表明,半滑舌鳎基因 ATG上游长度为667 bp的片段是其核心启动子;周家红等构建了含有2基因5′端不同区域的荧光素酶报告基因质粒,鉴定了具有基础转录活性的最小启动子区域-58/+60。本研究通过热不对称交错PCR成功克隆得到了大小为644 bp的1基因上游序列,利用PlantCARE在线软件对其启动子序列进行分析,发现其含有TATA-box和CAAT-box基础启动子区域,光、乙烯和茉莉酸甲酯响应元件,还含有高转录水平顺式作用元件5′UTR Py-rich stretch等。根据预测结果,对花期花烟草进行光胁迫处理,发现对1基因的表达量确实存在显著影响,与启动子元件的分析结果相对应,但在暗处理后1基因表达量显著降低,表明除光因素外还有其他调控因子在光照条件下对1基因表达的上调产生了作用。通过启动子序列的分析结果未发现有花特异性响应元件,但1基因时空表达分析的结果表明,1基因在花烟草花中特异性表达,叶片中也具有一定的表达量,推测主要与保护花组织免受病原菌的侵害有关。
通过构建两个植物表达载体pCAMBIA1391z-pNaD1-644∶∶GUS和pCAMBIA1391z-pNaD1-310∶∶GUS,将其遗传转化至花烟草并进行GUS染色后发现结果均为阳性,说明启动子核心元件位于1基因上游-310~-1 bp中。以上研究结果为研究1基因的表达调控模式和更高效地利用NaD1蛋白奠定了基础。
