森林土壤微生物与植物碳源的磷脂脂肪酸及其单体同位素研究
2022-03-02姜懿珊孙迎韬罗春玲
姜懿珊, 孙迎韬, 张 干, 罗春玲*
森林土壤微生物与植物碳源的磷脂脂肪酸及其单体同位素研究
姜懿珊1, 2, 3, 孙迎韬1, 张 干1, 罗春玲1*
(1. 中国科学院 广州地球化学研究所 有机地球化学国家重点实验室, 广东 广州 510640; 2. 武汉科技大学 绿色制造工程研究院, 湖北 武汉 430081; 3. 中国科学院大学, 北京 110049)
森林生态系统的土壤微生物群落组成和活性, 是影响生物地球化学循环、有机质代谢和土壤质量的关键因素。磷脂脂肪酸(PLFA)是一类可有效表征活体微生物群落结构的生物标志物, 而其单体稳定碳同位素(13C)水平对土壤微生物植物碳代谢具有独特的指示作用。本次研究以土壤PLFA为对象, 分析了我国位处纬度梯度带上(24°N~47°N)的9个高山森林的土壤PLFA组成、丰度及其13C水平, 以此表征土壤细菌、真菌、革兰氏阳性菌和革兰氏阴性菌4种生物群落的生物量、微生物生物量、微生物的群落结构、植物碳源特征及其与环境因素的关系。土壤中PLFA总量为28.2~253 µg/g, 不同森林土壤中四类微生物群落PLFA含量和PLFA总量以及革兰氏阳性与阴性菌比值等指标存在显著差异(<0.01)。处于相对高纬度–低海拔和相对低纬度–高海拔的森林土壤PLFA的组分相似, 说明其微生物群落结构相似。土壤pH值、总有机碳(SOC)和总氮(TN)与土壤PLFA含量显著相关(<0.01), 年均温、土壤碳氮比和土壤温度是影响土壤微生物群落结构的主要因素(<0.01), 可见森林土壤微生物生物量主要由土壤性质决定, 而微生物的群落结构受气候因素和土壤性质共同影响。森林土壤PLFA的单体13C范围为−35‰ ~ −17‰, 整体上接近C3植物, 说明这些森林土壤中微生物的植物碳源主要来自C3植物。四类微生物群落PLFA和PLFA总量的13C与年均温、年降水量、土壤总有机碳、总氮显著相关(<0.05), 表明土壤微生物对植物碳源的选择可能受到气候因素和土壤肥力的共同影响。
森林土壤微生物; 磷脂脂肪酸; 单体稳定碳同位素; 群落结构; 碳源
0 引 言
森林土壤微生物在森林生态系统中频繁活动, 承担了分解动植物的任务并以此促进生态系统进行能量流动和物质循环(龙健等, 2004)。微生物群落结构和代谢行为可能受到生态系统中不同环境因素影响, 在不同地理气候条件下形成的森林土壤中呈现出多样化的群落分布和代谢特征。森林生态系统环境评价的主要依据之一就是森林中土壤微生物群落组成及其代谢情况, 因为其反映了微生物的生态分布和生物化学特性在土壤各因素影响下的作用情况(郭银宝和许小英, 2006)。土壤微生物可能会通过参与森林植被凋落物的代谢, 对植物生长、养分供给、生物防治、肥力保持和肥料管理等一系列生态进程产生直接或间接影响(White et al., 1979)。土壤微生物分布的差异性, 反映了其对环境的适应能力。受地理气候的影响, 不同土壤环境将影响到土壤微生物的结构和分布。所以, 对森林土壤微生物与环境影响因素的研究, 将促进微环境气候认知, 对林区土壤生态可持续发展起到积极作用(焦晓丹和吴凤芝, 2005)。
PLFA是一种被广泛应用的表征活体微生物群落结构的生物标志物, 可用于开展大范围土壤微生物生态研究(Lalor et al., 2007)。PLFA分析技术于近年来不断完善, 应用于土壤碳动态研究(宋斗妍等, 2008)。PLFA是组成微生物细胞膜的主要成分。相比于其它生物标志物, PLFA化学性质较稳定, 在提取过程中不容易丧失或转化(Frostegård et al., 1991)。更重要的是, PLFA单体化合物可通过仪器直接检测其稳定同位素13C, 用于反映微生物的碳源情况(Boschker et al., 2002), 为解释土壤碳循环机理提供直接信息。因此, PLFA是研究土壤中活体微生物丰度、群落和碳代谢动态的有效工具。
目前, 我国森林土壤微生物群落结构的研究主要集中在局部地区森林生态系统, 如长白山和鼎湖山等, 对较大空间尺度下森林土壤微生物分布特征的研究还相对较少, 对其在空间上的分布差异和代谢特征缺乏整体认识。在全球变暖、环境污染等影响下, 土壤微生物种类、数量、功能及营养元素的生物地球化学循环, 也可能发生变化(徐文煦等, 2009)。因此, 在较大区域尺度上研究微生物空间分布规律, 探究环境影响因素, 对于了解我国森林土壤微生物群落特征、维持生态系统稳定性和应对全球气候变化等, 均具重要意义。本研究在整合之前发表的我国东北地区3个高山森林(姜懿珊等, 2014)和之后研究中收集到的6个高山森林, 共9个高山森林土壤PLFA组分结果(姜懿珊, 2014), 进一步分析了土壤微生物PLFA结构及其单体13C水平, 探究不同地理气候条件下土壤微生物群落的分布规律、植物碳代谢特征和影响其分布及碳源选择特性的环境因素。
1 材料和方法
1.1 样品采集
我国纬度范围24.53°N~46.63°N内选取了9个海拔1000 m以上高山背景森林进行实地调研和土壤采样工作。采样点包括: 小兴安岭平顶山(海拔1429 m)、长白山(海拔2261 m)、赛罕乌拉(海拔1940 m)、五岳寨(海拔2150 m)、太白山(海拔3771 m)、鳌山(海拔3456 m)、贡嘎山东坡和西坡(海拔7556 m)和哀牢山(海拔3166 m)等, 具体位置如表1所示。
2012年5月至同年12月, 依据各森林林型和海拔高度的变化, 于上述9个森林设置了36个采样点(表1), 并通过联合国粮农组织开发的New Loc_Clim软件计算收集了各采样点的气候参数(表2)。采样点海拔范围为565~4167 m, 森林林型包括阔叶林、阔叶混交林、针阔混交林、针叶林和高山杜鹃林等。在每个采样点10 m×10 m范围内采集3个存在腐殖质层(O层)、淋溶层(A层)、沉积层(B层)和母质层(C层)的森林土壤剖面, 以微生物主要活动的淋溶层(A层)(陈庆强等, 2005)土壤作为该采样点的土壤样品, 开展此次研究。采样同时, 用土壤温度计插入土壤保持15 min后读数土壤温度, 并用容重环采集土壤容重。采集后的土壤去除其中石砾、杂物和较粗的植物根系后, 用干冰冷却密封保存并立即带回实验室, 取适量混合均匀后的土壤进行土壤PLFA的提取, 其余部分在−20 ℃下冷冻保存。分析前, 以烘干法测定含水率, 而后置于冷冻干燥机中在−50℃下冷冻干燥, 用玛瑙研磨至80目。

表1 9个高山森林设置采样点位置和林型
1.2 土壤理化性质分析
土壤总有机碳含量、土壤总氮含量和土壤碳氮比测定: 取5 g土壤放入试管中, 加入6 mol/L的过量HCl, 加热至60 ℃, 保持24 h以去除碳酸盐。用去离子水清洗至中性。清洗后的样品置于60 ℃烘箱内烘干, 然后放于干燥器中冷却平衡至恒重。冷却后样品取1.5 g用锡舟包好, 用Elementar元素分析仪(Vario EL III)测定总有机碳和总氮含量, 每个样品重复测定2次。
土壤溶液pH值测定: 取5 g土壤置于50 mL的烧杯中, 加入25 mL 浓度为1 mol/L的KCl溶液, 摇匀。静置半小时, 待溶液浸提至平衡后, 用pH计(上海雷磁PHSJ-4F型)测定土壤溶液pH值, 每个样品重复测定2次。
1.3 PLFA的提取
使用Bligh and Dyer (1959)方法提取, 用氯仿/甲醇/柠檬酸缓冲液(2∶1∶0.8)混合溶剂超声提取土壤有机质(Frostegård et al., 1996), 之后硅胶柱层析, 淋洗收集含PLFA的甲醇相。PLFA需甲酯化以用于气相色谱分析识别。用温和碱性甲醇分解法(White et al., 1979), 将吹干后的PLFA溶解于0.2 mol/L氢氧化钾的甲醇溶液中, 保持在37 ℃恒温状态15 min,然后加入醋酸中和, 之后用正己烷/氯仿(4∶1)溶液萃取上层有机相。将萃取所得磷脂脂肪酸甲酯(Fatty Acid Methyl ester, FAME)在氮吹仪上氮吹至干, 加入3 mL正己烷定容, 随后加入内标十九酸甲酯(0.086 mg/cm3)用作定量分析, 在−20 ℃下保存以待仪器分析。
1.4 PLFA的仪器分析
磷脂脂肪酸甲酯分析所用仪器为安捷伦7890A/5975C气相色谱–质谱(GC-MSD)联用仪。根据GC-MS测定总离子流图中磷脂脂肪酸甲酯标样的相对保留时间(Relative Retention time, RRT)来对PLFA进行定性分析。定性分析所使用的两种标样为: 美国NU-CHEK公司生产的型号为GRS617的40种标准脂肪酸甲酯的混合样品和美国Sigma公司生产的型号为BAME 47080-U的26种标准脂肪酸甲酯的混合样品。
PLFA在土壤中的含量表示为PLFA/土壤(μg/g), 计算公式如下:

式中:PLFA为目标PLFA含量;为峰面积;为质量。
1.5 PLFA单体稳定碳同位素(δ13C)分析
对土壤中主要的13种单体PLFA的13C进行了分析, 分别是: C14∶0, iC15∶0, cC15∶0, brC16, C16∶1ω9c, C16∶0, brC17, cyC17, C18∶1ω9c, C18∶1ω9t, C18∶0, brC19和cyC19。分析使用的是美国安捷伦公司的气相色谱仪(安捷伦7890 N)联用同位素比质谱仪(Delta+XL, Finnigan MAT)系统。气相色谱的升温程序为初始温度50 ℃保持4 min, 以15 ℃/min升至155 ℃后, 再以1.5 ℃/min升至230 ℃, 最后以15 ℃/min升至290 ℃恒温保持10 min。进样模式为无分流进样, 载气为高纯氦气, 流速为1.0 mL/min。
13C比度结果表示为13C‰, 参照国际通用标准(Werner and Brand, 2001)。所有分析重复三次执行, 仪器分析所得到的磷脂脂肪酸甲酯的13C需要通过校正甲酯化过程中加入的甲基碳来得到PLFA的13C , 使用以下公式进行计算:
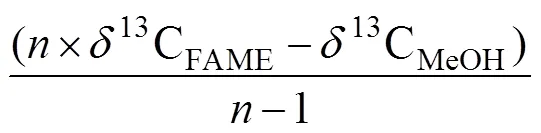
式中:13CPLFA是PLFA的同位素比度;13CFAME是磷脂脂肪酸甲酯的同位素比度;13CMeOH是衍生化分析所用到的甲醇的同位素比度;是磷脂脂肪酸甲酯的碳原子个数。
1.6 统计分析
土壤环境和微生物参数的差异使用SPSS19.0的单变量方差分析(Analysis of variance, ANOVA)及多重比较(least significant difference, LSD)进行检验。土壤中PLFA组分的分布使用SPSS19.0的主成份分析法(Principal components analysis, PCA)进行分析。土壤环境参数和理化性质与土壤微生物参数之间的相关性分析使用SPSS19.0的皮尔森相关分析。土壤环境参数及理化性质与PLFA组分相关性使用的分析方法是冗余分析(Redundancy analysis, RDA),分析软件是R软件的3.5.3版本(vegan package 2.5-4)。土壤环境参数及理化性质与微生物PLFA的13C相关性使用SPSS19.0的Spearman相关分析。
2 结 果
2.1 土壤的理化性质
土壤的理化性质符合调查结果(Myrold, 1998; Borken et al., 2002; Zhang et al., 2013), 其中土壤密度、含水率、土壤温度、总有机碳和总氮在9个森林中呈现出显著差异(<0.05)(表2)。土壤密度范围为0.2~0.6 g/cm3; pH值变化范围为3~5, 含水率范围为23%~49%。采样点纬度分布居中的几个森林土壤(太白山、鳌山、贡嘎山东坡、贡嘎山西坡)含水率(均值> 40%)要高于纬度分布较高的(平顶山、长白山、赛罕乌拉、五岳寨)和较低的(哀牢山)的几个森林(均值< 35 %)(表2)。土壤温度均于9~16 ℃之间, 集中在10 ℃左右(表2)。除平顶山土壤温度是16 ℃以外, 其它几个森林之间无显著差异(<0.05)(表2)。总有机碳变化范围为5%~15%, 总氮变化范围为0.3%~0.9%, 在各森林中的变化情况基本一致(表2)。总有机碳和总氮含量较高的几个森林分别是: 平顶山、太白山、鳌山和哀牢山; 含量较低的几个森林分别是: 长白山、赛罕乌拉、五岳寨、贡嘎山东坡和贡嘎山西坡(表2)。土壤碳氮比值范围为14~22, 在各森林中没有表现出显著差异(表2)。
2.2 土壤微生物生物量及群落结构
本文用PLFA的总含量表征土壤微生物的生物量(Frostegård et al., 1991), 用对应PLFA含量(µg/g)来表征4类典型微生物群落(Frostegård et al., 1996; Djukic et al., 2010)(细菌、真菌、革兰氏阳性菌和革兰氏阴性菌)的生物量和群落结构, 用PLFA的组分分布来表征微生物群落结构(Balkwill et al., 1988; Lalor et al., 2007), 结果如表2、图1a、b。
PLFA总含量变化范围为28~253 µg/g, 在9个森林中呈现显著差异(<0.01)。细菌PLFA含量为6~67 µg/g, 真菌PLFA含量为5~59 µg/g, 革兰氏阳性菌PLFA为3~38 µg/g, 革兰氏阴性菌PLFA为1~14 µg/g。4类微生物群落的PLFA含量均在9个森林中呈现出显著差异(<0.01), 其在各森林中分布变化与PLFA总含量基本一致(表2)。平顶山、五岳寨和哀牢山的革兰氏阳性菌与阴性菌生物量比值显著高于其它森林(表2)。这几个森林的共同特点是组内林型变化较小。平均PLFA含量最低的贡嘎山东坡各个样品点数据的变异系数(Coefficient of variation)变异程度最大, 达到91.73%。平均PLFA含量相对较高的赛罕乌拉各个样品点变异系数最低,仅有19.67%。9个森林的革兰氏阳性与阴性菌比值变化范围为0.7~4.2, 真菌与细菌比值变化的范围为0.5~1.1, 其中革兰氏阳性与阴性菌比值在9个森林中的呈现显著差异(< 0.01)。

表2 9个森林土壤取样点的气候、土壤理化性质和微生物参数
注: 小写字母标记显著性差异(单因素ANOVA的LSD多重比较法,<0.05,=36); 数据=平均值±标准差。
对鉴定出的39种PLFA中含量较高的23种PLFA组分进行主成分分析, 提取出的主成分1和主成分2得分图用来代表微生物群落结构的变化(图1a)。主成分1解释了总PLFA变化的51.3%, 主成分2解释了总PLFA变化的11.2%。PLFA主成分1和2的旋转载荷图(图1b)用来解释构成主成分的PLFA种类来源。图1a中9个森林土壤采样点的分布可将森林划分为结构相近的3组: ①长白山、贡嘎山东坡、贡嘎啥西坡; ②太白山、鳌山、赛罕乌拉; ③平顶山、五岳寨、哀牢山。图1b中代表细菌和革兰氏阳性菌群落的大部分PLFA(iC15∶0, aC15∶0, C15∶0, iC16∶0, C16∶1ω9, C16∶1ω7t, iC17∶0, C18ω7和cycC19∶0)位于主成分1的右侧, 与代表真菌群落的C18∶1ω9和C18∶2、革兰氏阴性菌群落的cycC17∶0、C15∶0、C17∶0呈正相关。所有类型微生物群落中普遍存在的无支链偶数碳饱和脂肪酸(C16、C18、C20)位于主成分1的左侧, 与上述PLFA呈负相关。主成分2分离出了brC19和cycC19两种PLFA, 分别属于放线菌属和梭菌属或双歧杆菌属(Paul et al., 2007)的革兰氏阳性菌群落。
2.3 土壤微生物的稳定碳同位素
4类微生物群落PLFA及总PLFA的13C水平在九个森林中分布情况如图2所示。根据已知的C3、C4植物碳的稳定碳同位素特征, C3植物的13C约为29‰, C4植物的13C约为−12‰。9个森林土壤微生物PLFA的13C范围在−35‰ ~ −17‰, 整体上与C3植被的13C水平(图2)相近, 代表森林土壤微生物以C3植物为主要的植物碳源。4类微生物群落PLFA与总PLFA的13C平均值在9个森林中均显示出显著差异(<0.05), 变化分布相似(图2)。位于30°N左右的贡嘎山(贡嘎东坡、贡嘎西坡)森林土壤中, 其PLFA的整体13C在9个森林中最高, 为−32‰ ~ −17‰。其中, 贡嘎西坡的PLFA整体δ13C明显高于其它森林土壤, 范围为−27‰ ~ −17‰, 说明贡嘎山土壤微生物植物碳源可能部分来自于C4植物。
2.4 土壤微生物与环境因子的相关关系
对36个采样点的环境参数、细菌、真菌、革兰氏阳性菌和革兰氏阴性菌的PLFA含量、群落结构进行相关分析(Pearson方法), 环境参数和PLFA组分进行冗余分析(RDA), 如表3和图3所示。4类微生物群落的PLFA含量与土壤总有机碳、总氮和pH值均为显著相关(<0.01)(表3)。群落结构指标中, 真菌/细菌在九个森林中没有显著变化, 也没有和环境因素显示出较显著的相关关系(表3)。革兰氏阳性菌/阴性菌与采样点地理因素的经度、纬度、高度和代表土壤理化性质的土壤温度、碳氮比均显著相关(<0.01)。RDA结果表明, 海拔高度、年均温、土壤温度和土壤碳氮比可解释森林土壤微生物PLFA组成分布(图3)。
4类微生物群落PLFA和总PLFA的13C与环境参数的相关分析结果如表4所示。气候条件参数(年均温、年降水量)、总有机碳和总氮与微生物PLFA的13C呈显著相关关系(<0.05)。
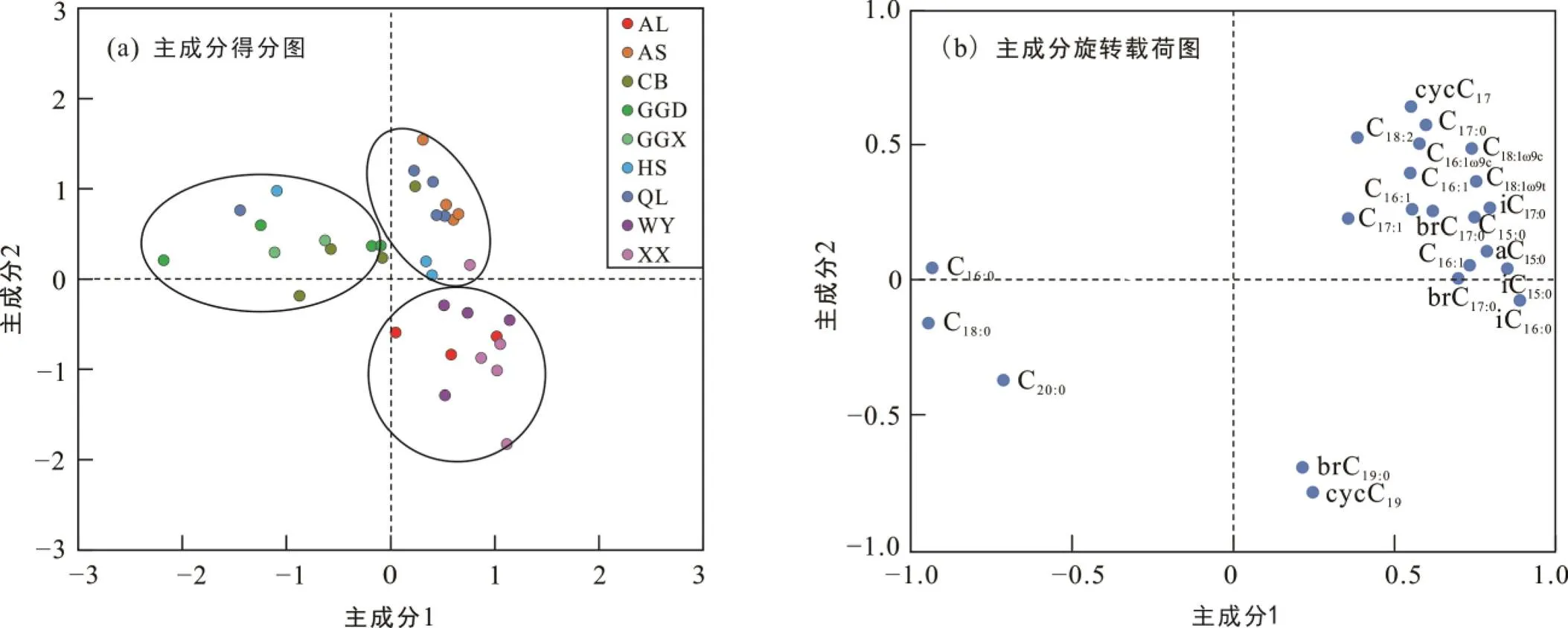
XX. 小兴安岭平顶山; HS. 赛罕乌拉; CB. 长白山; WY. 五岳寨; QL. 秦岭太白山; AS. 鳌山; GGD. 贡嘎东坡; GGX. 贡嘎西坡; AL. 哀牢山。主成分1方差贡献率为51.3%; 主成分2方差贡献率为11.2%。
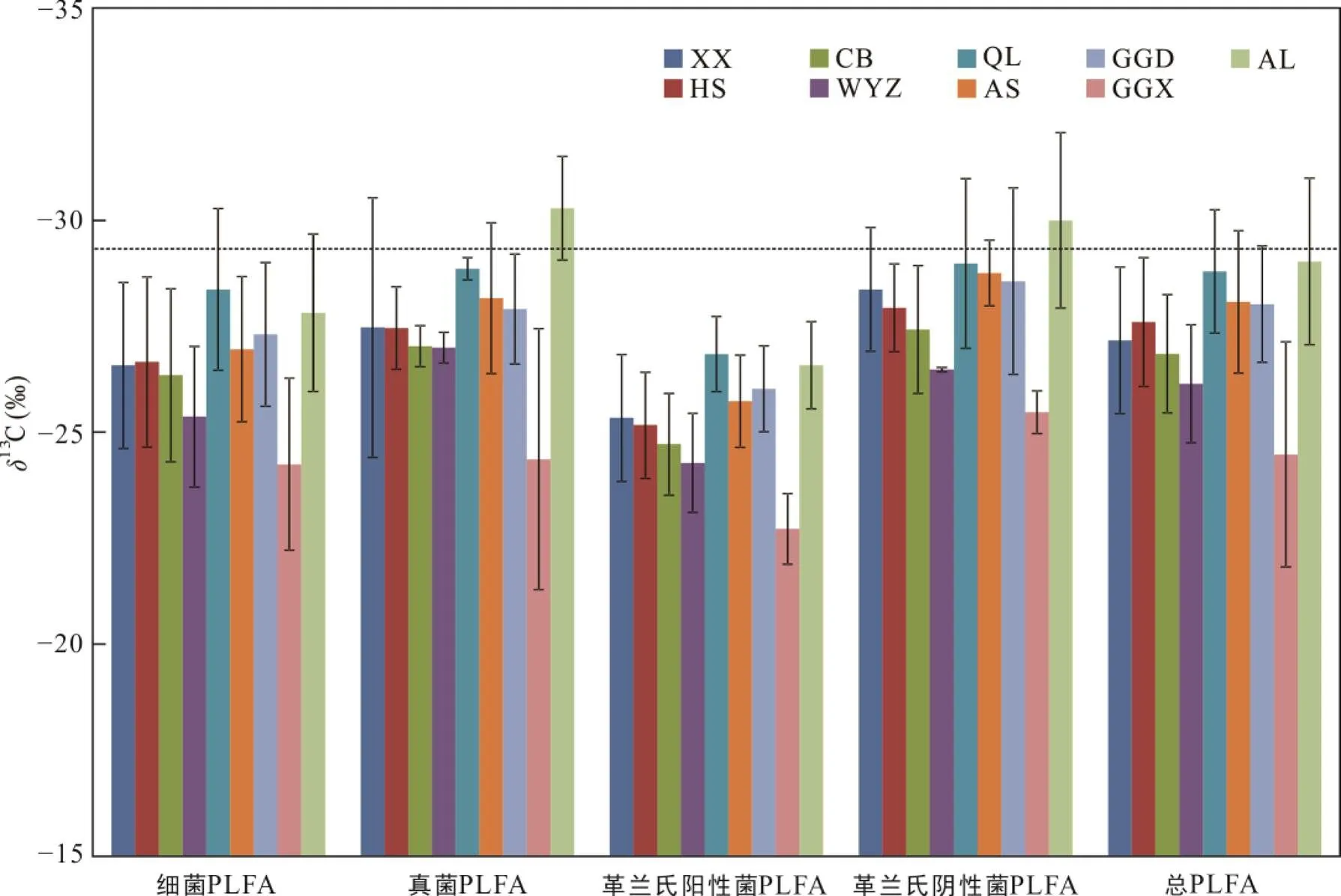
注: 森林按纬度从高到低排列, 虚线为参考C3植被δ13C水平, ≈29 ‰。XX. 小兴安岭平顶山; HS. 赛罕乌拉; CB. 长白山; WY. 五岳寨; QL. 秦岭太白山; AS. 鳌山; GGD. 贡嘎东坡; GGX. 贡嘎西坡; AL. 哀牢山。
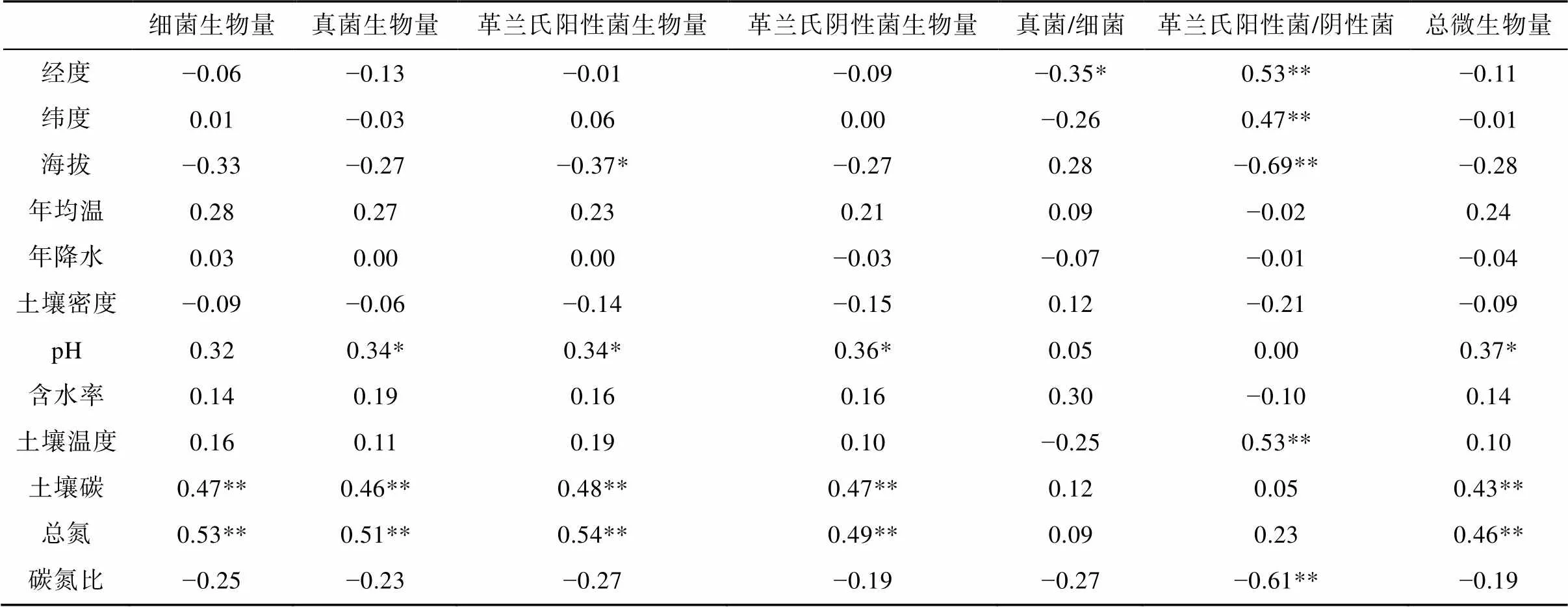
表3 土壤微生物群落参数与土壤非生物因素的关系
注: Pearson系数, *代表相关度在0.05水平显著; **代表相关度在0.01水平显著;=36。
3 讨 论
3.1 森林土壤微生物的空间分布特征
土壤微生物PLFA含量和以PLFA表征的微生物群落结构在不同森林环境中呈现的差异可以表示不同生境条件下, 土壤微生物的生存状态。PLFA含量反映的土壤微生物生物量指示了土壤微生物可利用的能量和营养物的来源(Paul and Clark, 1998), 是反映土壤质量、人为干扰程度和土壤环境变化最为敏感的指标之一。贡嘎山东坡的4种微生物群落的平均生物量和革兰氏阳性菌与阴性菌比值都显著低于其它森林, 这应该与其组内数据较大的变异系数有关(表2)。贡嘎山东坡采样点在9个森林中所处海拔最高, 变化梯度(2060~4167 m)最大, 其环境参数的组间变异系数最高; 反映出多样化的气候条件、植被类型和土壤性质, 可能造成了其采样点间微生物生物量差异较大。PLFA组分的主成分分析将9个森林的微生物结构分为3组。第1组长白山和贡嘎山东坡、贡嘎山西坡海拔高(>2000 m)、生物量偏低(<50 µg/g)和海拔梯度上植被类型变化大: 有阔叶林、针阔混交林、针叶林和高原灌木林。长白山位于相对高纬度(42°N)低海拔(2000 m), 贡嘎山东坡和贡嘎山西坡位于相对低纬度(29°N)高海拔(4000 m),这样的地理位置可能形成了类似的气候和植被类型, 使整体微生物群落结构比较相似。第2组森林之间的纬度比较接近, 赛罕乌拉纬度(44°N)略高于鳌山和太白山(34°N), 采样点的平均海拔也比较接近(1300~1800 m)。相似的地理位置所形成相似的气候条件和植被类型, 可能使它们具有比较相似的微生物结构。第3组平顶山、五岳寨和哀牢山的地理位置相差最大。平顶山位于相对高纬度(47°N)低海拔(1400 m), 五岳寨位于中纬度(39°N)中海拔(1800 m), 而哀牢山位于低纬度(24°N)高海拔(2100 m)。3个森林海拔梯度上林型相似, 均为阔叶林和针阔混交林。3个森林所处纬度和海拔特征可能形成类似的气候条件和植被类型, 出现类似的微生物结构。微生物群落结构表现出纬度和海拔影响相互抵消的特征, 说明土壤微生物群落结构可能受到所处地理特征的影响。
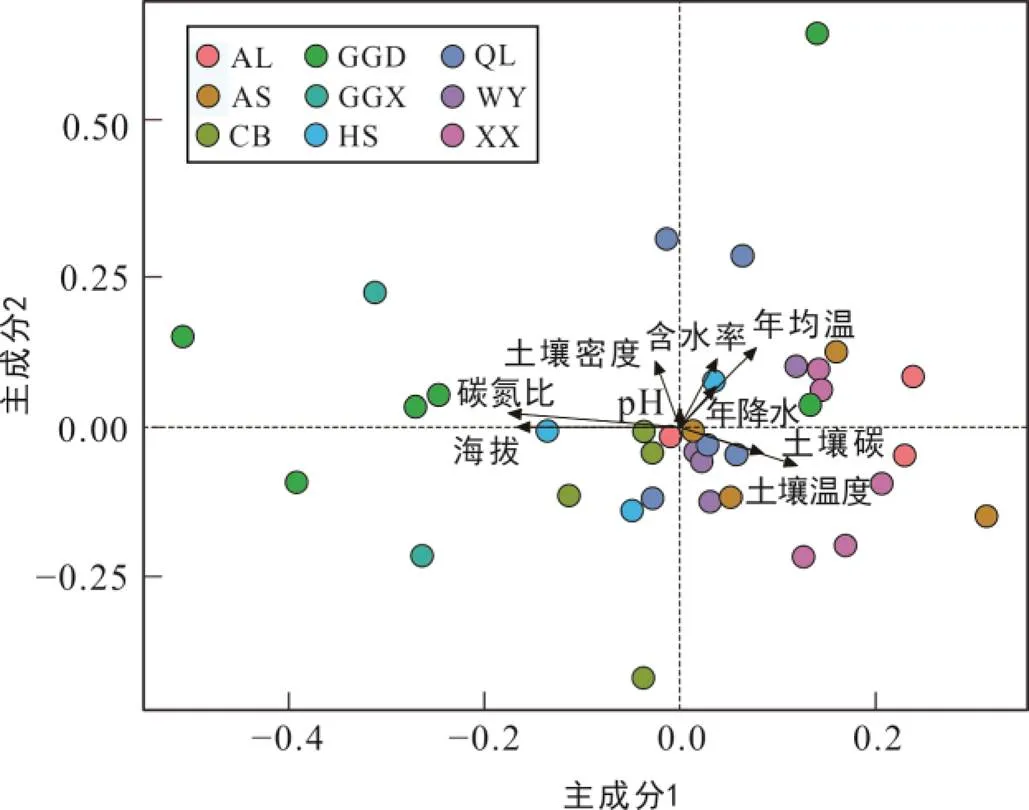
注: 每个点代表一个森林中的一个土壤样品; 箭头代表显著相关的环境变量(p < 0.05)。XX. 小兴安岭平顶山; HS. 赛罕乌拉; CB. 长白山; WY. 五岳寨; QL. 秦岭太白山; AS. 鳌山; GGD. 贡嘎东坡; GGX. 贡嘎西坡; AL. 哀牢山。主成分1方差贡献率为26.44%; 主成分2方差贡献率为12.06%。
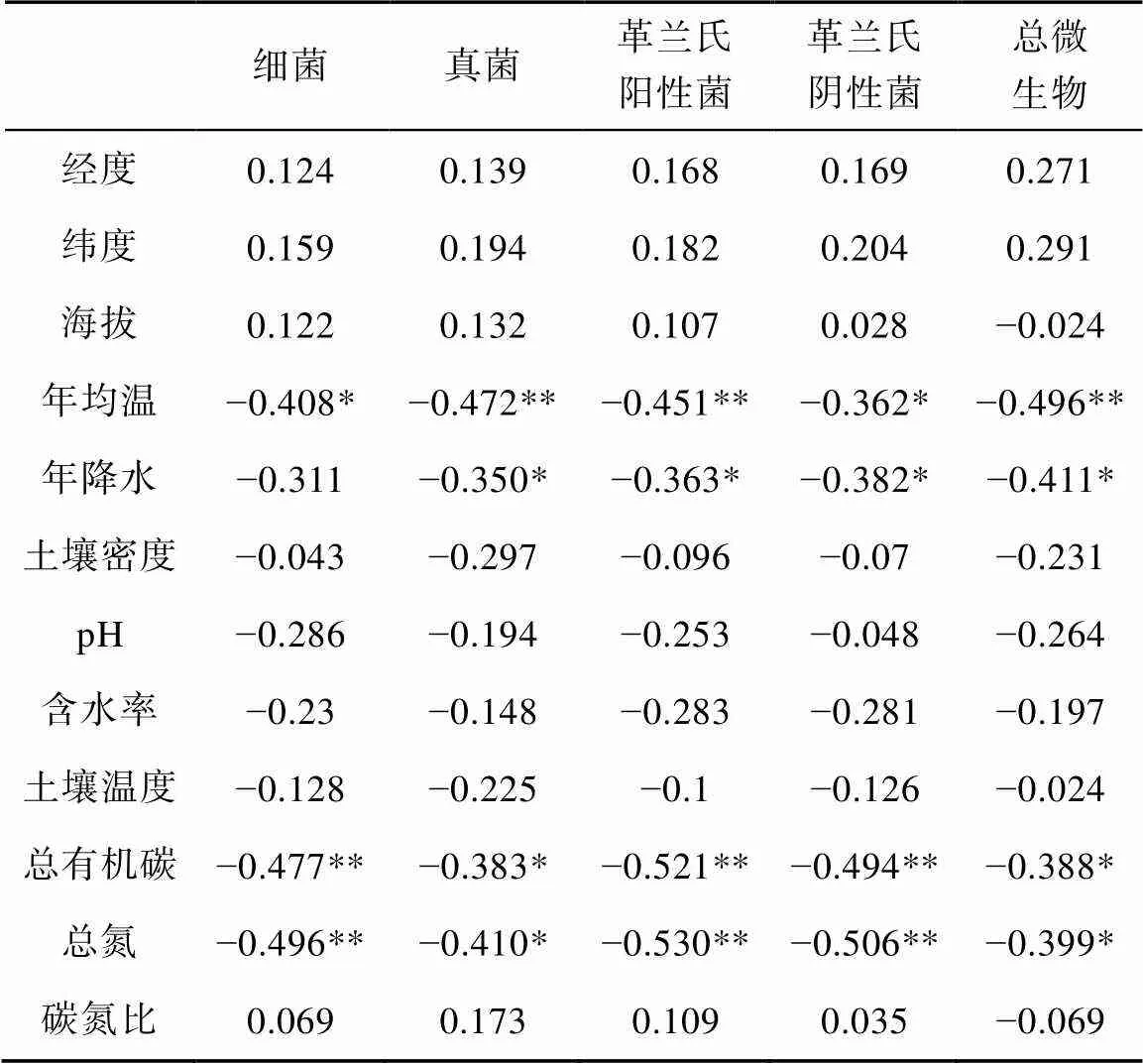
表4 土壤微生物群落的δ13C水平与土壤非生物因素的关系
注: Spearman系数, *代表相关度在0.05水平显著; **代表相关度在0.01水平显著;=36。
3.2 影响土壤微生物空间分布的环境因素
在我们的研究结果中, 土壤微生物生物量主要受到土壤总有机碳、总氮和pH值的影响, 与前人研究结果一致(Alexander, 1977; Frostegård, 1991)。土壤微生物的群落结构受海拔高度、年均温以及土壤温度和碳氮比的影响。土壤碳氮比与微生物群落降解有机质的速率紧密关联, 可影响微生物群落的含量与结构(Swift et al., 1979; Myrold, 1988)。土壤碳氮比在生态系统中很大程度上由植物碳的输入决定, 与地理位置和气候条件所决定的植被类型有很大关系。因此, 我们认为通过土壤碳氮比所反映的植被类型也可能是影响土壤微生物群落结构的因素之一。年均温以及由此决定的土壤温度对整体PLFA组分和土壤革兰氏阳性菌与阴性菌比值具有较显著的影响(图3), 这说明温度是另一个影响土壤微生物群落结构的重要因素。影响微生物群落结构的环境因素在不同研究中一贯存在争议, 如土壤pH值(Bååth et al., 1992, 1995; Pennanen et al., 1998; Högberg et al., 2003)等。而相对普遍的认识是, 除土壤理化性质以外, 土壤微生物群落结构不由单一因素决定, 是不同因素共同作用的结果(Blagodatskaya and Anderson, 1998; Bååth and Anderson, 2003)。本次研究中, 微生物的群落结构显示出了与地理因素、气候因素和土壤性质多种因素的相关性, 证实了不同微生物群落结构的环境影响因素不一致, 且微生物群落并不只受单一因素影响(Jumpponen and Myrold, 2014)。
3.3 微生物的植物碳源
土壤微生物13C分布的显著差异可以体现森林植被类型对微生物所带来影响(刘满强等, 2003; Saynes et al., 2005)。贡嘎山东坡海拔2000 m以上几乎没有C4植物的存在(李嘉竹等, 2009), 但在青藏高原等其它高海拔地区(约4250 m)则出现了C4植物的分布(旺罗等, 2004)。在此次研究中贡嘎山采样点整体海拔较高, 西坡采样点均处于海拔3000 m以上, 考虑到C4植物在温暖且光照充足的条件下更容易生长(Wang et al., 2005), 贡嘎山气候条件或土壤性质可能增加了C4植物的分布, 使土壤微生物整体较其它森林更偏向于C4植物碳源。贡嘎山微生物PLFA的13C符合之前对贡嘎山植被的13C调查结果(−35‰ ~ −17‰)(李嘉竹等, 2009), 结合相关分析结果来看, 微生物的植物碳源受年均温、降水量、总有机碳和总氮的影响。因此, 我们推测气候因素与土壤肥力可能通过影响植被类型分布, 决定土壤微生物对植物碳源的选择。
4 结 论
(1) PLFA组分的主成分分析显示, 微生物群落结构在空间分布上具有纬度和海拔高度平衡分布的特点。
(2) 环境因素和微生物生物量及群落结构的相关分析结果表明, 土壤pH值、总有机碳和总碳是影响微生物生物量的主要因素; 而碳氮比和温度是影响微生物群落结构的主要因素。
(3) PLFA的13C反映了微生物的植物碳源以C3植物为主。
(4) 环境因素与微生物PLFA的13C的相关分析显示, 微生物对植物碳源的选择很可能受年均温、年降水量、总有机碳和总碳共同影响。
致谢:感谢大连理工大学王琰副教授和华南农业大学王俊老师给出的专业评审意见, 对本文质量的提升具有很大帮助。
陈庆强, 沈承德, 孙彦敏, 彭少麟, 易惟熙, 李志安, 姜漫涛. 2005. 鼎湖山土壤有机质深度分布的剖面演化机制. 土壤学报, 42(1): 1–8.
郭银宝, 许小英. 2006. 祁连林区不同植被类型下三种土壤微生物群落的数量分布. 青海农林科技, (3): 16–18.
姜懿珊. 2014. 中国背景森林土壤中的磷脂脂肪酸(PLFAs)及其微生物群落指示意义初步研究. 广州: 中国科学院广州地球化学研究所硕士学位论文: 46–60.
姜懿珊, 肖静, 罗春玲, 李军, 张干. 2014. 平顶山、长白山、赛罕乌拉森林土壤微生物群落结构分析. 生态环境学报, 23(8): 1272–1279.
焦晓丹, 吴凤芝. 2005. 土壤微生物多样性研究方法的进展. 土壤通报, 35(6): 789–792.
李嘉竹, 王国安, 刘贤赵, 韩家懋, 刘敏, 柳晓娟. 2009. 贡嘎山东坡C3植物碳同位素组成及C4植物分布沿海拔高度的变化. 中国科学(D辑), 39(10): 1387– 1396.
刘满强, 胡锋, 何园球, 李辉信. 2003. 退化红壤不同植被恢复下土壤微生物量季节动态及其指示意义. 土壤学报, 40(6): 937–944.
龙健, 李娟, 江新荣, 黄昌勇. 2004. 贵州茂兰喀斯特森林土壤微生物活性的研究. 土壤学报, 41(4): 597–602.
宋斗妍, 白震, 何红波, 张旭东, 解宏图, 郑立臣. 2008. PLFAs稳定同位素技术及其在土壤微生物学中的应用. 土壤通报, (6): 1475–1479.
旺罗, 吕厚远, 吴乃琴, 除多, 韩家懋, 吴玉虎, 吴海斌, 顾兆炎. 2004. 青藏高原高海拔地区C4植物的发现. 科学通报, 49(13): 1290–1293.
徐文煦, 王继华, 张雪萍. 2009. 我国森林土壤微生物生态学研究现状及展望. 哈尔滨师范大学自然科学学报, (3): 96–100.
Alexander M. 1977. Introduction to soil microbiology. New york and London: John Wiley & Sons, Inc: 1–472.
Bååth E, Anderson T H. 2003. Comparison of soil fungal/ bacterial ratios in a pH gradient using physiological and PLFA-based techniques., 35(7): 955–963.
Bååth E, Frostegård Å, Fritze H. 1992. Soil bacterial biomass, activity, phospholipid fatty acid pattern, and pH tolerancein an area polluted with alkaline dust deposition., 58(12): 4026–4031.
Bååth E, Frostegård Å, Pennanen T, Fritze H. 1995. Microbial community structure and pH response in relation to soil organic matter quality in wood-ash fertilized, clear-cut or burned coniferous forest soils., 27(2): 229–240.
Balkwill D L, Leach F R, Wilson J T, McNabb J F, White D C. 1988. Equivalence of microbial biomass measures based on membrane lipid and cell wall components, adenosine triphosphate, and direct counts in subsurface aquifer sediments., 16(1): 73–84.
Blagodatskaya E V, Anderson T H. 1998. Interactive effects of pH and substrate quality on the fungal-to-bacterial ratio and qCO2of microbial communities in forest soils., 30(10): 1269–1274.
Borken W, Muhs A, Beese F. 2002. Changes in microbial and soil properties following compost treatment of degraded temperate forest soils., 34(3): 403–412.
Boschker H T S, Middelburg J J. 2002. Stable isotopes and biomarkers in microbial ecology., 40(2): 85–95.
Djukic I, Zehetner F, Mentler A, Gerzabek M H. 2010. Microbial community composition and activity in different Alpine vegetation zones., 42(2): 155–161.
Frostegård Å, Bååth E. 1996. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil., 22(1–2): 59–65.
Frostegård Å, Tunlid A, Bååth E. 1991. Microbial biomass measured as total lipid phosphate in soils of different organic content., 14(3): 151–163.
Högberg M N, Bååth E, Nordgren A, Arnebrant K, Högberg P. 2003. Contrasting effects of nitrogen availability on plant carbon supply to mycorrhizal fungi and saprotrophs– a hypothesis based on field observations in boreal forest., 160(1): 225–238.
Jumpponen A, Myrold D D. 2014. Microbial Community and Functional Responses to Rainfall Manipulations in a Prairie Soil., (56): 98.
Lalor B, Cookson W, Murphy D. 2007. Comparison of two methods that assess soil community level physiological profiles in a forest ecosystem., 39(2): 454–462.
Myrold D D. 1998. Transformations of nitrogen., 14: 333–373.
Paul E A. 2007. Soil microbiology, ecology and biochemistry // Academic press. San Diego: 515–532.
Paul E A, Clark F. 1998. Soil microbiology and biochemistry., 51: 254–254.
Pennanen T, Perkiömäki J, Kiikkilä O, Vanhala P, Neuvonen S, Fritze H. 1998. Prolonged. simulated acid rain and heavy metal deposition: separated and combined effects on forest soil microbial community structure., 27(3): 291–300.
Saynes V, Hidalgo C, Etchevers J D, Campo J E. 2005. Soil C and N dynamics in primary and secondary seasonally dry tropical forests in Mexico., 29(3): 282–289.
Swift M J, Heal O W, Anderson J M. 1979. Decomposition in terrestrial ecosystems. Berkeley: University of California Press: 1–372.
White D, Davis W, Nickels J, King J, Bobbie R. 1979. Determination of the sedimentary microbial biomass by extractible lipid phosphate., 40(1): 51–62.
Werner R A, Brand W A. 2001. Referencing strategies and techniques in stable isotope ratio analysis., 15(7): 501–519.
Wang L, Ouyang H, Zhou C P, Zhang F, Song M H, Tian Y Q. 2005. Soil organic matter dynamics along a vertical vegetation gradient in the Gongga Mountain on the Tibetan Plateau., 47(4): 411–420.
Zhang B, Liang C, He H, Zhang X. 2013. Variations in soil microbial communities and residues along an altitude gradient on the northern slope of Changbai Mountain, China., 8(6): e66184.
Mountain forest soil microbial communities and carbon source study by phospholipid fatty acid structure and compound-specific isotope analysis
JIANG Yishan1, 2, 3, SUN Yingtao1, ZHANG Gan1, LUO Chunling1*
(1. State Key Laboratory of Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, Guangdong, China; 2. Academy of Green Manufacturing Engineering, Wuhan University of Science and Technology, Wuhan 430081, Hubei, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China)
Soil microbial structures and their activity in forest ecosystems plays a key role in soil biogeochemical cycles, soil organic matter metabolism, and soil quality. Phospholipid fatty acid (PLFA) is a biomarker of living microbial structure, and its natural stable carbon isotope abundance (13C) is indicative of the microbial plant carbon sources. In this study, four microbial communities (bacteria, fungi, gram-positive bacteria, and gram-negativebacteria) as well as total microbial biomass, structures, plant carbon sources and their relationship with environmental factors were discussed based on the abundance, composition, and13C of their representative PLFA in nine mountain forests distributed on a latitudinal gradient (24°N–47°N) in China. The total microbial biomass (28.2– 253 µg/g) was significantly different in the nine forests, as was the biomass of the four microbial communities and the ratio of gram-positive bacteria to gram-negative bacteria (GP/GN) (<0.01). The principal components of PLFA in forests located at relatively high latitudes and low elevations are similar to those in forests located at relatively low latitudes and high elevations, indicating a similar microbial structure in these forests. Soil pH, soil organic carbon (SOC), and total nitrogen (TN) were significantly correlated with soil microbial biomass (<0.01), while mean annual temperature (MAT), soil temperature, and the ratio of soil carbon and nitrogen were significantly correlated with the soil microbial structure (<0.01). This indicates that the microbial biomass was mainly influenced by soil properties, but the microbial structure was determined in combination with climatic conditions. The13C of soil microbes varied from −35‰ to −17‰, which was similar to that of C3plants, indicating a principal C3plant microbial carbon source in these forests. There was a significant relationship between the total and the four microbial13C values and mean annual temperature, mean annual precipitation, soil organic carbon, and total nitrogen (<0.05), suggesting that the choice of microbial plant carbon source is influenced by soil fertility and climatic conditions.
forest soil microbes; phospholipid fatty acid; stable carbon isotope; microbial community; microbial carbon source
S714.3
A
0379-1726(2022)01-0009-10
10.19700/j.0379-1726.2022.01.002
2020-04-03;
2020-04-14
广东省“珠江人才计划”本土创新科研团队(grant 2017BT01Z134)和有机地球化学国家重点实验室开放基金课题(SKLOG202106)资助。
姜懿珊(1990–), 女, 博士, 环境工程专业。E-mail: jiangyishan_12345@yahoo.com
罗春玲(1978–), 女, 研究员, 主要从事重金属、有机污染物在土壤‒植物系统中的迁移和转化研究。E-mail: clluo@gig.ac.cn
