1株秦艽内生真菌的分离鉴定及生物活性研究
2022-03-02李佩华魏淑红刘小红周丽倩段典佑彭正松
李佩华,赵 欢,魏淑红,刘小红,周丽倩,段典佑,彭正松
(1.西华师范大学生命科学院,四川南充 637009;2.西昌学院农学院,四川西昌 615013)
植物内生真菌指那些在其生活史的一定阶段或全部阶段生活于宿主植物的各种组织和器官内,且植物不表现出外在病症的一类真菌[1]。其广泛分布,种类繁多,且可产生丰富的次生代谢产物,具有抗肿瘤、抗氧化、抗病原微生物和促植物生长等功效[2]。此外,内生真菌具有易培养、易控制、生长快、低生产成本以及可大规模工业生产及可通过诱变育种提高菌株性能等优点,使得利用内生真菌寻找新的天然活性物质成为近年来的一个研究热点[3]。
聚酮化合物是一类具有复杂化学结构的天然化合物,广泛存在于动、植物及微生物中,具有抗菌、抗肿瘤、抗病毒和抑制免疫反应等生物学活性[4]。其生物合成途径是由一个脂酰辅酶A为启动单元,与若干丙二酰辅酶A延伸单元经反复醇醛缩合和延伸而成,形成含有多个酮基的中间代谢产物,再经甲基化、糖基化、氧化还原等修饰反应形成各式各样结构复杂的聚酮类化合物,而聚酮合酶(polyketide synthase,PKS)是催化合成反应的关键酶[5-6]。根据结构和催化机制可将PKS分为3类:模件型PKS(又称Ⅰ型PKS)、重复型PKS(又称Ⅱ型PKS)和查尔酮型(又称Ⅲ型PKS),其中,真菌聚酮合酶大多属Ⅰ型PKS,其包括基本结构域组合:酮体合成酶、酰基转移酶和酰基载体蛋白,及一些的功能结构域,如脱水酶、酮体还原酶、甲基转移酶和环化酶等[7]。目前,所报道的内生真菌PKS基因序列比较有限,仅见芍药、川楝、海芦笋和蛇足石杉等少数几种植物[8-11]。
秦艽(Gentiana macrophylla Pall.)为龙胆科龙胆属多年生草本植物,始载于《神农本草经》,具有祛风除湿、活血舒筋及清热利尿的功效,用于治疗风湿痹痛、筋脉拘挛、骨蒸潮热和湿热黄疸等病症[12-13]。其主要成分为龙胆苦苷,属环烯醚萜类化合物,具有保肝利胆、抗炎镇痛及抗氧化等功效[14]。由于市场需求量猛增和过度采挖,致使秦艽野生资源濒临枯竭,现已被列为国家三级重点保护植物。目前,有关秦艽内生真菌的研究鲜有报道,有关秦艽内生真菌抗氧化活性和抗菌方面的研究尚未报道。本文对从秦艽叶中分离获得的1株内生真菌(命名为QJ15菌株)进行形态学和分子生物学鉴定,检测了PKS基因,并研究其代谢产物的抗菌和抗氧化活性,以期为该内生真菌菌株的合理开发与利用提供参考依据。
1 材料和方法
1.1 材料
植物材料由四川省农业科学院杨晓老师馈赠,由马永红副教授鉴定为Gentiana macrophylla Pall。内生真菌QJ 15菌株分离纯化于秦艽的叶,现保存于西华师范大学生命科学院。指示菌:金黄色葡萄球菌(Staphylococcus aureus CICC10384)和大肠埃希菌(Escherichia coli EPEC026:K60 CICC 10372),由四川省农业科学院分析测试中心魏超老师馈赠。
1.2 试剂及仪器
试剂:KOD酶,上海东洋纺生物科技有限公司;二苯代苦味肼基自由基(DPPH),Sigma公司;其他试剂均为国产分析纯。引物均由上海生工生物工程有限公司合成。
仪器:OLYMPUS显微镜、PCR仪、电泳仪、凝胶成像系统、高速冷冻离心机、摇床、恒温培养箱、光照培养箱、旋转蒸发仪、循环水式真空比泵、BioTeck酶标仪、全温摇床。
1.3 方法
1.3.1 真菌的鉴定
将QJ15菌株接种于PDA平板上,于28℃培养6 d,采用插片法显微观察菌株的菌丝、孢子及产孢结构等特征,鉴定菌株种属。按照Omega公司真菌基因组DNA提取试剂盒(Fungal DNA Kit D3390)的步骤提取菌株基因组DNA,分别用通用引物对ITS 1(5’-TCCGTAGGTGAACCTGCGC-3’)和ITS 4(5’-TCCTCCGCTTATTGATATGC-3’);引物对NL1(5’-GCATATCAATAAGCGGAGGAAAAG-3’)和 LR3(5’-GGTCCGTGTTTCAAGAC-3’)扩 增 菌 株 的rDNA ITS区和LSU基因,PCR扩增程序为:94℃预变性3 min,94℃变性30 s,55℃退火30 s,68℃延伸1 min,共30个循环,72℃延伸10 min,4℃保存。经1%琼脂糖电泳检测并回收后,将纯化后的PCR产物送上海生工生物工程有限公司测序,并提交Gen⁃Bank进行序列同源性比对,采用MEGA 4.0构建系统发育树,确定其分类地位。
1.3.2 PKS基因的扩增
采用简并引物对KAF(5’-GARKSICAYGGIACI GGIAC-3’)和KAR2(5’-CCAYTGIGCICCYTGICCI GTRAA-3’)[14]扩增射干内生真菌的PKS基因。PKS扩增的PCR反应体系:模板DNA 2 μL,2× PCR Mix 12.5 μL,上下引物(10 pmol)各0.5 μL,无菌重蒸水补齐至25 μL。PCR反应程序:94℃预变性3 min,94℃变性30 s,50℃退火1 min,72℃延伸2 min,共30个循环,72℃延伸10 min。产物经1%的琼脂糖凝胶电泳检测后,胶回收并连接至pEASY-Blunt载体,采用冻融法将其转化至大肠杆菌DH5α感受态细胞中,并涂布于含50 mg/mL卡那霉素(Kanamy⁃cin,Kan)的LB固体培养基,37℃过夜培养。采用菌落PCR检测并挑选3~5个阳性克隆,送上海生工生物工程有限公司测序,测序结果与GenBank已报道的PKS基因的氨基酸序列进行相似性分析,用MEGA 4.0软件构建系统发育树。
1.3.3 内生真菌发酵液的制备
用直径为4 mm的无菌打孔器打取已活化的QJ15菌株的菌饼2个,接种于含50 mL Czapek培养基(MgSO4·7H2O 0.5 g,K2HPO41 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,蔗糖30 g,NaNO33 g,定容至1 000 mL,pH=7.0)的150 mL锥形瓶中,于28℃、120 r/min培养7 d,无菌滤纸过滤。加入等体积的乙酸乙酯萃取上清液3次,合并乙酸乙酯相,于40℃、8×103Pa条件下旋转蒸发,甲醇定容至3 mg/mL,4℃保存备用。
1.3.4 发酵条件的优化
以CZ培养基为基础培养基,以牛肉膏、蛋白胨、硝酸钾、硝酸钠和硫酸铵为待测氮源,筛选最适氮源。筛选出最适氮源后,以葡萄糖、蔗糖、木糖、山梨醇、乳糖和可溶性淀粉为待测碳源,进一步筛选最适碳源。
1.3.5 DPPH自由基清除能力的测定
采用Cui J.L.等[15]的方法测定DPPH自由基清除能力。将2 mL 3 mg/mL乙酸乙酯粗提液与4 mL 50 mg/L的DPPH混合,充分振荡,于37℃避光30 min,测定λ=517 nm时的OD值。以1 mg/mL抗坏血酸(VC)为阳性对照,以DPPH的甲醇溶液为空白对照。DPPH自由基的清除率/%=[(A0-A1)/A0]×100%,其中A0为对照的吸光度,A1为样品(或Vc)吸光度,试验重复3次,每个样品测定4个平行,取平均值。
1.3.6 QJ15发酵液的抑菌分析
QJ15菌株发酵液的制备参见1.3.3,发酵结束后8 000 r/min离心10 min,上清液冻干机制备样品,采用二倍稀释法将样品浓度定容于35、17.5、8.75、4.375、2.187 5和1.093 mg/mL。用牛津杯法测定样品的抗菌活性,加入终浓度为106CFU/mL指示菌的菌悬液于45℃的牛肉膏蛋白胨培养基中,迅速摇匀,制成平板。将灭菌的牛津杯放入,并在其中加入100 μL待测样品的无菌发酵液,平板37℃培养24 h后测定抑菌圈的大小。
2 结果与分析
2.1 QJ 15菌株的形态学鉴定
26℃的培养条件下,QJ15菌株的菌落初期为黄色,后期渐变为黄褐色,表面菌丝黄白色,短绒状(图1-A,B);显微观察发现菌丝呈树枝状,多个孢子串联成链状,分生孢子为孔出孢子,卵圆形或棒状,单个孢子中间细胞较大,两端延长呈喙状(图1-C)。
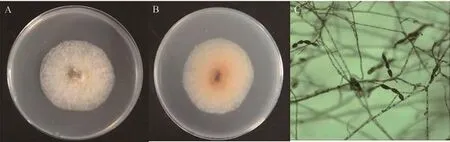
图1 QJ15菌株的形态学鉴定Figure 1 The morphological identification of QJ15 strain
2.2 QJ15菌株的分子鉴定
采用ITS序列测定法对QJ15菌株进行分子鉴定,PCR扩增结果表明,可获得1条长为535 bp的条带。将序列与GeneBank中所报道的序列进行分析,结果表明,其与Alternaria alternata Q2(基因登录号:MG214867.1)的ITS区序列相似性为99.81%。选取相似度较高的序列,利用MEGA 7.0软件的邻接法构建系统发育树,可以看出QJ15和Alternaria alternate聚为一支。LSU基因分析表明,其与Alter⁃naria alternata strain CM14(基因登录号:MN200346.1)的序列相似性为97%(图2)。选取相似度较高的序列,利用MEGA 7.0软件的邻接法构建系统发育树,可以看出,QJ15和Alternaria alter⁃nate聚为一支。综上,结合QJ15的形态学特征和系统发育树分析,将其鉴定为链格孢属真菌Alternaria alternata QJ15(图3)。

图2 QJ15菌株基于r DNA-ITS序列的系统发育学分析Figure 2 Phylogenetic tree constructed based on ITS sequences of QJ15 strain
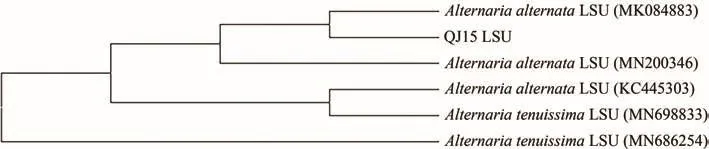
图3 QJ15菌株基于LSU序列的系统发育学分析Figure 3 Phylogenetic tree constructed based on LSU sequences of QJ15 strain
2.3 PKS基因的扩增
以QJ15菌株基因组DNA为模板扩增其PKS基因,结果表明,扩增的PCR片段约为800 bp,与预期值相符。序列比对发现,其与GenBank中所报道的Alternaria alternata(基因登录号:XP_018388399.1)Ⅰ型PKS基因的氨基酸序列相似性极高,为98%;与树状链格孢Alternaria arborescens的Lovastatin diketide synthase的序列(基因登录号:RYN42508.1)相似性高达96.84%。采用MEGA软件对Genbank已报道的PKS基因的氨基酸序列,即Alternaria sp.(Genkank中的登录号 :AFN68301、BAE80697.1、AOO87095.1、AHD03880.1和XP_018388399.1),Bipolaris sp.(Genk⁃ank中的登录号:XP_007703917.1、XP_014083463.1、XP_007712878.1和 XP_014554240.1)及 Lovastatin diketide synthase(Genkank中的登录号:RYN42508.1、XP_028507901.1和RYO53185.1)Lovastatin nonaketide synthase protein(Genkank中的登录号:KFH40639.1和XP_013331428.1)构建系统发育树,结果发现,Alter⁃naria sp.和Bipolaris sp.的PKS序列各自聚为一类。在Alternaria sp.的分支中,来自树状链格孢A.arbore⁃scens的3条PKS序列(RYN42508.1、XP_028507901.1和RYO53185.1)聚为一小类,自展支持率为87;QJ15 PKS序列与A.alternata PKS序列(XP_018388399.1)聚为一小类,自展支持率为85;A.alternata PKS序列(AFN68301)与Alternaria sp.PKS序列(AHD03880.1)聚为一小类,自展支持率为98。此外,A.alternata PKS序 列(AOO87095.1)和 A.solani PKS序 列(BAE80697.1)分别为一小类(图4)。

图4 QJ15菌株基于PKS氨基酸序列构建的系统发育树Figure 4 Phylogenetic tree based on PKS amino acid sequences of QJ15 strain
2.4 QJ15发酵产物的乙酸乙酯萃取物对DPPH自由基的清除能力
以DPPH自由基的清除能力为指标,检测QJ15发酵产物的乙酸乙酯萃取物对DPPH自由基的清除能力,结果表明,QJ15菌株的乙酸乙酯萃取物与其对DPPH自由基的清除能力呈量效关系(图5)。当乙酸乙酯萃取物的质量浓度为1.0 mg/mL时,其对DPPH自由基清除率为34.19%。随着发酵产物质量浓度的增大,其对DPPH自由基的清除能力逐渐增强,当乙酸乙酯萃取物的质量浓度为10.0 mg/mL时,其对DPPH自由基清除率达到最大值,为83.87%。就EC50而言,QJ15菌株的乙酸乙酯萃取物对DPPH自由基的IC50为2.728 mg/mL(拟合方程为:y=8.637 5x+26.439,R2=0.990 7)。
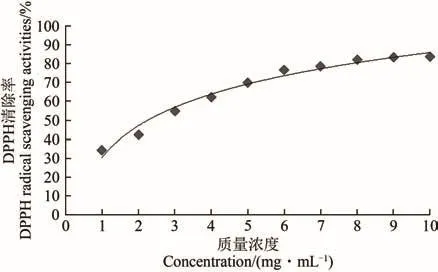
图5 不同质量浓度QJ15发酵产物的乙酸乙酯萃取物对DPPH自由基的清除能力Figure 5 DPPH radical scavenging activities of the ethyl acetate extracts from QJ15 strain fermentation at different concentrations
2.5 最适碳氮源
最适氮源的筛选结果表明,在5种的供试氮源发酵条件下,QJ 15菌株发酵产物的乙酸乙酯粗提液均能清除DPPH自由基,但清除能力存在差异。当KNO3为氮源时,QJ15菌株对DPPH自由基清除能力最强,当质量浓度为3.0 mg/mL时,其清除率达到52.78%;当硝酸钠为氮源时,其对DPPH自由基清除能力偏低,当质量浓度为3.0 mg/mL时,其清除率仅为38.00%;QJ15菌株对DPPH自由基的清除能力表现为 KNO3(52.78%)>牛肉膏(48.78%)>蛋白胨(48.39%)>NH4NO3(38.64%)>NaNO3(38.00%)。综上,选择KNO3为QJ15菌株发酵的最适氮源(图6)。
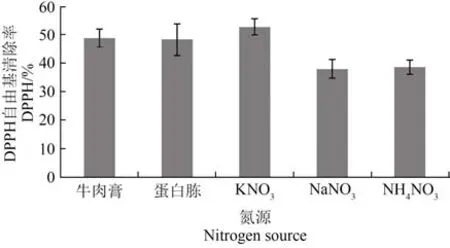
图6 不同氮源QJ15发酵产物的乙酸乙酯萃取物对DPPH自由基的清除能力Figure 6 DPPH radical scavenging activities of the ethyl acetate extracts from QJ15 strain fermentation in different nitrogen source
在已筛选出最适氮源的基础上,进一步筛选QJ15菌株发酵的最适碳源,结果表明,在6种的供试碳源发酵条件下,QJ 15菌株发酵产物的乙酸乙酯萃取物均能清除DPPH自由基,但清除能力存在差异。当果糖为碳源时,QJ15菌株对DPPH自由基清除能力最强,当质量浓度为3.0 mg/mL时,其清除率达到90.10%;当山梨醇为碳源时,菌株对DPPH自由基清除能力偏低;当质量浓度为3.0 mg/mL时,其清除率仅为44.67%;QJ15菌株对DPPH自由基的清除能力表现为:果糖(90.10%)>木糖(89.29%)>麦芽糖(88.46%)>葡萄糖(81.61%)>蔗糖(58.10%)>山梨醇(44.99%)>淀粉(44.67%)。由于麦芽糖较果糖和木糖而言更为经济实惠,且3者对DPPH自由基清除效果差异不显著,综上,选择麦芽糖为QJ15菌株发酵的最适碳源(图7)。

图7 不同碳源QJ15发酵产物的乙酸乙酯萃取物对DPPH自由基的清除能力Figure 7 DPPH radical scavenging activities of the ethyl acetate extracts from QJ15 strain fermentation in different cabin source
2.6 抗菌活性分析
抗菌活性结果显示,菌株QJ15的代谢产物对金黄色葡萄球菌和大肠埃希氏杆菌均有抑制作用。随供试样品浓度的增加,其对两种指示菌的抑制效果随之增加,当QJ15浓度为35 mg/mL,其抑菌圈直径分别为20.6和18.8 mm(图8)。
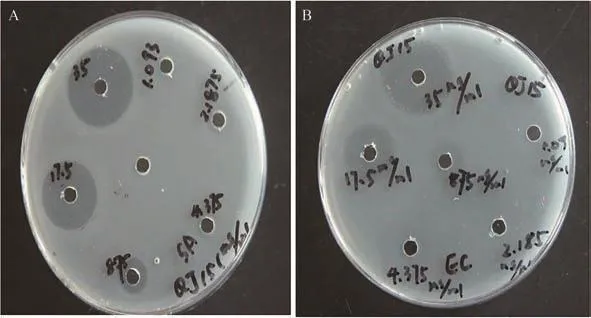
图8 秦艽内生真菌粗提液分别对金黄色葡萄球菌(A)和大肠杆菌(B)的抑菌作用Figure 8 The antibacterial activity of crude extracts from the endophytic fungi isolated from G.macrophylla,against pathogenic bacteria A-S.aureus,B-E.coli
3 讨论与结论
目前,有关秦艽内生真菌的报道相对较少。Yin H.等[16]采用组织块法从秦艽根、茎和叶中共分离出20种内生真菌,并从菌落形态、生长曲线和生物碱类物质的定性反应等方面对分离菌株进行了描述,同时,鉴定出QJ-18菌株为根霉。本文从药用植物秦艽中分离纯化了1株QJ15内生菌株,通过显微观察发现,该菌株的生长形态、菌落特性及分子孢子等形态特征与链格孢属(Alternaria sp.)内生真菌极为相似;同时,对其rDNA ITS区和LSU序列分析表明,该菌株与互隔交链孢霉Alternaria alternata的序列相似性较高。综上,将其鉴定为Alternaria alternata,这也是首次从秦艽中分离获得Alternaria属的内生真菌菌株。
链格孢属Alternaria sp.是一类具有开发潜力的内生真菌,广泛存在于刺五加、杜仲、艾草、枸杞、甘草和丹参等宿主植物中,具有抗氧化活性[17-22]。S.Chatterjee等[21]从印度印楝的叶中分离获得了1株互隔交链孢霉A.alternata AE1,其发酵产物对DPPH自由基和超氧化物阴离子均有较好的清除能力。Tian J.等[22]从丹参中分离获得了一株内生真菌Alternaria sp.Samif01,采用硅胶柱色谱、Sephadex LH-20等方法对菌株的发酵液进行分离,并鉴定化合物单体的理化性质和结构,结果表明,其发酵液的乙酸乙酯提取物中的3-epidihydroaltenuene A、Altenuisol和 4-hydroxyalternariol-9-methyl ether具有清除DPPH自由基和羟基自由基的活性。本文测定了菌株QJ15发酵液上清乙酸乙酯抽提物对DPPH自由基的清除能力,结果显示,其对DPPH自由基清除率的IC50值为2.728 mg/mL,说明菌株QJ15具有较好的清除DPPH自由基的能力,具有潜在的开发利用价值。进一步对发酵培养基中的碳氮源进行优化发现,在同等剂量(3 mg/mL)下,优化后的QJ15乙酸乙酯萃取物对DPPH自由基的清除作用可达到88.46%,比未优化前约提高了30%。究其原因,可能是由于菌株在不同碳氮源培养基上产生的次生代谢产物不同,也可能由于菌株在不同碳氮源培养基上的生长速率不同,使得抗氧化活性物质的产生量不同,从而致使菌株在不同碳氮源培养条件下对DPPH自由基清除率有显著差异。下一步的工作将采用对正相硅胶、Sephadex LH-20柱色谱等分离纯化A.alternata QJ15发酵液的乙酸乙酯萃取物,筛选出具有抗氧化活性的单体化合物,并根据理化性质和波谱数据对其进行分析鉴定。
此外,链格孢属Alternaria sp.内生真菌也是一类很有潜力的天然抗病原微生物资源。苗智等[23]从秦岭山区夹竹桃茎中分离鉴定了1株内生真菌Al⁃ternaria sp.SPS-04,并对其次生代谢产物的化学成分进行了研究,结果表明,该内生真菌发酵产物中分离得到的交链孢甲醚对金黄色葡萄球菌和番茄灰霉病菌均有抑制效果,最小抑菌浓度分别为1.95和3.91 μg/mL。刘悦等[20]从刺五加的根茎叶中分离获得了71株内生真菌,其中,内生菌株Alternaria al⁃ternata CWJ-6对大肠埃希菌抑菌效果显著,抑菌直径为18.07 mm。刘军等[24]研究了檀香内生真菌的生物多样性及其抗菌与促生特性,结果表明,分离自檀香茎中的Alternaria属内生真菌对金黄色葡萄球菌、伤寒沙门菌和枯草芽孢杆菌均具有抑制效果。本文分离获得的菌株A.alternata QJ15对金黄色葡萄球菌和大肠埃希菌均有较好的抑制效果,说明菌株为广谱抗菌活性菌株,该结果进一步支持上述学者的观点。同时,也预示A.alternata QJ15代谢产物中可能蕴藏较为丰富的抗菌活性物质,可能成为新型抗菌剂来源。目前,有关A.alternate内生真菌抗菌机制的研究仅见王永刚等[25-26]报道。该课题组从药用植物白毛蛇中分离获得1株内生真菌A.alternata B06e,并探讨了其发酵产物的醋酸乙酯提取物对金黄色葡萄球菌和大肠埃希菌的作用机制,研究表明,B06e均可增加两种病原菌的细胞膜通透性,破坏细胞膜的完整性,造成胞质内β-半乳糖苷酶、核酸和蛋白质等的渗漏和外源物质的大量流入,引起细胞的生理功能紊乱,从而抑制细胞繁殖。此外,B06e对大肠杆菌的抑制机制还表现为,其可破坏大肠杆菌DNA的结构,影响细菌DNA正常复制和相关基因的表达调控,从而抑制了细胞的正常生长。故下一步工作将对QJ15代谢成分进行分离,寻找新的抗菌活性物质,并研究其抗菌机制。
洛伐他汀是一些丝状真菌的次生代谢产物,具有抗细菌、抗炎、抗癌、降低胆固醇和神经保护等生物学活性[27]。其生物合成主要受洛伐他汀九酮合酶Lovastatin nonaketide synthase和洛伐他汀二酮合酶Lovastatin diketide synthase两个关键酶调控。其中,洛伐他汀二酮合酶是由LovF基因编码,包含2532个氨基酸残基,主要催化1分子乙酰CoA和1分子丙二酰CoA缩合,形成洛伐他汀的2-甲基丁酰侧链部分[28]。本文中QJ15的PKS氨基酸序列与洛伐他汀二酮合酶具有较高的相似性,推测QJ15菌株具有合成洛伐他汀类聚酮化合物的潜力。同时,本文的抑细菌试验也表明菌株QJ15能产生强的抗细菌活性物质,而抗细菌活性与洛伐他汀类药物是否相关值得进一步研究。
秦艽的主要活性成分为龙胆苦苷,具有抗细菌、抗氧化和细胞毒性等功能[29]。研究表明,链格孢属内生真菌可产生与宿主植物相同或相似的活性物质,如黄连中分离得到的内生菌株Alternaria sp.HL-Y-3可产小檗碱[30],杜仲中分离得到的Alter⁃naria sp.内生真菌可产绿原酸[31],茶条槭中分离得到的内生菌株Alternaria sp.CP11可产没食子酸[32]等。基于此,本文也采用HPLC检测A.alternata QJ15发酵液的乙酸乙酯萃取物,但未能检测出龙胆苦苷(数据未列),故下一步工作将寻找更多产龙胆苦苷的高产秦艽内生真菌资源。
