吸附去除水体重金属离子的影响因素研究进展
2022-03-02冯江涛王桢钰闫炫冶张娟涛徐浩延卫
冯江涛,王桢钰,闫炫冶,张娟涛,徐浩,延卫
(西安交通大学能源动力与工程学院,710049,西安)
水体中的重金属离子主要来源于电镀、冶金、电池制造、杀虫剂等行业,重金属离子具有高迁移、高毒、不可生物降解等特性,对环境造成巨大的危害。重金属离子还可以通过生物食物链富集,即使在低浓度下也会对生态系统造成严重威胁[1-4]。目前,对于水体中重金属离子污染的治理技术有化学沉淀法、电化学法、膜分离法、化学氧化法、反渗透法、电渗析法、离子交换法和吸附法等,其中吸附法因操作简便、效率高、成本低等优点,具有很强的实用性[5-7]。以往吸附处理水体重金属离子的一些研究往往更多地关注吸附容量、吸附平衡时间等吸附的性能参数,而忽略了某些因素对于吸附过程的影响,如温度、pH值、吸附剂用量、共存离子强度、共存有机物等,不能全面准确地评价吸附剂的实际应用性能。
各种因素对吸附过程的影响是多样的,这与吸附剂和目标金属离子的物化性质和吸附的具体机制有关。如,吸附剂的物理性质会影响到暴露的活性吸附位点的数量和吸附质的传质扩散过程,化学性质不仅影响吸附容量和吸附平衡时间,还决定了吸附剂的吸附选择性能;溶液温度的影响与吸附的热力学性质密切相关;溶液pH值会改变吸附剂活性位点的化学状态和重金属离子在水中的赋存形态;不同的溶液初始浓度提供了不同的驱动力,影响传质效应;更多的吸附剂提供更多的吸附位点,但吸附剂过多可能会发生团聚,影响吸附效果;共存离子对吸附过程的影响与共存离子的种类和浓度、吸附剂与吸附质的性质等有关。
在吸附法去除重金属离子研究的过程中,对影响因素的深入研究是非常必要的。一方面,可以确定最优的吸附条件,为探究吸附机理提供帮助。另一方面,实际重金属废水成分比较复杂,往往含有多种离子和有机物,研究可以帮助评价吸附剂的实际应用性能。本文总结了各种因素对于吸附性能的影响,以及产生这种影响的途径和机制。
1 吸附材料性质的影响
吸附材料是水体中重金属离子去除最重要的影响因素之一。吸附材料的种类非常多,传统吸附剂如活性炭、沸石分子筛、黏土、金属氧化物等;新型吸附剂如纳米材料、离子印记材料、金属有机框架聚合物(MOFs)、多孔有机聚合物(POPs)等以及各种复合材料。不同吸附剂的物理化学性质具有一定的差异,这是产生不同吸附行为的首要原因。
1.1 物理性质对吸附性能的影响
吸附剂的物理性质主要表现为吸附剂的颗粒尺寸。颗粒尺寸越小,比表面积越大,暴露的活性位点越多,越有利于提高吸附容量。颗粒尺寸小有利于吸附质的传质,从而缩短吸附平衡时间。但颗粒过小可能会引起团聚,反而不利于吸附。颗粒越小,吸附剂的沉降速度越慢,不利于吸附平衡后的固液分离。
比表面积、孔径、孔道结构等是表征吸附材料物理性质的重要参数。一般认为,吸附剂的比表面积越大,能提供的吸附活性位点越多,吸附容量也就越大。比表面积和孔径分布之间有着密切关系,孔径越小,吸附剂的比表面积越大。根据国际纯粹与应用化学联合会(IUPAC)的定义,材料的孔径按照孔隙尺寸可分为微孔(<2 nm)、介孔(2~50 nm)和大孔(>50 nm)。有文献表明,吸附剂的比表面积绝大部分是由微孔提供,贡献率达到了95%左右[8-10]。
孔径除了影响比表面积外,也会影响吸附质在吸附剂中的传质和扩散,从而影响吸附容量和吸附平衡时间。孔径太小,吸附质可能无法进入孔中,不利于去除目标物。适当增大孔径有利于吸附质在孔道内的扩散,从而提高吸附容量和缩短吸附平衡时间。如Yuan等通过研究发现,孔径对吸附剂性能有很大影响,与孔径较小的介孔二氧化硅磁性微球(约2~4 nm)相比,孔径较大的接枝氨基后,可以吸附更多的重金属离子[11]。这是因为,孔径较小的介孔二氧化硅磁性微球接枝氨基后造成孔道阻塞,减小了吸附剂的比表面积以及吸附活性位点的可及性。
另外,规则有序的孔道结构也是吸附质能在孔道快速传质扩散的关键。如介孔二氧化硅具有孔体积大、孔道均一性好、孔道排布有序等特殊的结构优势[12],可以实现重金属离子的快速吸附。Pinnavaia和Mercier通过吸附Hg(Ⅱ)测试了介孔二氧化硅上接枝巯基的可及性,结果表明,与无序结构材料(如非晶二氧化硅)相比,有序介孔材料的活性吸附位点的可及性更好[13-14]。大量研究表明,介孔二氧化硅材料对水体中重金属离子的吸附在几十min甚至十几min内就可完成。李荣华等用氨基功能化SBA-15有序介孔材料吸附去除水体中的Cd2+,在30 min内即可达到吸附平衡[15]。
在吸附去除水体中重金属的研究中,了解各种材料的比表面积、孔径、孔道结构等物理结构和性质是十分有必要的。这对于选取某种类型材料进行优化改善或者进行新型吸附剂开发具有一定的指导意义,同时也可以为吸附机理的探究和分析提供帮助。总的来说,吸附剂的物理性质主要是通过影响活性位点暴露的数量以及吸附质在吸附剂中的扩散传质来影响吸附剂的吸附性能。
1.2 化学性质对吸附性能的影响
吸附剂的化学性质体现在其表面所含有的官能团的种类和数量、氧化与还原性能、掺杂状态等,这决定了其与吸附质之间的化学作用,如离子交换、表面络合、氧化还原等[16]。离子交换是指随着其他阳离子的释放[17-18],重金属离子被吸附到吸附剂上;材料表面的功能基团(羧基,羟基和氨基等)与重金属离子之间的络合反应称为表面络合[19-20];氧化还原是指吸附剂与重金属离子之间发生氧化或还原反应后再将其吸附[21-22]。
Jiang等合成了花球状的氢氧化镁吸附剂,用于吸附去除水中的Ni(Ⅱ),研究发现,Ni(Ⅱ)通过离子交换作用形成的Ni(OH)2固定在吸附剂表面,同时释放出Mg2+[23]。Lu等研究了原位生成锰铁氧化物通过表面络合作用,实现了对水中痕量Hg(II)的高效去除[24]。Jiang等研究铁锰二元氧化物吸附剂去除Co(II)的行为和机理,在吸附剂中铁和锰分别以Fe(Ⅲ)和Mn(Ⅳ)的价态存在,通过FT-IR和XPS分析发现,铁氧化物表现为吸附作用,锰氧化物同时体现出吸附和氧化作用[25],可能的吸附机理如图1和式(1)~式(3)[25]所示。

图1 铁锰二元氧化物吸附剂去除水中Co(II)的机理[25]Fig.1 Schematic diagram of Co(II) removal from water by iron-manganese binary oxide adsorbent[25]
(1)
Co(Ⅱ)-SFe-Mn+MnO2+2H+→
Co(Ⅲ)(aq)+Mn2++H2
(2)
Co(Ⅲ)(aq)+Co(Ⅱ)-SFe-Mn→
Co(Ⅲ)-SFe-Mn+Co(Ⅱ)
(3)
吸附剂表面功能基团在化学吸附中扮演着重要角色,大量研究表明,材料的吸附性能与表面功能基团有密切关系。张新艳等发现,巯基功能化的沸石对Hg(Ⅱ)的吸附容量相对于天然沸石提高了10倍[26]。Zhao等通过L-半胱氨酸功能化,将氨基(—NH2)和巯基(—SH)引入到UiO-66 MOF材料,对Hg(Ⅱ)吸附容量从112.68 mg·g-1提升至350.14 mg·g-1[27]。Zhang等合成了负载聚吡咯的均匀纤维球(UFB-PPy),用于去除水体中的Cr(VI),涉及了离子交换和氧化还原的化学吸附过程,HCrO4-被UFB-PPy中的—N+—吸引,与Cl-发生离子交换而被固定在吸附剂表面,在酸性条件下与聚吡咯(PPy0)发生电子转移,被还原为Cr(III)固定在吸附剂表面[28]。引入表面功能基团可以改善吸附平衡时间,华熠等用四乙烯五胺修饰制备出表面胺基功能化的高分子材料,对水中Cr(VI)的吸附可以在30 min内达到平衡,大大缩短了吸附材料对重金属离子的吸附去除时间[29]。
吸附剂的化学性质不仅影响到吸附容量和吸附平衡时间,可能还会影响不同活性位点对不同重金属离子的亲和力,这就决定了吸附剂的选择吸附性能。对于这种吸附选择性,软硬酸碱理论(HSAB)是一种常用的理论解释[30-31]。HSAB理论以酸碱电子论为基础,即凡是可以接受外来电子对的分子、离子或原子团称为路易斯酸;凡可以提供电子对的分子、离子或原子团称为路易斯碱。路易斯酸和路易斯碱的分类如表1所示。在此基础上,根据酸碱的强度,酸碱又有软硬之分。HSAB理论认为,软酸更易与软碱反应结合,硬酸更容易与硬碱反应结合[31]。总的来说,“硬-硬,软-软”生成的化合物较稳定。根据HSAB理论,在重金属离子的吸附中,重金属离子属于路易斯酸,活性位点属于路易斯碱,他们之间的软硬强度的不同,造成其结合力有一定的差异,即体现了吸附的选择性。此外,吸附活性位点的空间位阻效应也会影响材料的吸附选择性。本课题组前期以带羟基的苯甲醛与吡咯单体为原料,通过改变苯甲醛上羟基的位置,合成了具有不同空间位阻(苯环上羟基与吡咯环上氨基的距离)的聚吡咯甲烷吸附剂,并发现羟基在邻位取代的聚吡咯甲烷对水体中的Pb2+具有更强的选择吸附性能。这主要是因为其活性位点的空间位阻与Pb2+的离子尺寸更匹配,其吸附原理如图2所示[32]。

表1 路易斯酸和路易斯碱的分类[31]
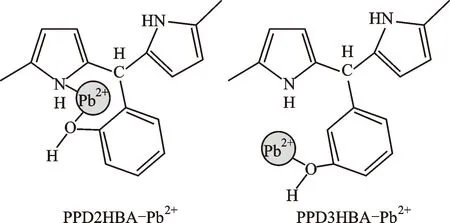
图2 两种聚吡咯甲烷对Pb2+的吸附机理[32]Fig.2 Adsorption mechanism of Pb2+ by two kinds of poly (pyrrole methane)[32]
在吸附研究过程中,准确把握吸附剂的化学结构和性质是必要的,因为这样才能准确分析吸附质与活性位点间的相互作用和构效关系,为深入探索选择性吸附机理提供方向和思路。
2 温度对吸附性能的影响
温度是影响吸附性能的重要参数之一。在水相吸附行为研究中,温度范围一般为10~50 ℃,因为这符合各种污水的实际情况。大量研究表明,吸附性能随温度的变化规律并不一致,有的温度越高,吸附容量越大[30,32-34],而有的随着温度的升高,吸附容量反而降低[35-37]。
温度对吸附性能的影响常常体现在吸附等温线与吸附热力学中。在吸附等温线的分析中,表现为各种吸附等温线模型中参数的变化。在热力学研究中,常用吉布斯自由能变(ΔG)、焓变(ΔH)和熵变(ΔS)等经典热力学参数来评价热力学实验数据[38]。其中ΔG是判断吸附过程能否自发进行和自发程度的一个关键因素,ΔG的值越负,说明吸附过程越容易自发进行,即越有利于吸附,重金属吸附过程中ΔG与温度的变化情况见表2。

表2 重金属吸附过程中吉布斯自由能变(ΔG)随温度的变化情况
除了对吸附的热力学过程产生影响外,温度升高还会影响到吸附材料的性质,导致吸附剂变质,从而影响吸附性能。如Igberase等发现,当温度超过45 ℃时,壳聚糖材料由于不能承受更高的温度而引起吸附剂变质,导致4-氨基苯甲酸接枝的壳聚糖/环氧氯丙烷复合材料对金属离子的吸附性能下降[39]。
3 吸附剂用量和溶液初始浓度的影响
吸附剂用量,在有些文献中也称为吸附剂浓度,单位通常为g·L-1,是评价吸附剂性能的一个常用指标。实验中,通常希望使用更少的吸附剂实现理想的吸附效果。通过系列吸附剂用量梯度的实验来选择最合适的吸附剂用量是必要的,因为当使用优化后的吸附剂用量时,不仅可以使吸附效果最大化,还能保证吸附剂更充分地被利用。一般来说,吸附剂用量在0.5~10 g·L-1之间,就可在较短时间内达到较好的吸附效果[37-38,40-42]。随着吸附剂用量的增加,重金属离子的去除率会先升高,然后逐渐趋于稳定[23,30,43-48]。这是因为,随着吸附剂用量的增加,有效吸附位点的数量也随之增加,重金属离子更容易与有效吸附位点结合,从而使去除率提高。当吸附剂用量达到一定值时,有效吸附位点被充分利用,甚至出现富余,所以再继续增加吸附剂用量,去除率的增高趋势逐渐变缓,最终趋于平衡。有些吸附剂在水中会发生团聚现象[49],这就导致在吸附剂用量增大到一定值时,继续增大吸附剂用量反而不利于重金属离子的去除。如Jamshidifard等将MOFs材料UiO-66-NH2负载到聚丙烯腈/壳聚糖纳米纤维中用于水体Pb(II)、Cd(II)和Cr(VI)的吸附去除。当负载的MOFs质量分数在0~10%时,随着UiO-66-NH2质量分数的增大,吸附容量增加,MOFs质量分数继续增加时,吸附容量反而下降。这是因为,一些MOFs在纳米纤维基体中聚集引起纳米纤维的表面积减小,重金属离子向纳米纤维内部孔隙的扩散更加困难,导致了重金属离子的有效吸附活性位点减少[37]。Zia在研究多孔聚乳酸/壳聚糖纳米纤维对水溶液中Cu(II)的吸附时也发现同样的现象[50]。
溶液初始浓度是影响吸附容量和去除率的关键参数。当采用合适的吸附剂用量时,随着溶液初始浓度的提高,吸附剂容量一般先快速增加,然后逐渐趋于平缓,最终达到一个定值,即吸附饱和[30,36,47,51-53]。这是因为,增加溶液初始浓度,会增大重金属离子与吸附剂活性位点发生碰撞的概率,同时溶液与吸附剂中较大的浓度差产生较大的驱动力,能够促进金属离子在吸附剂中的扩散,即传质效应增强[30,51,53-54]。在初始浓度达到一定值时,吸附剂表面的活性位点被充分占据,超过该浓度后无法实现更多的吸附增强,吸附曲线逐渐趋于平缓。
4 溶液初始pH值的影响
溶液初始pH值是影响重金属离子吸附的重要因素之一。溶液pH值会改变吸附剂活性位点的化学状态和重金属离子在水中的形态,从而影响吸附剂对重金属离子的吸附性能[55-56]。
4.1 溶液初始pH值对吸附材料的影响
大量研究表明,在低pH值(2~4)时,大多数吸附剂对以阳离子为主要存在形态的重金属离子(如Pb(II)、Cu(II)、Zn(II)、Cd(II))吸附性能较差。随着溶液pH值增大,吸附性能会提高。Kenawy等用鸟酰改性纤维素吸附去除水中的Cu(II)、Cd(II)、Hg(II)、Pb(II)和Zn(II)。当溶液pH值在1~6的范围时,材料对5种重金属离子的吸附容量随着pH值的增加而增加[36]。Bashir等在研究马铃薯淀粉磷酸聚合物对Zn(II)、Pb(II)、Cd(II)、Hg(II)的吸附性能时,也得到了相似的结果,溶液pH值在2~7的范围内,吸附容量随着pH值的增加而增加[30]。这一现象通常解释为,低pH值产生的质子化效应,使得吸附剂活性位点带大量正电荷,与目标重金属离子间存在较强的静电排斥作用,以及大量的H3O+和H+与目标离子的竞争吸附[40,57-60]。随着溶液pH值的增加,由于金属离子结合位点的脱质子作用,材料表面的负电荷密度增大,金属离子可以更有效地竞争可用的结合位点,从而提高吸附性能[44,61-62]。
对于含氧阴离子的重金属离子(如As(V)、Cr(VI)等)来说,相对较低的pH值会增大静电吸引作用,有利于吸附。Cuong等在对活性MnO2/生物炭复合材料吸附去除As(III,V)时发现,pH值为4时的吸附去除效果要好于pH值等于7和10时的去除效果,其中吸附剂与含氧阴离子间的静电相互作用有着不可忽视的贡献[63]。Hosseinzadeh等在对Cr(VI)的吸附研究中发现,随着pH值的增加,吸附容量从pH=2时的121 mg·g-1下降到pH=10时的11 mg·g-1。这种行为与活性吸附位点的脱质子化以及OH-和CrO42-离子在高pH值(pH>6)下的竞争性相互作用有关。在酸性(pH=2~6)条件下,吸附剂表面带正电荷的官能团与带负电荷的HCrO4-和Cr2O72-离子间的静电相互作用,达到了较高的Cr(VI)吸附效率[64]。
根据以上讨论可知,表面电荷状态对于材料的吸附性能具有很大影响。材料表面的电荷状态通常采用零电荷点或等电点进行表征。零电荷点是指在一定的温度、压力和溶液组成条件下,吸附材料表面电荷密度为零时的溶液pH值。等电点是指在一定的温度、压力和溶液组成条件下,电动电势为零时的pH值。两者的区别在于零电荷点与外表面、内表面的总电荷量有关,而等电点仅代表了溶液中吸附剂颗粒外表面所带的电荷。当溶剂为惰性电解质或者不存在特性吸附时,等电点与零电荷点的值相等[65]。目前,大多数研究采用zeta电位测试,确定材料的等电点,确定不同溶液pH值时材料表面所带电荷情况。当pH值小于等电点时,材料表面带正电,与阳离子之间有静电排斥作用,不利于吸附,而与含氧阴离子之间有静电吸引作用,有利于吸附;反之亦然。
初始溶液pH值的变化还可能会对材料表面活性位点的结构产生影响甚至是破坏。Weng等合成了磁性二硫代氨基甲酸盐功能化石墨烯,用于吸附去除水体中Cu(II)、Cd(II)等重金属离子,发现在低pH值下,除了大量H+的竞争吸附外,吸附剂吸附活性位点(-N-CS2-)还容易分解,产生胺和二氧化碳,导致材料的吸附容量降低[40]。Choi等在用硫醇功能化纤维素纳米纤维膜吸附去除Cu(II)、Cd(II)和Pb(II)时发现,在pH=2~7的范围内,去除率随pH值先增大后减小,并在pH=4时达到最大。这可能归因于,较高pH值下,二硫键的形成或硫醇发生氧化反应[66]。Monahan等也报道了二硫键的形成和硫醇的氧化在高pH值下易于进行,但在低pH值下可以被抑制的现象[67]。
溶液初始pH值还会对材料在水中的溶解度产生影响。Asiabi等研究发现,在低pH值(pH=3)条件下,吸附材料在溶液中有轻微的溶解,从而导致在pH=3时的吸附性能较差[68]。Zia等研究发现,在pH值较低时的壳聚糖轻微溶解是造成低pH值条件下吸附性能下降的原因之一[50]。
综上所述,溶液初始pH值主要是通过改变吸附材料活性位点的电荷状况来影响材料与重金属离子之间的静电作用,从而影响吸附剂的吸附性能。此外,pH值还会影响吸附材料在水中的溶解度,改变甚至破坏活性吸附位点的化学结构,对材料的吸附性能产生了重要影响。
4.2 溶液初始pH值对重金属离子形态的影响
溶液初始pH值对重金属离子的存在形态会产生很大的影响。如Cu(II)、Pb(II)、Zn(II)、Cd(II)等在pH<6时主要以金属阳离子形式存在,pH>6时,可能会产生氢氧化物沉淀,对于此类重金属离子的吸附研究,主要在pH≤6的范围内。图3a显示Cu(II)在不同溶液pH值条件下的存在形式,从中可以看出:当pH<6时,Cu2+是主要的存在形式;pH>6时,则是以各种Cu(II)与氢氧根的络合产物为主[69]。图3b显示:pH=2~3时,Hg(OH)+和Hg2+是溶液中的主要存在形式,摩尔数占溶液中Hg(II)的70%;pH=4时,Hg(OH)2(aq)摩尔数占溶液中Hg(II)的95%;在pH=6时,Hg(OH)2(aq)的摩尔数比例上升到99.9%[70]。Lu等计算发现,在Cl-存在时,随着pH值的变化,Hg2+形成了HgCl2(aq)、HgClOH(aq)和Hg(OH)2等存在形态(如图3b)[24]。此外,含氧阴离子(As(III,V),Se(IV,VI),Cr(VI)等)随着pH值的变化也存在多种形式。Cr(VI)在溶液中随pH值的变化表现为H2CrO4、HCrO4-、CrO42-、Cr2O72-等多种形式。如图4a所示,当溶液pH<2时,Cr(VI)以HCrO4-和H2CrO4形式为主;当pH=2~4.5时,主要以HCrO4-的形式存在;随着pH值的继续增加,HCrO4-向着CrO42-的形式转变。pH>8时,CrO42-占据绝对的优势[69]。图4b、4c分别为As(V,Ⅲ)和Se(IV,VI)在水中存在状态随pH值的变化[71-72]。
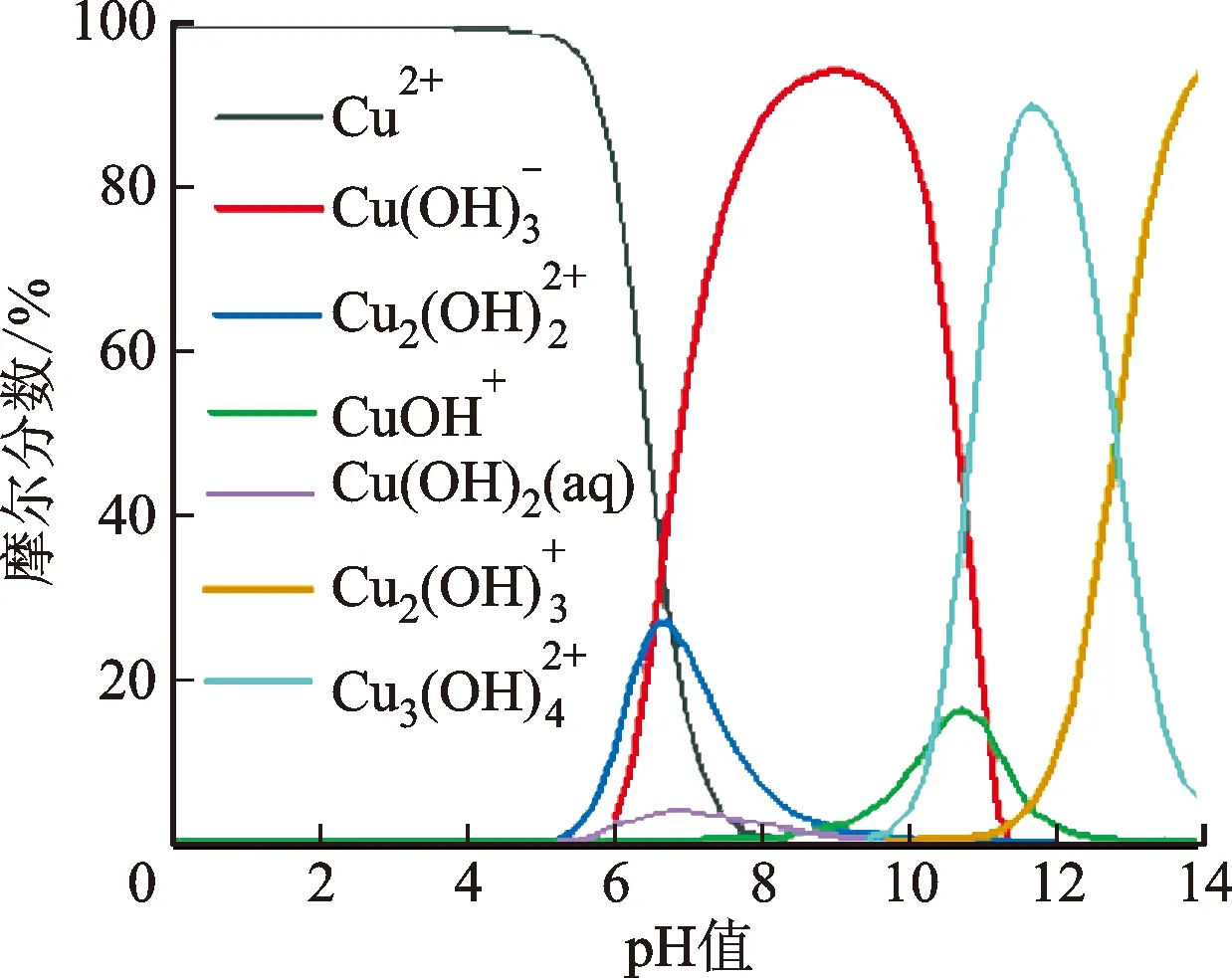
(a)Cu(II)[69]

(a)Cr(VI)[69]
重金属离子存在形态的不同,会影响其与吸附剂活性位点之间的静电相互作用。在活性MnO2/生物炭复合材料吸附去除As(V,III)的研究中,pH=7和pH=10时对As(V)的去除效果与在pH=4时相比均有明显下降,而对As(III)的吸附效果只有在pH=10时才有较为明显的下降。这是因为,在pH=4~10的范围内,As(V)主要以H2AsO4-(pH<7)和HAsO42-(pH>7)阴离子形式存在,As(III)则以非离子型H3AsO3(pH<9.1)和阴离子H2AsO3-(pH>9.1)的形态为主(如图4b)。随着pH值增大,吸附剂的zeta电位越来越负,与As(V)之间的静电斥力越来越大,从而引起吸附能力的下降,而对非离子型的H3AsO3没有产生与静电作用有关的影响[63]。
重金属离子的存在形式不同,它们与活性位点的吸附自由能也会有差别,从而对吸附过程产生影响。如HCrO4-和H2CrO4的吸附自由能分别为-10.46~2.51 kJ·mol-1和-8.79~1.26 kJ·mol-1[35]。吸附法去除Cr(VI)的大量研究显示了一个共同的规律,即随着pH值的增大,吸附容量先增大后减小,最大吸附量停留的pH=3~5的区间内[35,61,69,73-74]。因为在这个区间内,Cr(VI)以HCrO4-为主要的存在形式,与质子化的活性位点有静电相互作用,同时HCrO4-的吸附自由能更低,从而促进了Cr(VI)的去除。
pH值会影响到离子的氧化还原性能。例如,Cr(VI)具有较强的氧化性,尤其是在酸性条件下氧化性更强。据此,许多研究人员研究合成一类吸附剂,首先吸附捕获Cr(VI),再将其还原为Cr(III),固定在吸附剂表面,从而达到去除Cr(VI)和减少水体毒性的目的[33,42,73,75]。
总的来说,pH值对吸附性能的影响是多方面的。在分析pH值影响时,要结合吸附材料和吸附质离子的性质。对于吸附材料来说,需要通过zeta电位测试得到等电点,从而判断其表面的荷电状况。此外,还要注意吸附材料在不同pH值条件下是否有溶解、表面官能团是否会被破坏等问题。对于吸附质离子来说,首先是要弄清楚其在特定pH值条件的离子存在状态,这对于判断离子带电情况,以及与吸附材料活性位点的相互作用非常重要。此外,重金属离子在不同存在形态时的吸附自由能、氧化还原性也同样有着不可忽视的作用。
5 共存离子的影响
电镀、冶金等工业产生的含有重金属离子的废水中往往不只含有一种重金属离子,而是各种有机、无机阴阳离子共存。共存的各种离子可能会对吸附过程产生非常复杂的影响,如离子之间的静电相互作用、金属离子之间产生的竞争吸附、不同离子之间形成的各种复杂的络合物等。所以,采用单一离子的模拟废水不能很好地反应吸附剂对于实际废水的处理情况。同时,探究溶液中各种共存离子对于吸附过程的影响还有助于更加深入地理解吸附机理[76]。
5.1 背景离子的影响
背景离子一般是指水体中常见的Na+、K+、Ca2+、Mg2+等非重金属阳离子,以及Cl-、NO3-、CO32-、PO43-、SO42-等无机阴离子。背景离子的存在可能会与目标离子之间产生协同或竞争作用,影响吸附剂与吸附质之间的静电作用,影响重金属离子的存在状态等。背景离子的离子强度是影响吸附过程的重要因素之一。离子强度对不同的吸附过程产生不同的影响,这与吸附剂与吸附质的性质以及相关的吸附机理有关。对于有些吸附过程来说,背景离子的存在对吸附结果几乎不产生影响[76-78],如Zhou等发现纳米二氧化锰-生物质复合材料对Cu(II)的吸附过程中,存在0.001~0.1 mol·L-1NaNO3并没有对吸附容量造成显著影响[77];聚吡咯/累托石复合材料吸附Cr(VI)的研究发现,存在阴离子Cl-、NO3-和CO32-均未明显影响该复合材料对Cr(VI)的吸附性能。这是因为,对于Cr(VI)的吸附涉及吸附还原过程,富电子的聚吡咯将Cr(VI)还原为Cr(III),根据勒夏特列原理,平衡向有利于吸附的方向移动,从而促进Cr(VI)的进一步吸附去除。阴离子Cl-、NO3-和CO32-的氧化性较弱,不足以被聚吡咯还原[73]。有些背景离子在低浓度时对吸附基本无影响,但在高浓度条件下就会产生明显的影响[79-80]。如Musso等在pH=5.5的条件下,用Na+调节溶液的离子强度,发现膨润土对Cu(II)和Ni(II)的吸附容量随着离子强度的降低而增加,在Na+浓度低于0.05 mol/L时,膨润土对Cu(II)和Ni(II)的吸附容量保持最大值[79]。
在离子强度相同时,背景离子的种类会对吸附过程产生不同的影响[80-84],这与背景离子的水化半径和结构、荷电性质等有关。Khandaker等在对铯(Cs+)的吸附研究中发现,相同浓度的K+和Na+对于吸附过程的影响存在差异。K+对Cs+的吸附影响相对较大,这是因为K+的水化半径(0.33 nm)比Na+的水化半径(0.36 nm)更接近Cs+(0.325 nm)[81]。Wei等用胺类吸附剂去除水中砷和硒时,发现无机阴离子对吸附过程的影响大小顺序为PO43-、SO42-、NO3-、SiO32-[72]。Hu等探究发现PO43-对As(V)吸附的抑制效果最明显,其他文献也报道了不同类型吸附剂对磷酸盐与砷酸盐的竞争性吸附,得到了相似的结论[80,82,85-88]。这是由于,磷和砷均位于第VA族,所以砷酸盐和磷酸盐具有相似的离子结构和化学性质,具有相同的吸附活性位点[83,89]。
无机离子对吸附过程的影响会因目标重金属离子的不同存在一定的差异[84]。例如,Li等研究了在pH=7时,不同离子强度(不同浓度NaCl)对As(V)和As(III)吸附过程的影响发现,离子强度对于As(III)几乎没有影响,但离子强度增大,反而有利于As(V)的吸附。这是因为在pH=7时,As(V)和As(III)分别以HAsO42-和H3AsO3的形式存在。随着共存离子浓度从0增加到0.1 mol·L-1,吸附剂的zeta电位从-37.4 mV变为-5.4 mV,减小了吸附剂与HAsO42-的静电排斥,而对不带电的H3AsO3几乎没有影响[80]。Song等在研究无机离子对生物质复合材料吸附去除Cr(VI)和Cd(II)时发现,碱金属和碱土金属离子对Cd(II)吸附性能的影响要略大于Cr(VI);阴离子SO42-、NO3-、Cl-和PO43-对于以阴离子形态存在的Cr(VI)的吸附过程有明显的抑制作用,而对以阳离子形态存在的Cd(II)的吸附则有明显的促进作用[84]。这主要是由于,两种目标离子的电荷状态不同,背景阴离子引起的吸附剂电荷状态的变化导致两种目标离子与吸附剂之间产生了完全相反的静电效应。
5.2 背景离子的影响机制
背景离子强度对于吸附过程的影响途径是多样的,一般认为有以下几点。
(1)溶液背景离子强度的增大,增加了其与重金属离子之间的吸附竞争,从而减少了重金属离子能够获得的有效吸附位点[54]。
(2)改变了吸附剂的zeta电位,影响与目标重金属离子之间的静电相互作用[80]。
(3)离子强度的增加可以减少静电斥力,从而引起粒子聚集,减少有效吸附位点的数量,从而减少对目标重金属离子的吸附[54,79,90-92]。
(4)影响目标重金属离子的活度系数,限制了它们在吸附剂表面的吸附过程[79,92]。
(5)溶液的背景离子可能会影响吸附剂的扩散双电层厚度和界面电位,从而区分外球(对离子强度敏感)和内球(对离子强度不敏感)表面复合物[76,93]。进一步解释就是,对于离子强度敏感,静电吸引或离子交换是其中一种主要的吸附机制;反之,其吸附机制基本不涉及到静电吸引或离子交换[91]。
(6)溶液的背景离子可能会与重金属离子形成不利于吸附的水溶性金属阴离子络合物[94]。如Cl-会与Hg形成HgClOH、HgCl+和HgCl2(aq)[24],也会与Cd形成CdCl+[94]。
5.3 重金属离子之间的相互影响
重金属废水中常包含了多种重金属离子,它们在电荷性质、离子尺寸、化学性质等方面存在一些相似之处,在吸附过程中可能互相影响,这种影响可能是相互抑制,也可能是相互促进。如含羧基的聚芳醚砜对Cu(II)、Pb(II)和Cd(II)的选择性吸附研究中发现,在竞争吸附条件(3种离子共存)下,对于Pb(II)、Cd(II)和Cu(II)的吸附容量相对非竞争条件(离子单独存在)下分别下降了31.1%、74.03%和37.35%[43]。生物质复合材料吸附去除Cd(II)和Cr(VI)的研究中,Ni(II)、Cu(II)、Zn(II)对Cr(VI)的吸附有明显的促进作用,其中Cu(II)的促进效果最为明显[84]。Zhu等在之前的相关研究中也得到了相同的结果,这是因为Cu(II)与吸附剂中的中性亚胺基团的配位作用使其携带一定数量的正电荷,增加了与Cr(VI)之间的静电吸引[95]。Ren等观察到,在磷酸盐存在的情况下,通过静电吸引、三元表面络合和或表面沉淀可以增强Cu(II)的吸附[96]。Huang等发现,Cd(II)的吸附使磁性氧化石墨烯的双静电层压缩,将其表面的负电荷中和,削弱了pH=5.0时表面带负电荷的氧化石墨烯与H2AsO4-之间的静电斥力,从而促进了As(V)的吸附去除。同时,吸附剂会与As(V)、Cd(II)形成三元表面配合物,表面配合物中暴露的As(V)可以作为新的吸附位点,通过静电吸引和络合作用连续吸附溶解在溶液中的Cd(II)[97]。两性生物吸附剂吸附Cr(VI)和Cu(II)的过程中,两种重金属离子之间微弱的相互影响可忽略不计[98]。
由上述可知,重金属离子之间的相互影响有竞争吸附和协同去除两种情况。一般来说,带同种电荷的离子间往往存在竞争关系,而带异种电荷的离子间常表现为协同去除。竞争吸附主要是因为这些重金属离子具有相同(或部分相同)的吸附位点,使得它们的吸附过程产生了相互抑制作用[43],而协同作用往往是由静电作用、三元表面络合引起的[95-97]。
5.4 选择性吸附
水中的重金属离子不仅是一种污染物,同时也是一种宝贵的资源。近年,人们越来越注重于材料选择吸附性能的研究,以此来实现对目标重金属离子的选择性吸附,从而达到对重金属资源循环利用的目的。吸附剂的选择性主要是通过静电相互作用、不同功能基团对重金属离子不同的亲和性、吸附活性位点的空间位阻效应等来实现的。如从厌氧消化污泥中提取的生物炭吸附剂对Pb(II)具有比Cd(II)更好的吸附选择性,这归因于不同的金属特性和由此产生的对吸附位点的亲和力差异。Pb(II)的水合半径(0.401 nm)小于Cd(II)(0.426 nm),且Pb(II)的水解常数的负对数(7.71)低于Cd(II)的(10.1)。这些金属特性使得Pb(II)比Cd(II)更容易通过内表面络合被生物炭吸附。此外,Pb(II)与Cd(II)具有完全相同的吸附位点。Pb(II)为硬路易斯酸,电负性较高(2.33),Cd(II)为软路易斯酸,电负性较低(1.69),这也导致Pb(II)对有机物中的大部分官能团(包括羧基和酚羟基)具有更强的亲和力[99]。
对于吸附剂选择性能的研究,常用分布系数Kd和选择性系数α作为评价标准。Kd(mL·g-1或L·g-1)表示在达到吸附平衡时吸附剂上的重金属离子浓度(mg·g-1)与溶液中重金属离子浓度(mg·L-1)的比值,Kd越大说明越容易被吸附,即吸附剂对该离子的吸附选择性越好。Kd表达式为
(4)
式中:qe是吸附平衡时吸附剂上重金属离子吸附容量;Ce是吸附平衡时溶液中重金属离子的浓度;C0是溶液的初始重金属离子浓度;V指的是溶液的体积;m是加入的吸附剂的质量;Kd1和Kd2分别是目标重金属离子和干扰离子的分布系数。
选择性系数α是目标重金属离子和干扰离子的分布系数的比值
α=Kd1/Kd2
(5)
根据定义我们可以知道,α值越大,其吸附剂对干扰离子的亲和力越低[27]。Zhao等对L-半胱氨酸修饰的Uio-66 MOFs材料的吸附选择性进行了研究,以Hg(II)为目标离子,Cr(VI)、Mg(II)、Ni(II)、Cd(II)、Fe(III)、Li(II)、Cu(II)、Zn(II)为干扰离子进行实验探究,然后计算每种离子的分布系数Kd和选择性系数α(见表3)。结果表明,L-半胱氨酸修饰过的Cys-UiO-66对Hg(II)的Kd值远大于其他离子,说明Cys-UiO-66对Hg(II)的有非常强的吸附选择性[27]。

表3 UiO-66在有共存离子时吸附Hg(II)的分布系数Kd和选择性系数α[27]
6 有机物的影响
水环境中有机物对于重金属离子吸附的影响不容忽视,其中以腐殖酸(HA)和黄腐酸为代表,因为它们包含了天然水体中约60%有机物。腐植酸含有丰富的羧基、酚基和醇基等功能基团,与水体系中溶解的重金属离子和固体吸附剂表面官能团相互作用,从而影响对重金属离子的吸附[91,100]。Goh等研究发现天然有机物可以通过阻碍LDH表面传质、直接竞争吸附活性位点来抑制砷酸盐的吸附[100]。而Khan等发现HA的存在对Cd(II)的吸附有一定的促进作用[76]。
有机物对重金属离子吸附过程的影响是复杂的,如Yang等在研究碳纳米管/聚丙烯酰胺复合材料吸附Pb(II)时发现,HA对于Pb(II)的吸附过程有明显的影响,且与HA的浓度有很明显的关系。在CHA<7.5 mg/L和CHA>12.5 mg/L时,Pb(II)的吸附容量随着HA浓度的增大而增加;当7.5 mg/L 上述结果表明,水中有机物对于重金属离子吸附的影响是非常复杂的,与重金属离子的种类、吸附剂的性质、有机物的种类和初始浓度都有密切的关系。 (1)吸附剂的物理和化学性质是影响吸附过程的首要因素。吸附剂的粒径、比表面积、孔径分布与孔道结构等物理性质,主要通过影响暴露的活性吸附位点的数量和吸附质的传质扩散过程,来影响吸附容量与吸附平衡时间。吸附剂不同的化学性质除了会影响到吸附容量和吸附平衡时间,还决定了吸附剂的吸附选择性。这取决于吸附活性位点对不同重金属离子之间特定的构效关系以及亲和力的差异。 (2)温度的影响主要与吸附过程的热力学性质有关。 (3)增加吸附剂用量会引进更多的活性位点,从而提高重金属离子的去除率,但在研究中还需要考虑到成本、活性位点的利用率和过多吸附剂是否会引起团聚现象等问题。 (4)增大溶液初始浓度会增大重金属离子与吸附剂活性位点发生碰撞的概率,同时溶液与吸附剂中较大的浓度差产生大的驱动力,能够促进金属离子向吸附剂中的扩散传质。在初始浓度达到一定值时,吸附剂表面的活性位点被充分占据,继续增大初始浓度,吸附不再增强。 (5)pH值会改变吸附剂活性位点的化学状态和重金属离子在水中的存在形态,进而影响吸附剂与吸附质之间的静电相互作用和吸附自由能,改变吸附剂性能。pH值也会引起吸附剂活性位点或重金属离子的氧化还原性,对涉及到还原和氧化的过程会产生较大影响。此外,溶液过酸或过碱时可能会导致某些吸附剂的溶解。 (6)共存无机离子的强度和种类不同,会对吸附过程产生不同的影响。背景离子与目标离子竞争活性位点,改变吸附剂与吸附质之间的静电作用、改变目标金属离子的活度系数和存在状态。 (7)有机物往往含有丰富的官能团,对重金属离子的吸附过程产生较为复杂的影响。有机物会与重金属发生络合反应,也会与活性位点结合,带电的有机物还会影响吸附过程的静电作用。至于这种影响是促进还是抑制了吸附过程,则需要结合实验具体分析。 在吸附法去除重金属离子研究的过程中,对于影响因素的深入研究是非常必要的。一方面,可以确定最优的吸附条件,为吸附机理的探究提供帮助;另一方面,可以帮助评价吸附剂在成分复杂的实际废水中的应用价值。7 总 结
