季盐对气体水合物相平衡影响研究进展*
2022-03-02段汉坤谢应明谢梅萍
段汉坤,谢应明†,谢梅萍
季盐对气体水合物相平衡影响研究进展*
段汉坤1,2,谢应明1,2†,谢梅萍1,2
(1. 上海理工大学 能源与动力工程学院,上海 200093;2. 上海市动力工程多相流动与传热重点实验室,上海 200093)
季盐是一种高效的水合物生成添加剂,通常通过填充水合物笼达到改善水合物相平衡条件的效果。季盐对CH4、CO2等气体水合物相平衡条件的影响效果主要与季盐浓度有关。就甲烷水合物而言,同等相平衡压力条件下,TiPeAF和TiAAB对相平衡影响显著:添加了TiPeAF(0.315%)、TiAAB(0.438%)的体系,其相平衡温度分别比纯水体系高20 K和22 K;TBANO3、TAAB、TAAC对相平衡影响甚微:其相平衡温度较添加TBAB、TBAC等季盐的体系低10 K。对于CO2水合物,添加TiAAB的体系相平衡温度比纯水体系高29 K,添加TBAF体系的相平衡温度比纯水体系高26 K。此外,季盐与其他类型添加剂复配后对水合物的相平衡条件有更好的提升效果:相较于仅添加TBAB的体系,TBAB(0.05%)和NaCl(0.03%)的复配体系可以使水合物相平衡温度再升高10 K。
季盐;气体;水合物;相平衡;显微结构
0 引 言
水合物通常是在一定温度和压力下由水分子与客体分子(如N2、CO2、CH4等)共同形成,水分子直接通过氢键互相连接形成晶穴,客体分子进入晶穴而形成笼型水合物。水合物应用范围广泛,但是由于其较为严苛的生成条件导致其在实际运用中存在困难。研究如何降低水合物生成条件、加快水合物生成速率显得至关重要。其中添加促进剂是高效制备水合物的研究热点,研究人员发现季盐类促进剂要比其他水合物促进剂更好[1]。季盐是一种可溶于水的热力学添加剂,研究较多的季盐有丁基铵盐(T-butylammonium X, TBAX)和丁基膦盐(T-butylphosphonium X, TBPX),如四丁基溴化铵(tetrabutylammonium bromide, TBAB)、四丁基氯化铵(tetrabutylammonium chloride, TBAC)、四丁基氟化膦(tetrabutylphosphonium fluoride, TBAF)、三丁基氧化膦(tri-n-butyl phosphine oxide, TBPO)等;还有甲基铵盐(T-methylammonium X, TMAX)、乙基铵盐(T-ethylammonium X, TEAX)、丙基铵盐(T-propylammonium X, TPrAX)、戊基铵盐(T-amylammonium X, TAAX或T-pentylammonium X, TPeAX)、异戊基铵盐(T-isoamylamylammonium X, TiAAX或T-isoamylpentylammonium X, TiPeAX)也会对水合物的相平衡产生不同程度的影响。其中阴离子X常见的有氟离子(F−)、氯离子(Cl−)、溴离子(Br−),除此之外还可以是硝酸根离子(NO3−)、氢氧根离子(OH−)、醋酸根离子(CH3COO−)、氧离子(O2−)等。其中甲、乙、丙基的季盐会使得水合物相平衡条件趋于低温高压方向,而丁、戊、异戊基季盐则会使水合物相平衡条件趋于高温低压方向。本文介绍有季盐参与生成的半笼型水合物结构的特殊性,从对相平衡条件的影响综述各类季盐对不同种类水合物相平衡的影响。分析不同种类季盐产生不同效果的原因,最后提出今后关于季盐对水合物相平衡影响的研究方向。
1 季盐对水合物相平衡的影响
1.1 季盐简介
笼型水合物的晶体结构通常包括I型、II型和H型。半笼型水合物促进剂大多为季盐类有机物,氨离子或膦离子中的氢原子被烷基取代即为季盐[2]。1940年FOWLER等[3]发现一系列季铵盐水溶液可以在常压下形成水合物,而且熔点也相对较高,如TBAF生成的水合物熔点可达37℃。随后JEFFREY等[4]利用X射线衍射研究发现这类水合物的阴离子(如F−、Cl−、Br−等)会替代一个水分子参与晶穴的构成,阳离子(如TBA+)则会占据大孔穴,即形成“半笼型水合物”。常见的半笼型水合物结构包括六边形结构(2P∙2T∙3D∙40H2O, HS)、四边形结构(4P∙16T∙10D∙172H2O, TS)和立方结构(48T∙16D∙368H2O, SCS)[5]。如图1所示,TBAB质量浓度(若无特殊说明,文后均指质量浓度)较低时(<18%)为HS型、浓度较高时(>18%)为TS型[6]。TBAC为TS型[7]、TBAF可以形成TS或SCS型(超立方结构)[8]。
TBPB可形成TBPB∙32H2O和TBPB∙38H2O两种不同结构的半笼型水合物[9],TBPB∙38H2O的结构如图2所示,其与TBAB形成的HS结构类似。

图1 HS半笼型水合物(左)和TS半笼型水合物(右)结构[6]

图2 TBPB∙38H2O的结构图
将上述季盐加入到CO2/CH4/H2等气体+ 水体系中,这些小气体分子会进入季盐形成的“半笼型水合物”的小孔穴之中。在这种特殊的结构中,客体分子(气体小分子和季盐的阳离子)与主体分子(水分子)间不仅有范德华力作用,还有氢键作用,因此半笼型水合物拥有更好的热力学稳定性[10],从而使水合物的相平衡条件向着高温低压的方向偏移。
然而,并非所有季盐都会生成半笼型水合物,如KHAN等[11]发现TMAOH/TEAOH/TPrAOH + CH4+ CO2体系的水合物解离焓数据与I型水合物相近,但水合物的解离焓往往和水合物结构有关,因此部分季盐可能不会生成半笼型水合物。在TMAC/TEAOH/TPrAOH + CO2+ H2O体系中也得出了类似的结论[12]。这些碳链较短的甲基、乙基、丙基铵盐往往使原水合物的相平衡压力更高,这与半笼型水合物的特性不符。水合物的相平衡条件和水合物的结构有一定相关性,但是这些季盐的结构数据还较少,需要更进一步的研究。
1.2 对CH4水合物相平衡的影响
甲烷水合物大量存在于自然界中,具有替代传统化石能源的潜力[13],还可应用在海水淡化、天然气固态储运等方面[13-14]。季盐对CH4水合物相平衡影响的研究很多,在TBPB[15-17]、TBPC[18]、TBPO[19]、TBAC[20-21]、TBAB[22]、TBAF[23]等研究实验中,均发现随着季盐浓度的增加,相平衡曲线均不断右移,但移动幅度不断变小。说明随着季盐浓度的增加,CH4水合物相平衡条件向着高温低压的方向偏移,但季盐对CH4水合物的相平衡条件的影响不是线性的,越多的季盐使其相平衡条件向高温低压方向偏移的趋势逐渐减小,过多的季盐甚至会降低CH4水合物稳定性。除上述季盐外,TBANO3、TBAOH、TAAB、TAAC、TiAAB、TiPeAF均可在不同程度上使CH4水合物的相平衡条件向着高温低压的方向偏移。大部分季盐对CH4水合物相平衡的影响类似,随着季盐浓度增大,CH4水合物相平衡条件向高温低压趋势先变大后减小,即存在一个最佳浓度。将上述研究中各种季盐浓度与最佳浓度整理于表1中,发现各种季盐的最佳质量分数大多在0.30 ~ 0.35之间。但TAAB的最佳质量分数为0.1,TiAAB、TiPeAF、TAAC、TBANO3的研究浓度较为单一,还需进一步研究。
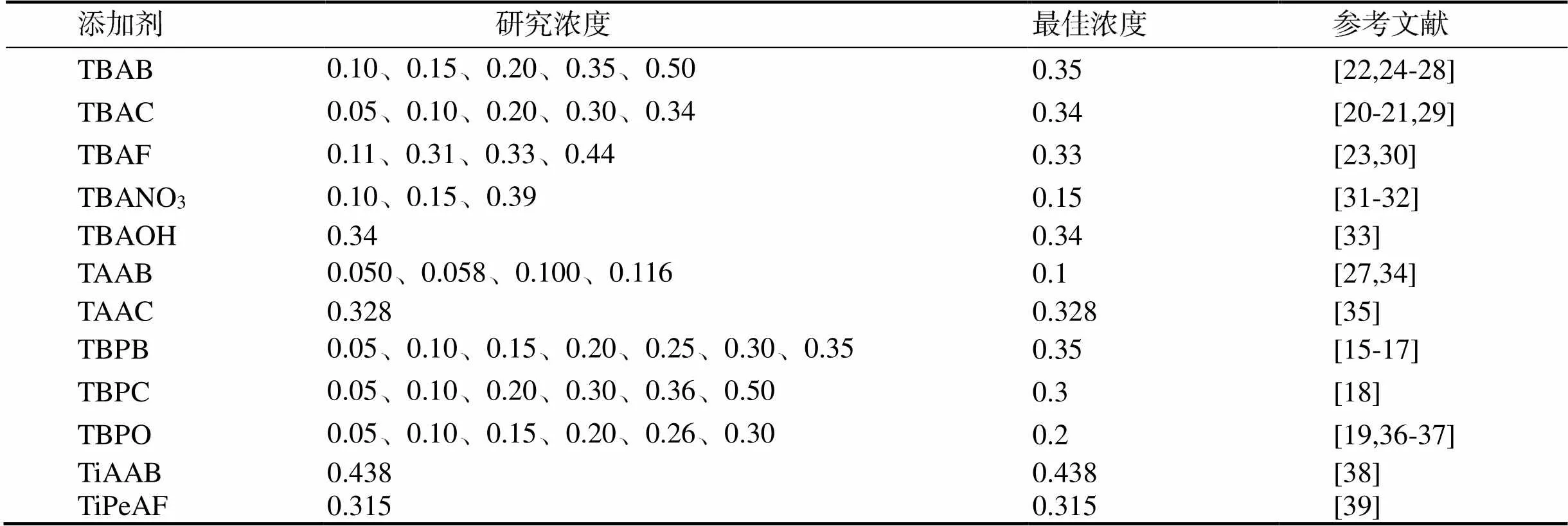
表1 各种季盐对CH4水合物相平衡影响研究
从表1选取各种季盐的最佳浓度的相平衡数据整理于图3。从图中可以观察到,TiPeAF和TiAAB对相平衡的影响最明显,在相同相平衡压力下,添加TiPeAF(0.315%)和TiAAB(0.438%)的体系,其相平衡温度可比纯水体系分别高20 K和22 K。TBANO3、TAAB、TAAC对相平衡影响最不明显,其相平衡温度比添加TBAB、TBAC等季盐的体系低10 K。
从图3中还可以观察到,对于丁基铵盐,其使相平衡向高温低压方向偏移的作用随阴离子的摩尔体积减小而增大[41]。文献[7]中离子半径的数据列于表2,发现此规律不仅限于丁基铵盐中,在阳离子相同的情况下,阴离子半径越大,半笼型水合物相平衡条件越严苛,但O2−例外,是由于在TBPB和TBPC中,阳离子均有4条碳链,但是在TBPO中仅有3条碳链,由此可以推断碳链的数量也可能是影响半笼型水合物相平衡条件的一项因素。TiAAB与TAAB的化学式虽相同,但由于结构不同而导致对水合物相平衡的影响大不相同,需要在以后进行更多的结构分析。

图3 各种季盐最佳浓度对CH4水合物相平衡的影响

表2 阴离子半径[7]
1.3 对CO2水合物相平衡的影响
CO2会造成全球气候变暖,但全球CO2排放量居高不下,水合物封存[42]可以在一定程度上减少CO2的排放量。此外,CO2水合物也是一种当今研究的替代型蓄冷介质[43]。但是其有生成压力高、诱导时间长等缺点,引入季盐类添加剂可以有效缓解。
有学者研究了TBAB[44-45]、TBAC[46]、TBAF[23]对CO2相平衡的影响,均发现随着季盐浓度的增大,半笼型水合物的相平衡条件向着高温低压方向偏移,且均存在最佳浓度,当季盐浓度过大时,对相平衡的缓解效果将会降低。如YE等[45]发现当TBAB质量分数为0.55时,水合物相平衡温度有所降低,并介于0.19 ~ 0.32之间。
ZHOU等[44]研究了TBAB质量分数为0.01 ~ 0.32对CO2水合物相平衡的影响。随着TBAB的浓度增加,在一定的压力下,平衡温度明显升高。平衡压力对温度更加敏感。这使得CO2+ TBAB体系会更适用于空调系统却不适用于储气库和其他应用中。YE等[46]发现当TBAC或TBPC的质量分数从0.01增加到0.35时,相平衡温度的升高幅度不断变小,并发现在较低压力下TBAC或TBPC对缓和CO2水合物的相平衡条件的作用更明显。LEE等[23]发现在质量分数为0.448的TBAF + CO2体系中,只有部分TBAF参与了半笼型水合物的形成,剩下的TBA+和F−均以自由离子的形式存在。它们会对半笼型水合物形成抑制作用。这很好地解释了季盐具有最佳浓度的原因。
不同于其他添加剂,从SILVA等[19]的研究发现,TBPO浓度的增加对CO2水合物的相平衡影响趋势却不明显,而且在不同的压力下,最佳浓度不同,例如当压力为1.0 MPa和1.5 MPa时最佳质量分数为0.15,但当压力增加到2.0 MPa和3.0 MPa时最佳质量分数则变成了0.20和0.30。这可能与TBPO的结构特殊有关。

表3 各种季盐对CO2水合物相平衡影响研究
TBAA、TAAB、TAAC、TBANO3、TiAAB均有实验证明可使CO2水合物相平衡条件向高温低压方向偏移[47-53],现有研究中各种添加剂最佳浓度见表3,其规律与CH4水合物类似,最佳质量分数也在0.30 ~ 0.35之间。TAAB、TBPO的最佳质量分数为0.1和0.15。其中TiAAB、TBAF效果较好,在相同相平衡压力下,添加TiAAB和TBAF的体系,其相平衡温度比纯水体系分别高29 K和26 K。
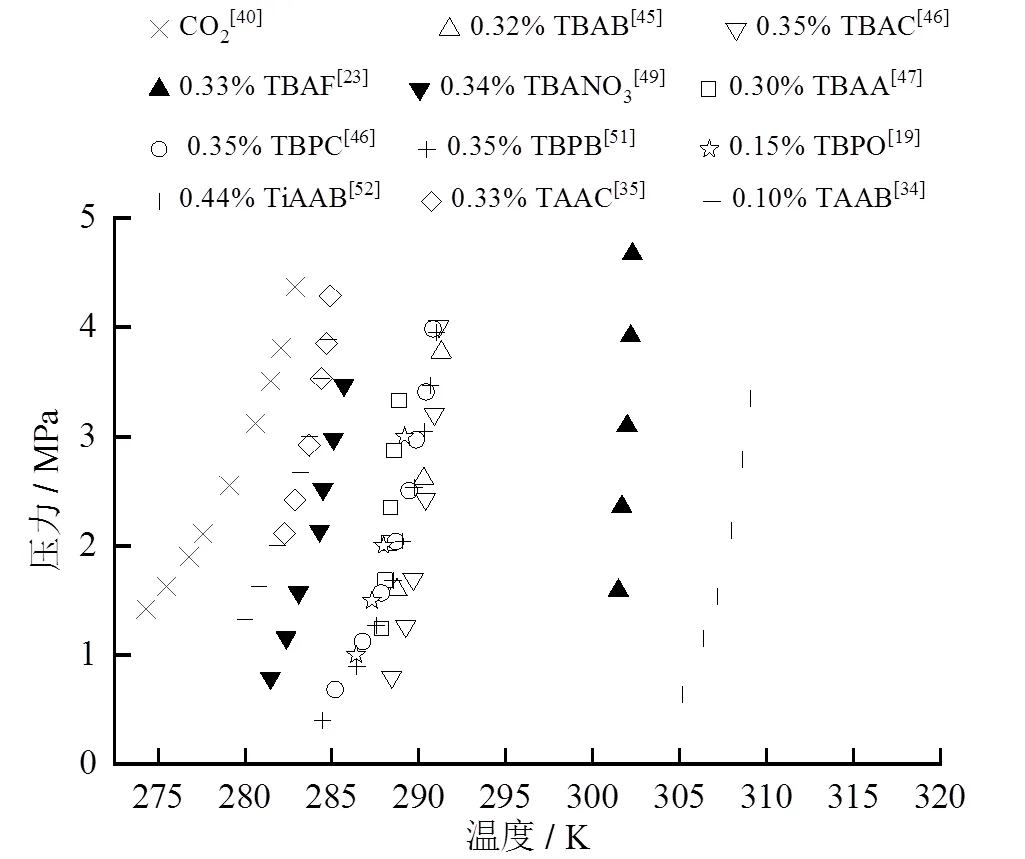
图4 各种季盐最佳添加浓度对CO2水合物相平衡的影响
将表3中各种季盐的最佳浓度的相平衡数据整理于图4中,将图3与图4对比,总结各种季盐对CO2水合物和CH4水合物相平衡的影响,可以得出一些相同的结论如:在阳离子相同的情况下,阴离子半径越大,半笼型水合物相平衡条件越严苛;在阴离子相同的情况下,季盐对水合物热力学稳定性的促进效果为异戊基> 丁基> 戊基;季盐均存在最佳浓度;但也有不相同的结论,如对于CO2水合物,TBANO3最佳质量分数是0.15,但是对于CH4水合物,最佳质量分数是0.34。
1.4 对其他气体水合物相平衡的影响
N2水合物可以用于CO2捕集和水合物储氢等方面[54-55]。H2是一种新型的清洁能源,但由于其易燃易爆的性质,H2的安全储存与运输显得至关重要。李璐伶等[56]指出水合物储氢是一种可行的储氢材料,当加入季盐生成半笼型水合物时,虽然稳定性提高,但是储能密度却会下降。除此之外,季盐还被应用在Ar、Xe、H2S、CF4等气体水合物生成过程中,将现有的研究列于表4。

表4 各种季盐对其他气体水合物的影响研究
由表4可知,这些季盐对绝大多数气体的相平衡影响作用类似,即都可以使水合物的相平衡条件向着高温低压的方向偏移,且具有最佳浓度,但有些实验数据较为匮乏,需要在未来进一步研究。此外部分季盐对某些气体水合物的相平衡影响有特殊性,如KARIMI等[60]研究TBAOH对H2水合物的相平衡影响时发现,在不同压力下最佳浓度不同,但两者之间的关系并不明显;BABAEE等[63]研究了TBAB对CF4水合物相平衡的影响,结果发现TBAB对CF4水合物的相平衡影响不大。
1.5 使水合物相平衡向低温高压趋向的季盐
在天然气和石油工业中,水合物的形成会造成管路堵塞,影响工业正常运行,造成巨大损失[64]。碳链较短的甲、乙、丙基铵盐可作为水合物抑制剂应用在这些领域中[65]。TMAA[66]、TMAB[27-28,65,67]、TMAC[12,68]、TMAOH[69-70]、TEAB[27-28,65,67]、TEAC[71]、TEAI[65,67]、TEAOH[12]、TPrAB[27]、TPrAOH[12,33]、TPeAOH[33]等季盐均被研究证明可使CH4或CO2水合物的相平衡向低温高压方向偏移。
QASIM等[65,67]研究了TEAB、TEAI、TMAB三种季盐对CH4和CO2水合物相平衡影响,KHAN等[12]研究了TMAC、TEAOH、TPrAOH对CO2水合物相平衡影响,均发现影响效果和季盐种类与浓度有关,浓度越高,相平衡向低温高压方向偏移越大。不同种类季盐的作用虽有不同但差距不大。SU等[27,33]研究指出,部分季盐会使得水合物相平衡向低温高压方向偏移,类似于被广泛研究的无机盐NaCl,这说明水合物熔点的下降有可能是一种综合效应,即熔点的降低只与溶质的浓度有关。QASIM等[65]在其研究中还发现TEAB、TEAI、TMAB三种季盐与乙二醇组成混合剂有更强的使相平衡向低温高压方向偏移效果。

表5 季盐与其他物质复配对水合物相平衡影响的实验研究
2 季盐与其他物质复配对水合物相平衡的影响
当季盐与其他物质复配时,可以进一步降低水合物相平衡压力,在现有的研究中,其他物质主要有热力学添加剂、无机盐和纳米颗粒。将一些学者研究得出的结论列于表5中,可以发现,季盐与热力学添加剂或NaCl一起使用时,一般情况下可以进一步改变相平衡条件:在相同压力下质量分数为0.05的TBAB和0.03的NaCl可使得相平衡温度再升高10 K。但是,在部分复配浓度下,促进效果不明显甚至会有反作用,因此如何复配才能得到更好的促进效果还需进一步研究;与纳米颗粒共同使用时,相平衡数据变化不大或向着低温的方向偏移1 K左右。
3 结 语
本文总结归纳了季盐对水合物相平衡的影响,得到如下结论,并提出一些建议:
(1)丁基季盐会打破水合物的常规结构,其中的阴离子会替代一个水分子参与晶穴的构成,阳离子则会占据大孔穴,形成“半笼型水合物”。但碳链较短的甲、乙、丙基季盐不会形成“半笼型水合物”,其结构研究还较少,需要进一步研究。
(2)对于CH4水合物,在相同相平衡压力下,质量分数为0.315的TiPeAF和质量分数为0.438的TiAAB可使水合物相平衡温度高于其他体系15 K甚至更多,TBAOH与TBAF的效果次之,BANO3、TAAB、TAAC的效果最低。对于CO2水合物,在相同压力下,添加TiAAB和TBAF,其相平衡温度高于其他体系至少13 K。使水合物相平衡条件向高温低压趋向的季盐均有最佳浓度,大多数季盐的最佳质量分数在0.3 ~ 0.35之间。
(3)季盐使相平衡条件向高温低压趋向作用除了与浓度有关外,还与碳链长度和数量、阴离子半径有关。不同长度碳链促进效果为异戊基> 丁基> 戊基,阴离子半径越小促进效果越强。通过此规律便于寻找效果更好的季盐,有关异戊基与戊基季盐之间的差异也值得深入研究。
(4)季盐与其他种类添加剂一起使用可以进一步加强相平衡条件偏移的趋势,但如何复配以获得更好的效果还需要继续深入研究。与纳米颗粒共同使用时,相平衡数据变化不大或向着低温的方向偏移1 K左右。
(5)使水合物相平衡条件向低温高压偏移的季盐,其效果与季盐种类关系不明显,类似于无机盐NaCl,效果会随季盐浓度增大而增强。
[1] 周麟晨, 孙志高, 李娟, 等. 水合物形成促进剂研究进展[J]. 化工进展, 2019, 38(9): 4131-4141. DOI: 10.16085/j.issn.1000-6613.2018-2415.
[2] 李亮. 室温稳定四异戊基溴化铵半笼型水合物的合成、结构及性能研究[D]. 广州: 华南理工大学, 2018.
[3] FOWLER D L, LOEBENSTEIN W V, PALL D B, et al. Some unusual hydrates of quaternary ammonium salts[J]. Journal of the american chemical society, 1940, 62(5): 1140-1142. DOI: 10.1021/ja01862a039.
[4] JEFFREY G A. Water structure in organic hydrates[J]. Accounts of chemical research, 1969, 2(11): 344-352. DOI: 10.1021/ar50023a004.
[5] 史伶俐, 梁德青, 丁家祥. 季铵盐半笼型甲烷水合物激光拉曼光谱研究[J]. 工程热物理学报, 2018, 39(11): 2362-2365.
[6] SHIMADA W, EBINUMA T, OYAMA H, et al. Separation of gas molecule using tetra-n-butyl ammoniumbromide semi-clathrate hydrate crystals[J]. Japanese journal of applied physics, 2003, 42(2A): L129-L131. DOI: 10.1143/JJAP.42.L129.
[7] RODIONOVA T, KOMAROV V, VILLEVALD G, et al. Calorimetric and structural studies of tetrabutylammonium chloride ionic clathrate hydrates[J]. The journal of physical chemistry B, 2010, 114(36): 11838-11846. DOI: 10.1021/jp103939q.
[8] TRUEBA A T, RADOVIĆ I R, ZEVENBERGEN J F, et al. Kinetic measurements and in situ Raman spectroscopy study of the formation of TBAF semi-hydrates with hydrogen and carbon dioxide[J]. International journal of hydrogen energy, 2013, 38(18): 7326-7334. DOI:10.1016/ j.ijhydene.2013.03.154.
[9] MUROMACHI S, TAKEYA S, YAMAMOTO Y, et al. Characterization of tetra--butylphosphonium bromide semiclathrate hydrate by crystal structure analysis[J]. CrystEngComm, 2014, 16(10): 2056-2060. DOI: 10.1039/C3CE41942H.
[10] 史伶俐, 梁德青. 四丁基氯化铵半笼型水合物的相平衡模型[J]. 新能源进展, 2014, 2(3): 221-225. DOI: 10.3969/j.issn.2095-560X.2014.03.010.
[11] KHAN M S, LAL B, KEONG L K, et al. Experimental evaluation and thermodynamic modelling of AILs alkyl chain elongation on methane riched gas hydrate system[J].Fluid phase equilibria, 2018, 473: 300-309. DOI: 10.1016/ j.fluid.2018.07.003.
[12] KHAN M S, BAVOH C B, PARTOON B, et al. Thermodynamic effect of ammonium based ionic liquids on CO2hydrates phase boundary[J]. Journal of molecular liquids, 2017, 238: 533-539. DOI: 10.1016/j.molliq.2017.05.045.
[13] 刘芙蓉, 王胜杰, 张文玲, 等. 冰-水-气生成天然气水合物的实验研究[J]. 西安交通大学学报, 2000, 34(12): 66-69. DOI: 10.3321/j.issn:0253-987X.2000.12.017.
[14] 梁艳, 王树立, 孙誉珍, 等. 水合物法海水淡化脱盐效率研究[J]. 环境工程, 2015, 33(5): 10-13, 47. DOI: 10.13205/j.hjgc.201505003.
[15] ILANI-KASHKOULI P, MOHAMMADI A H, NAIDOO P, et al. Hydrate phase equilibria for CO2, CH4, or N2+ tetrabutylphosphonium bromide (TBPB) aqueous solution[J]. Fluid phase equilibria, 2016, 411: 88-92. DOI: 10.1016/j.fluid.2015.11.021.
[16] SUGINAKA T, SAKAMOTO H, IINO K, et al. Phase equilibrium for ionic semiclathrate hydrate formed with CO2, CH4, or N2plus tetrabutylphosphonium bromide[J]. Fluid phase equilibria, 2013, 344: 108-111. DOI: 10.1016/j.fluid.2013.01.018.
[17] SILVA L P S, DALMAZZONE D, STAMBOULI M, et al. Phase equilibria of semi-clathrate hydrates of tetra-n-butyl phosphonium bromide at atmospheric pressure and in presence of CH4and CO2+ CH4[J]. Fluid phase equilibria, 2016, 413: 28-35. DOI: 10.1016/j.fluid.2015.09.042.
[18] SHI L L, DING J X, LIANG D Q. Thermodynamic Properties of double semiclathrate hydrates formed with tetrabutylphosphonium chloride + CH4[J]. Journal of chemical & engineering data, 2017, 62(12): 4377-4382. DOI: 10.1021/acs.jced.7b00738.
[19] SILVA L P S, DALMAZZONE D, STAMBOULI M, et al. Phase behavior of simple tributylphosphine oxide (TBPO) and mixed gas (CO2, CH4and CO2+ CH4) + TBPO semiclathrate hydrates[J]. The journal of chemical thermodynamics, 2016, 102: 293-302. DOI: 10.1016/j.jct.2016.07.022.
[20] SUN Z G, LIU C G. Equilibrium conditions of methane in semiclathrate hydrates of tetra-n-butylammonium chloride[J]. Journal of chemical & engineering data, 2012, 57(3): 978-981. DOI: dx.doi.org/10.1021/je201264g.
[21] MAKINO T, YAMAMOTO T, NAGATA K, et al. Thermodynamic stabilities of tetra--butyl ammonium chloride + H2, N2, CH4, CO2, or C2H6semiclathrate hydrate systems[J]. Journal of chemical & engineering data, 2010, 55(2): 839-841. DOI:10.1021/je9004883.
[22] MOHAMMADI A H, ESLAMIMANESH A, BELANDRIA V, et al. Phase equilibria of semiclathrate hydrates of CO2, N2, CH4, or H2+ tetra--butylammonium bromide aqueous solution[J]. Journal of chemical & engineering data, 2011, 56(10): 3855-3865. DOI:10.1021/je2005159.
[23] LEE S, LEE Y, PARK S, et al. Thermodynamic and spectroscopic identification of guest gas enclathration in the double tetra--butylammonium fluoride semiclathrates[J].The journal of physical chemistry B, 2012, 116(30): 9075-9081. doi: 10.1021/jp302647c.
[24] ARJMANDI M, CHAPOY A, TOHIDI B. Equilibrium data of hydrogen, methane, nitrogen, carbon dioxide, and natural gas in semi-clathrate hydrates of tetrabutyl ammonium bromide[J]. Journal of chemical & engineering data, 2007, 52(6): 2153-2158. DOI:10.1021/je700144p.
[25] MOHAMMADI A H, RICHON D. Phase equilibria of semi-clathrate hydrates of tetra--butylammonium bromide + hydrogen sulfide and tetra--butylammonium bromide + methane[J]. Journal of chemical & engineering data, 2010, 55(2): 982-984. DOI:10.1021/je9004257.
[26] SANGWAI J S, OELLRICH L. Phase equilibrium of semiclathrate hydrates of methane in aqueous solutions of tetra-n-butyl ammonium bromide (TBAB) and TBAB–NaCl[J]. Fluid phase equilibria, 2014, 367: 95-102. DOI: 10.1016/J.FLUID.2014.01.036.
[27] SU Y, BERNARDI S, SEARLES D J, et al. Effect of carbon chain length of organic salts on the thermodynamic stability of methane hydrate[J]. Journal of chemical & engineering data, 2016, 61(5): 1952-1960. DOI: 10.1021/acs.jced.6b00185.
[28] GUPTA P, NAIR V C, SANGWAI J S. Phase equilibrium of methane hydrate in the presence of aqueous solutions of quaternary ammonium Salts[J]. Journal of chemical & engineering data, 2018, 63(7): 2410-2419. DOI: 10.1021/acs.jced.7b00976.
[29] MOHAMMADI A, MANTEGHIAN M, MOHAMMADI A H. Phase equilibria of semiclathrate hydrates for methane+tetra n-butylammonium chloride (TBAC), carbon dioxide+TBAC, and nitrogen+TBAC aqueous solution systems[J]. Fluid phase equilibria, 2014, 381: 102-107. DOI: 10.1016/j.fluid.2014.08.012.
[30] MOHAMMADI A, MANTEGHIAN M, MOHAMMADI A H. Dissociation data of semiclathrate hydrates for the systems of tetra--butylammonium fluoride (TBAF) + methane + water, TBAF + carbon dioxide + water, and TBAF + nitrogen + water[J]. Journal of chemical & engineering data, 2013, 58(12): 3545-3550. DOI: 10.1021/je4008519.
[31] ILANI-KASHKOULI P, MOHAMMADI A H, NAIDOO P, et al. Thermodynamic stability conditions for semi-clathrate hydrates of CO2, CH4, or N2with tetrabutyl ammonium nitrate (TBANO3) aqueous solution[J]. The journal of chemical thermodynamics, 2016, 96: 52-56. DOI: 10.1016/j.jct.2015.11.030.
[32] DU J W, LIANG D Q, LI D L, et al. Phase equilibrium conditions of tetrabutyl ammonium nitrate + CO2, N2, or CH4semiclathrate hydrate systems[J]. Industrial & engineering chemistry research, 2011, 50(20): 11720-11723. DOI: 10.1021/ie200380j.
[33] SU Y, SEARLES D J, WANG L G. Semiclathrate hydrates of methane + tetraalkylammonium hydroxides[J].Fuel, 2017, 203: 618-626. DOI: 10.1016/j.fuel.2017.05.005.
[34] SHI L L, LIANG D Q. Phase equilibria of double semiclathrate hydrates formed with tetraamylammonium bromide plus CH4, CO2, or N2[J]. Journal of chemical & engineering data, 2015, 60(9): 2749-2755. DOI: 10.1021/acs.jced.5b00516.
[35] SHI L L, LIANG D Q. Phase equilibrium conditions for the double semiclathrate hydrate formed with tetraamylammonium chloride plus CH4, CO2, or N2[J]. Journal of chemical & engineering data, 2014, 59(11): 3705-3709. DOI: 10.1021/je500587m.
[36] DU J W, WANG L G. Equilibrium conditions for semiclathrate hydrates formed with CO2, N2, or CH4in the presence of tri--butylphosphine oxide[J]. Industrial & engineering chemistry research, 2014, 53(3): 1234-1241. DOI: 10.1021/ie403130h.
[37] CHA J H, KIM E S, LEE K S, et al. Phase equilibria and dissociation enthalpies of tri--butylphosphine oxide semiclathrate hydrates incorporated with CH4, CO2, and H2[J]. Journal of chemical & engineering data, 2013, 58(12): 3494-3498. DOI: 10.1021/je400773k.
[38] KIM S, KIM KS, SEO Y. CH4enclathration in tetra-iso-amyl ammonium bromide (TiAAB) semiclathrate and its significance for natural gas storage[J]. Chemical engineering journal, 2017, 330: 1160-1165. DOI: 10.1016/j.cej.2017.08.054.
[39] HUGHES T J, MARSH K N. Methane semi-clathrate hydrate phase equilibria with tetraisopentylammonium fluoride[J]. Journal of chemical & engineering data, 2011, 56(12): 4597-4603. DOI: dx.doi.org/10.1021/je200538d.
[40] ADISASMITO S, FRANK III R J, SLOAN E D JR. Hydrates of carbon dioxide and methane mixtures[J]. Journal of chemical & engineering data, 1991, 36(1): 68-71. DOI:10.1021/je00001a020.
[41] KOBORI T, MUROMACHI S, YAMASAKI T, et al. Phase behavior and structural characterization of ionic clathrate hydrate formed with tetra--butylphosphonium hydroxide: discovery of primitive crystal structure[J]. Crystal growth & design, 2015, 15(8): 3862-3867. DOI:10.1021/acs.cgd.5b00484.
[42] 孙玉景, 周立发, 李越. CO2海洋封存的发展现状[J]. 地质科技情报, 2018, 37(4): 212-218. DOI: 10.19509/j.cnki.dzkq.2018.0428.
[43] 轩小波, 刘妮, 刘道平. 二氧化碳水合物浆在空调蓄冷技术中的研究进展[J]. 制冷技术, 2010, 30(2): 44-47, 51.
[44] ZHOU X B, LONG Z, HE Y, et al. Phase equilibria and the crystallographic properties of TBAB–CO2semiclathrate hydrates[J]. Journal of chemical & engineering data, 2018, 63(5): 1249-1255. DOI:10.1021/acs.jced.7b00884.
[45] YE N, ZHANG P. Equilibrium data and morphology of tetra--butyl ammonium bromide semiclathrate hydrate with carbon dioxide[J]. Journal of chemical & engineering data, 2012, 57(5): 1557-1562. doi: 10.1021/je3001443.
[46] YE N, ZHANG P. Phase equilibrium and morphology characteristics of hydrates formed by tetra--butyl ammonium chloride and tetra--butyl phosphonium chloride with and without CO2[J]. Fluid phase equilibria, 2014, 361: 208-214. DOI: 10.1016/j.fluid.2013.10.055.
[47] ILANI-KASHKOULI P, HASHEMI H, BASDEO A, et al. Hydrate dissociation data for the systems (CO2/CH4/Ar) + water with (TBAF/TBAA/TBPB/TBANO3and cyclopentane)[J]. Journal of chemical & engineering data, 2019, 64(6): 2542-2549. DOI:10.1021/acs.jced. 8b01195.
[48] SHI L L, LIANG D Q, WU N Y. Phase equilibrium data of the double tetrabutylammonium chloride plus carbon dioxide or nitrogen semiclathrate hydrate[J]. Journal of chemical & engineering data, 2014, 59(7): 2320-2323. DOI: 10.1021/JE500445W.
[49] BABU P, PARICAUD P, LINGA P. Experimental measurements and modeling of the dissociation conditions of semiclathrate hydrates of tetrabutyl ammonium nitrate and carbon dioxide[J]. Fluid phase equilibria, 2016, 413: 80-85. DOI: 10.1016/j.fluid.2015.08.034.
[50] SHI L L, LIANG D Q, LI D L. Phase Equilibrium data of tetrabutylphosphonium bromide plus carbon dioxide or nitrogen semiclathrate hydrates[J]. Journal of chemical & engineering data, 2013, 58(7): 2125-2130. DOI: 10.1021/je400452f.
[51] ZHANG P, YE N, ZHU H, et al. Hydrate equilibrium conditions of tetra--butylphosphonium bromide + carbon dioxide and the crystal morphologies[J]. Journal of chemical & engineering data, 2013, 58(6): 1781-1786. doi: 10.1021/je400179t.
[52] KIM S, KO G, KIM KS, et al. Phase equilibria of tetra-iso-amyl ammonium bromide (TiAAB) semiclathrates with CO2, N2, or CO2+ N2[J]. The journal of chemical thermodynamics, 2020, 142: 106024. DOI: 10.1016/j.jct.2019.106024.
[53] MAJUMDAR A, MAINI B, BISHNOI P R, et al. Three-phase equilibrium conditions of TiAAB semiclathrates formed from N2, CO2, and their mixtures[J]. Journal of chemical & engineering data, 2012, 57(8): 2322-2327. DOI: 10.1021/je300449p.
[54] 孟庆国, 刘昌岭, 业渝光, 等. 氮气水合物储氢的激光拉曼光谱研究[J]. 光谱学与光谱分析, 2012, 32(8): 2139-2142. DOI: 10.3964/j.issn.1000-0593(2012)08-2139-04.
[55] 孙志高, 焦丽君, 王功亮, 等. 氮气及氮气+二氧化碳在四丁基溴化铵水溶液中水合物相平衡研究[J]. 科学技术与工程, 2014, 14(17): 125-128. DOI:10.3969/j. issn.1671-1815.2014.17.024.
[56] 李璐伶, 樊栓狮, 陈秋雄, 等. 储氢技术研究现状及展望[J]. 储能科学与技术, 2018, 7(4): 586-594. DOI: 10.12028/j.issn.2095-4239.2018.0062.
[57] LEE S, LEE Y, PARK S, et al. Phase equilibria of semiclathrate hydrate for nitrogen in the presence of tetra--butylammonium bromide and fluoride[J]. Journal of chemical & engineering data, 2010, 55(12): 5883-5886. DOI: 10.1021/je100886b.
[58] DESCHAMPS J, DALMAZZONE D. Hydrogen storage in semiclathrate hydrates of tetrabutyl ammonium chloride and tetrabutyl phosphonium bromide[J]. Journal of chemical & engineering data, 2010, 55(9): 3395-3399. DOI: 10.1021/je100146b.
[59] SAKAMOTO J, HASHIMOTO S, TSUDA T, et al. Thermodynamic and Raman spectroscopic studies on hydrogen+tetra--butyl ammonium fluoride semi-clathrate hydrates[J]. Chemical engineering science, 2008, 63(24): 5789-5794. DOI: 10.1016/j.ces.2008.08.026.
[60] KARIMI A A, DOLOTKO O, DALMAZZONE D. Hydrate phase equilibria data and hydrogen storage capacity measurement of the system H2+tetrabutylammonium hydroxide+H2O[J]. Fluid phase equilibria, 2014, 361: 175-180. DOI: 10.1016/j.fluid.2013.10.043.
[61] FUJISAWA Y, TSUDA T, HASHIMOTO S, et al. Thermodynamic stability of hydrogen+tetra--butyl phosphonium bromide mixed semi-clathrate hydrate[J]. Chemical engineering science, 2012, 68(1): 660-662. DOI: 10.1016/j.ces.2011.09.045.
[62] GARCIA M, CLARKE M A. Equilibrium conditions for TBAB and TBAC semiclathrates of xenon and argon[J]. Journal of chemical & engineering data, 2014, 59(11): 3785-3790. DOI:10.1021/je5006642.
[63] BABAEE S, HASHEMI H, MOHAMMADI A H, et al. Experimental measurements and thermodynamic modelling of hydrate phase equilibrium conditions for CF4+TBAB aqueous solutions[J]. Chemical engineering communications, 2020, 207(2): 185-193. DOI: 10.1080/00986445.2019.1575823.
[64] 吴海浩, 杨璐, 吕晓方, 等. 天然气水合物生成速率实验研究[J]. 实验技术与管理, 2014, 31(1): 36-40. DOI:10.16791/j.cnki.sjg.2014.01.012.
[65] QASIM A, KHAN M S, LAL B, et al. Quaternary ammonium salts as thermodynamic hydrate inhibitors in the presence and absence of monoethylene glycol for methane hydrates[J]. Fuel, 2020, 259: 116219. DOI: 10.1016/j.fuel.2019.116219.
[66] TARIQ M, CONNOR E, THOMPSON J, et al. Doubly dual nature of ammonium-based ionic liquids for methane hydrates probed by rocking-rig assembly[J]. RSC advances, 2016, 6(28): 23827-23836. DOI: 10.1039/C6RA00170J.
[67] QASIM A, KHAN M S, LAL B, et al. Phase equilibrium measurement and modeling approach to quaternary ammonium salts with and without monoethylene glycol for carbon dioxide hydrates[J]. Journal of molecular liquids, 2019, 282: 106-114. DOI: 10.1016/j.molliq.2019.02.115.
[68] KHAN M S, LAL B, KEONG L K, et al. Tetramethyl ammonium chloride as dual functional inhibitor for methane and carbon dioxide hydrates[J]. Fuel, 2019, 236: 251-263. DOI: 10.1016/j.fuel.2018.09.001.
[69] KHAN M S, PARTOON B, BAVOH C B, et al. Influence of tetramethylammonium hydroxide on methane and carbondioxide gas hydrate phase equilibrium conditions[J]. Fluid phase equilibria, 2017, 440: 1-8. DOI: 10.1016/j.fluid.2017.02.011.
[70] KHAN M S, LAL B, PARTOON B, et al. Experimental evaluation of a novel thermodynamic inhibitor for CH4and CO2hydrates[J]. Procedia engineering, 2016, 148: 932-940. DOI: 10.1016/j.proeng.2016.06.433.
[71] KESHAVARZ L, JAVANMARDI J, ESLAMIMANESH A, et al. Experimental measurement and thermodynamic modeling of methane hydrate dissociation conditions in the presence of aqueous solution of ionic liquid[J]. Fluid phase equilibria, 2013, 354: 312-318. DOI: 10.1016/j.fluid.2013.05.007.
[72] LIN W, DALMAZZONE D, FÜRST W, et al. Thermodynamic properties of semiclathrate hydrates formedfrom the TBAB+TBPB+water and CO2+TBAB+TBPB+water systems[J]. Fluid phase equilibria, 2014, 372: 63-68. DOI: 10.1016/j.fluid.2014.03.026.
[73] HASSAN H, PAHLAVANZADEH H. Thermodynamic modeling and experimental measurement of semi-clathrate hydrate phase equilibria for CH4in the presence of cyclohexane (CH) and tetra-n-butyl ammonium bromide (TBAB) mixture[J]. Journal of natural gas science and engineering, 2020, 75: 103128. DOI: 10.1016/j.jngse.2019.103128.
[74] WU W Z, GUAN J A, SHEN X D, et al. Phase equilibrium data of methane hydrate in the aqueous solutions of additive mixtures (THF + TBAC)[J]. Journal of chemical & engineering data, 2016, 61(10): 3498-3503. DOI: 10.1021/acs.jced.6b00405.
[75] YANG M J, JING W, WANG P F, et al. Effects of an additive mixture (THF + TBAB) on CO2hydrate phase equilibrium[J]. Fluid phase equilibria, 2015, 401: 27-33. DOI: 10.1016/j.fluid.2015.05.007.
[76] 盛淑美, 章冶, 李栋梁, 等. 多壁碳纳米管对CH4-CO2-TBAB水合物的促进作用[J]. 天然气化工-C1化学与化工, 2019, 44(1): 51-56.
[77] LI D L, SHENG S M, ZHANG Y, et al. Effects of multiwalled carbon nanotubes on CH4hydrate in the presence of tetra--butyl ammonium bromide[J]. RSC advances, 2018, 8(18): 10089-10096. DOI: 10.1039/C8RA01124A.
[78] ZHOU S D, JIANG K, ZHAO Y L, et al. Experimental investigation of CO2hydrate formation in the water containing graphite nanoparticles and tetra--butyl ammonium bromide[J]. Journal of chemical & engineering data, 2018, 63(2): 389-394. DOI: 10.1021/acs.jced.7b00785.
Progress of Quaternary Salts on Phase Equilibrium of Gas Hydrate
DUAN Han-kun1,2, XIE Ying-ming1,2, XIE Mei-ping1,2
(1. School of Energy and Power Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. Shanghai Key Laboratory of Multiphase Flow and Heat Transfer in Power Engineering, Shanghai 200093, China)
Quaternary salt was an efficient additive for hydrate formation, which usually achieves the effect of improving hydrate phase equilibrium conditions by filling the hydrate cage. The effect of quaternary salt on phase equilibrium conditions of gas hydrates such as CH4and CO2was mainly relate to the concentration of quaternary salt. In terms of methane hydrate, TiPeAF and TiAAB had significant effects on phase equilibrium under the same phase equilibrium pressure: the phase equilibrium temperature of the system with TiPeAF (0.315%) and TiAAB (0.438%) was 20 K and 22 K higher than pure water system respectively. TBANO3, TAAB and TAAC had little effect on phase equilibrium: the phase equilibrium temperature was 10 K lower than that of the system with TBAB and TBAC. For CO2hydrate, the phase equilibrium temperature of TiAAB system was 29 K higher than pure water system, and that of TBAF system was 26 K higher than that of pure water system. In addition, the combination of quaternary salt and other additives had a better improvement effect on the phase equilibrium conditions of hydrate: the phase equilibrium temperature of hydrate in the combination system of TBAB (0.05%) and NaCl (0.03%) was 10 K higher compared with the system which adding TBAB only.
quaternary salts; gas; hydrate; phase equilibrium; microstructure
2095-560X(2022)01-0059-10
TK02;O621.2
A
10.3969/j.issn.2095-560X.2022.01.009
2021-08-30
2021-11-01
国家自然科学基金项目(50806050)
谢应明,E-mail:xymbox@163.com
段汉坤(1997-),男,硕士研究生,主要从事新型制冷空调技术和气体水合物应用及仿真技术研究。
谢应明(1976-),男,博士,副教授,主要从事气体水合物应用技术和新型制冷空调技术研究。
