胡杨PeNAC121基因启动子的分离鉴定和胁迫应答模式分析
2022-03-02李天静李鑫窈杨丰铭姚银安高永峰
谢 望 李天静 李鑫窈 杨丰铭 姚银安 高永峰
(西南科技大学生命科学与工程学院,绵阳 621010)
植物生长发育过程中,由于外界气候环境条件的变化,导致植物经常遭遇干旱、高盐、低温以及病虫害等各种非生物和生物胁迫的影响,这些胁迫不仅会对植物细胞造成损害,还会抑制植物的生长,降低作物的产量和品质。为此,植物也进化出了相应的应对策略,其中通过转录因子(Transcription Factor,TF)对外界环境胁迫信号做出响应并与相关启动子中的相关顺式作用元件相结合来调节(激活或抑制)下游逆境基因的表达,已成为植物应对或抵御外界逆境胁迫的一种重要调控方式。
植物中存在大量的与非生物胁迫应答相关的转录因子,其中的NAC 家族是植物中最大的转录因子家族之一,其主要行使转录激活的功能。近年来,以NAC 转录因子在植物逆境抗性中的功能研究的最为深入和广泛。研究表明,多种植物中的NAC 转录因子成员都参与调控了植物对干旱、高盐、高温、低温以及涝渍等非生物胁迫的应答,如 拟 南 芥()中 的RD26/ANANC072、ANANC096,水稻()中的SNAC1、ONAC022、OSNAC5 和OSNAC6,玉米()的ZmSNAC1、小麦()中 的TaNAC2 和TaNAC29,黄 花 棘 豆()的OoNAC72和 鹰 嘴 豆()的CarNAC4等均涉及到对干旱和高盐胁迫的响应和抗性。此外,NAC 转录因子在低温胁迫中也具有重要的作用,如辣椒()的CaNAC064、小麦的TaNAC67、水稻中的ONAC095 和苹果()的Md‐NAC029 均在低温响应和植物的耐寒性中发挥着重要的生物学功能。杨树()中的NAC转录因子家族有163个成员,但目前对其功能的研究还主要集中在次生细胞壁的发育和木材的形成的调控过程中,如PNAC070/PtWND5、PNAC086/PtWND1、 PNAC008/PtWND3A、 PNAC009/Pt‐WND4B、PNAC071/PtWND1B、PNAC085/PtWND2B等,而对其参与树木逆境胁迫应答和响应机制的研究较少。胡杨()是杨柳科()杨属()中最古老和原始的木本植物,其具有抗旱、耐盐碱、抗寒、生物量大且抗逆性强的众多特性,是植物抗胁迫相关基因挖掘的重要种质资源库。目前胡杨基因组测序结果的公布为胡杨中关键抗逆基因和逆境响应启动子元件的挖掘和筛选提供了便利。因此,本研究从胡杨叶片中克隆基因的启动子序列,分析该序列中存在的相关顺式作用元件,并使用该启动子驱动报告基因在野生型毛白杨()中表达,之后对获得的转基因植株采用不同胁迫处理(干旱、盐、低温和ABA)后进行GUS染色和酶活定量分析。胡杨NAC家族转录因子成员逆境胁迫响应和调控机制的研究,将为今后阐明胡杨抗旱耐盐的分子调控机制提供理论参考。
1 材料与方法
1.1 材料
实验材料胡杨是2016 年从新疆林场购进,西南科技大学东九6 楼水培室培养,生长状态良好。遗传转化所使用的植物材料-三倍体毛白杨由西南大学树木生物学课题组罗克明教授提供。基因克隆所需菌种、载体均由西南科技大学国际树木生物学实验室制作保存。
1.2 方法
1.2.1 胡杨基因启动子的克隆和序列分析
用胡杨基因核苷酸序列(XM_011045326.1)在NCBI 网站(https://www.ncbi.nlm.nih.gov/)找到该基因的上游启动子序列,设计用于启动子克隆的两对上下游引物(见表1),以3 年生胡杨的叶片DNA 为模板,进行PCR 扩增。将PCR产物经电泳检测,回收目的片段,连接克隆载体pEASY-T1,转化大肠杆菌,挑选正确的单克隆扩大培养后送擎科生物公司测序。
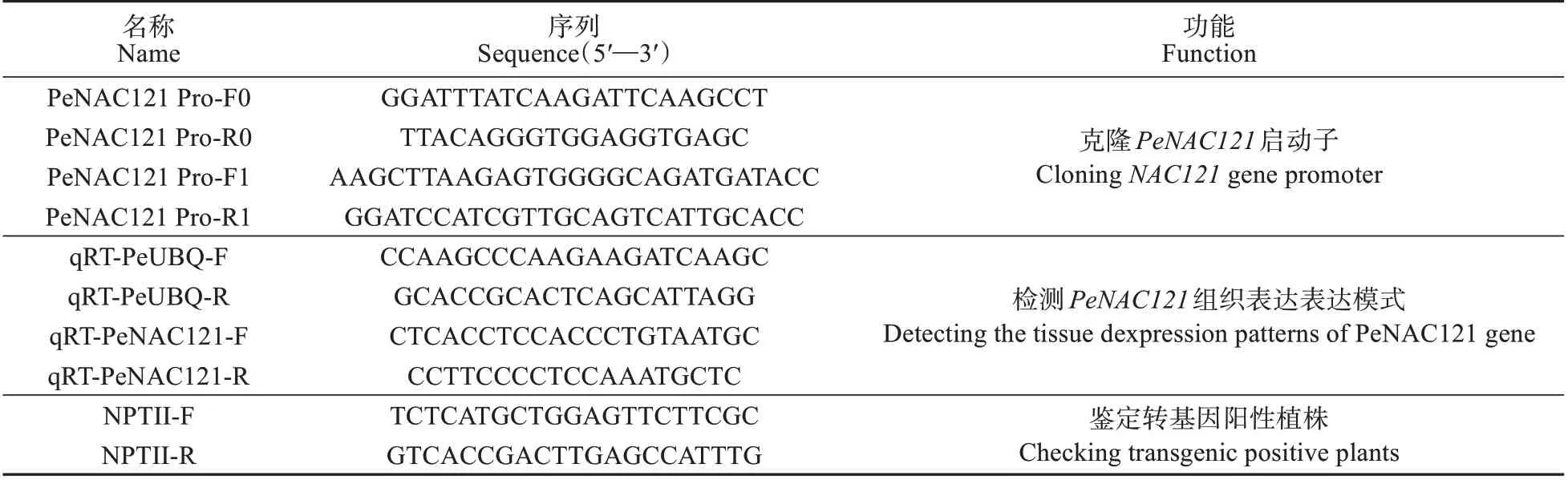
表1 实验中使用的引物Table 1 Primers used in this study
使用在线分析软件PlantCARE(http://bioin‐formatics.psb.ugent.be/webtools/plantcare/html/)对胡杨基因的启动子序列进行相关的顺式作用元件分析。
1.2.2 胡杨基因的组织表达模式分析
提取1 年生野生型胡杨不同组织(根、茎、叶)的总RNA,经反转录获得cDNA,再以cDNA 作为模板,以胡杨(Ubiquitin,XM_011004860.1)作为内参基因,以qRT-PeNAC121-F/R 作为目的基因特异性引物(见表1)进行实时荧光定量PCR(qRTPCR)检测。反应条件按照TransGen 公司的Trans‐Star Green qPCR SuperMix UDG 的说明书执行。每个样品取3个生物学重复,相对表达量采用2法进行计算方法。
1.2.3 毛白杨启动子植物表达载体的构建
将重组质粒pEASY-T1+PeNAC121和pBI121分别用HⅠ和dⅢ(Thermo 公司)进行双酶切,构建获得重组植物表达载体pBI121+PeNAC121::GUS,并转化农杆菌EHA105细胞。
1.2.4 毛白杨的遗传转化和再生植株的阳性鉴定
主要分为4 个过程,包括侵染、共培养、分化、生根。
(1)侵染:将1.2.3中的农杆菌悬液加入配置好的侵染液(加入1 mL 10 g·LAS 乙酰丁香酮的1/2 WPM 液体培养基)中混匀。然后,取野生型毛白杨无菌苗叶片切成0.2 cm的小方块后,置入侵染液中浸泡10 min,在此期间,使用尖头镊子在叶片上扎上小孔,以增加受伤面积。(2)共培养:侵染结束后,将已吸干侵染液的叶片均匀放置于共培养培养基上,在24 ℃的黑暗条件下培养至叶片发生轻微卷曲(大概2~3 d)后转移至分化培养基上。(3)分化培养:分化培养保持正常的光照条件,温度26/22 ℃(白天/16 h、黑夜/8 h)进行,每周更换一次培养基。当分化平板上的叶片分化出愈伤组织且长有小芽时,说明分化状态较好。(4)生根培养:待愈伤组织上长出3 cm 左右的小芽时,切下小芽置于生根培养基中进行培养。待苗长至6 cm高左右时取叶片,提DNA进行阳性鉴定。
共培养培养基:WPM(木本植物培养基,Phyto‐Tech 公司,货号HHA0449113A)+1 mg·LNAA(萘乙酸,BBI 公司,货号A600729-0100)+2 mg·LZT(反玉米素,BBI 公司,货号A600748-0100);诱导培养基:WPM+25 mg·LKana(硫酸卡那霉素,BBI 公司,货号A506636-0100)+200 mg·LTMT(特美汀,Solarbio 公司,货号401D0320);分化培养基:WPM+2 mg·LZT+25 mg·LKana+200 mg·LTMT;生根培养基:WPM+1 mg·LIAA(3-吲哚乙酸,BBI 公司,货号A600723-0025)+25 mg·LKana+200 mg·LTMT;以上各培养基的pH均为5.8~6.0。
转基因毛白杨的阳性鉴定用CTAB方法提取再生植株叶片基因组DNA 并以此为模板,用NPTII-F/R 引物(见表1)进行PCR 扩增,扩增产物进行电泳检测。
1.2.5 转基因植株的胁迫处理
将生长45 d 的野生型幼苗和转基因毛白杨幼苗从生根的固体培养基中取出,然后将它们分别置入含有200 mmol·LNaCl、300 mmol·L甘露醇、0.1 mmol·LABA(先进行叶面喷施,再将根置于液体中)的WPM 液体培养基中(不加任何激素和琼脂),并以在正常WPM 液体培养基中处理的野生型和转基因毛白杨幼苗作为对照;4 ℃低温处理在相同光照条件下的人工培养箱进行,培养方式同上,并使用正常WPM 液体培养基。将上述处理组的幼苗在相同的光照条件下处理24 h后,分别进行GUS 染色和酶活测定实验。本实验设有2 个生物学重复,每个重复包含6 个个体(其中3 株做GUS染色实验,另3株做GUS酶活测定)。
1.2.6 GUS组织化学染色和酶活的定量分析
参照高永峰等的实验方法进行转基因毛白杨幼苗的GUS 染色和酶活性的定量分析,该实验中使用酶标仪SpectraMax iD3(MOLECULAR DE‐VICES公司)测其样品产生的荧光。
2 结果与分析
2.1 胡杨PeNAC121 基因启动子克隆与序列分析
以胡杨叶片的基因组DNA 为模板,分别以PeNAC121Pro-F0/R0 和PeNAC121Pro-F1/R1 作 引物进行巢式PCR 的二轮扩增,第二轮扩增产物经凝胶电泳后发现在1 500~3 000 bp 区域中间出现一条单一的目的条带(见图1),回收其目的条带并连接pEASY-T1载体后转化大肠杆菌,挑单菌落经PCR 阳性克隆鉴定后测序。测序结果表明,克隆的基因启动子的片段大小为1 997 bp(见图2),使用PlantCARE 对基因启动子中存在的顺式作用元件进行预测后发现该启动子除含有12 个光响应元件以外,还包含很多与非生物胁迫相关的元件,包括1 个低温响应元件LTR、1 个参与干旱诱导的MYB 结合位点MBS、2个防卫和胁迫响应元件TC-rich repeats、2 个抗氧化反应元件ARE、2 个创伤响应元件WUN-motif 和3 个植物激素相关响应元件(包括2 个脱落酸和1个赤霉素响应元件)(见图2 和表2)。基于上述结果,推测胡杨基因启动子可能会对干旱、低温、创伤等非生物胁迫以及ABA 和GA 等植物激素处理产生应答。
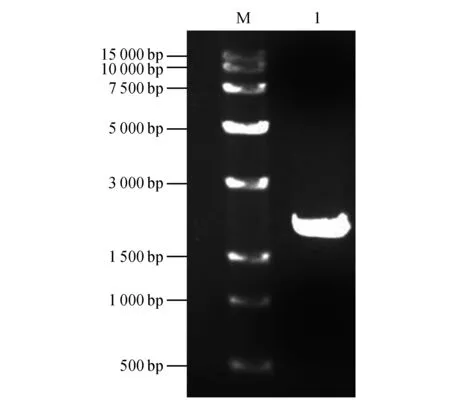
图1 胡杨PeNAC121基因启动子的PCR扩增产物电泳图M.DL15000;1.目的片段Fig.1 PCR amplified product of PeNAC121 gene promoter from P.euphraticaM.DL15000;1.PCR product of target fragment

图2 胡杨PeNAC121启动子的DNA序列下划线表示不同顺式作用元件的DNA核心序列Fig.2 DNA Sequences of PeNAC121 gene promoter from P.euphraticaThe underlined DNA sequences in the figure indicate DNA core sequences of different Cis-acting elements
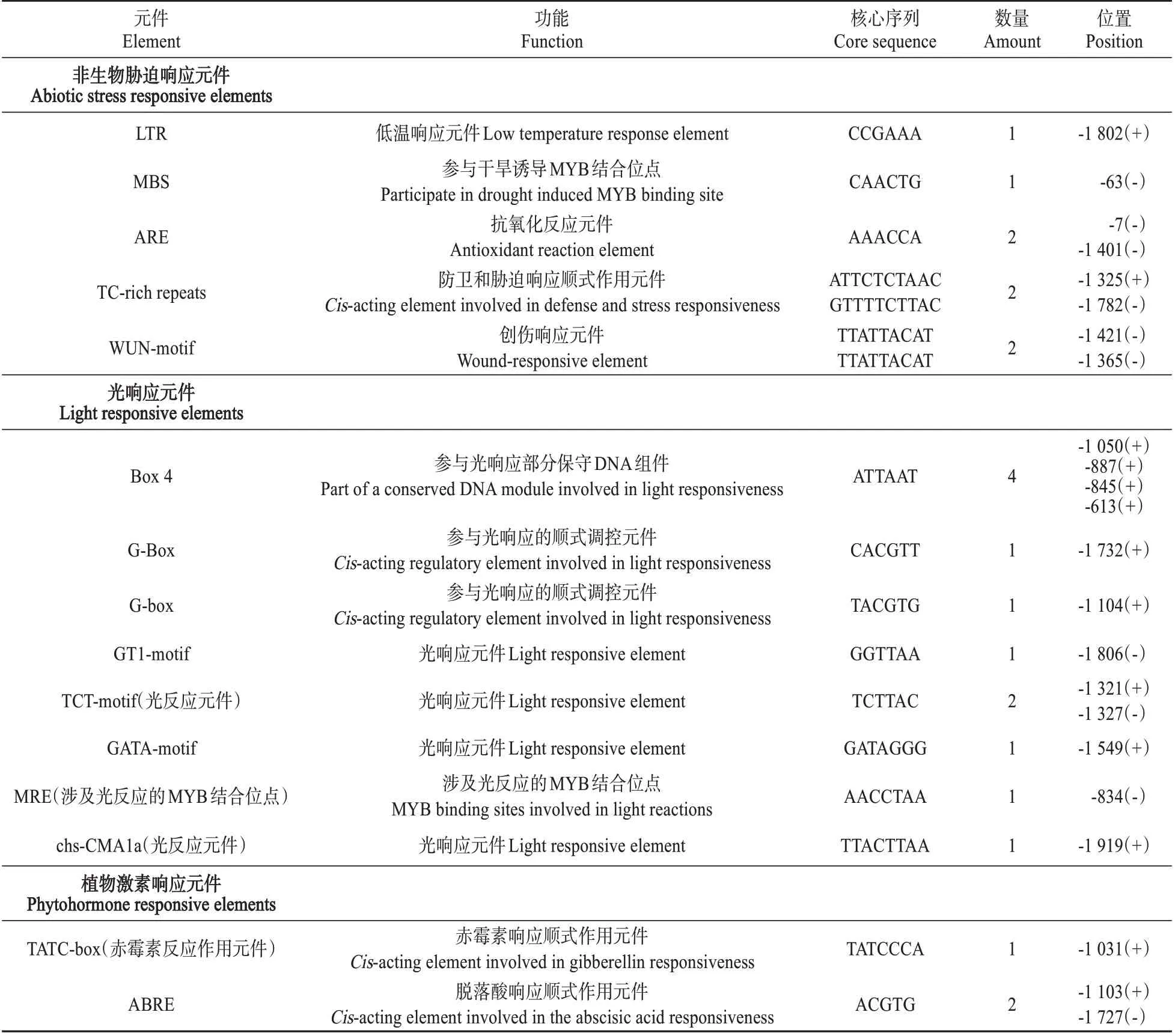
表2 胡杨PeNAC121基因启动子中的顺式作用元件Table 2 The Cis-acting elements in the isolated PeNAC121 promoter region
2.2 胡杨PeNAC121基因组织表达模式分析
利用qRT-PCR 技术检测基因在野生型胡杨不同组织中的表达模式,结果如下图所示(见图3):基因在胡杨的各个组织中均有不同程度的表达,但在茎中的表达量最高,分别是根的8.2 倍和叶片的5 倍左右,表明胡杨基因的表达不具有组织特异性。

图3 胡杨PeNAC121基因在不同组织中的表达模式Fig.3 Expression patterns of PeNAC121 gene in different tissues of P.euphratica
2.3 胡杨PeNAC121 基因启动子植物表达载体的构建与毛白杨的遗传转化
为了更深入地分析胡杨基因启动子的功能,利用基因的启动子序列去替换植物表达载体pBI121 上的CaMV35S 启动子,并形成重组载体pBI121+PeNAC121::GUS(见图4)。随后,对构建好的重组载体进行双酶切验证。酶切结果显示:酶切下来的条带与目的条带大小相符(见图5),且再次测序的结果也与前面测序的结果一致,证明重组载体构建成功。

图4 重组载体基因表达盒示意图Nos P.Nos启动子;NPTⅡ.新霉素磷酸转移酶Ⅱ;Nos T.Nos终止子Fig.4 Schematic diagram of recombination vectorNos P.The promoter of Nos gene;NPTⅡ.Neomycin phosphotransfer‐ase Ⅱ;Nos T.The terminator of Nos gene

图5 重组质粒的双酶切鉴定M.DL15000;1.重组质粒pBI121+PeNAC121Pro::GUS;2.pBI121+PeNAC121Pro::GUS质粒双酶切产物Fig.5 Double digestion of recombinant plasmidM.DL15000;1.Recombinant plasmid pBI121+PeNAC121Pro::GUS;2.The fragments of pBI121+PeNAC121Pro::GUS recombinant plasmid by restriction enzyme digested
之后,使用含有pBI121+PeNAC121::GUS的农杆菌侵染野生型毛白杨叶片,并通过组织培养(参考1.2.4)获得转基因毛白杨再生植株,本研究共获得9 株再生植株。再生植株的转基因阳性鉴定结果显示(见图6),除7 号再生植株外,其余的植株(8 株)均扩增出条带,且条带大小与正对照(pBI121+PeNAC121::GUS 重组质粒)相同,且负对照(野生型毛白杨)没有条带,证明该实验的转化阳性率为89%。
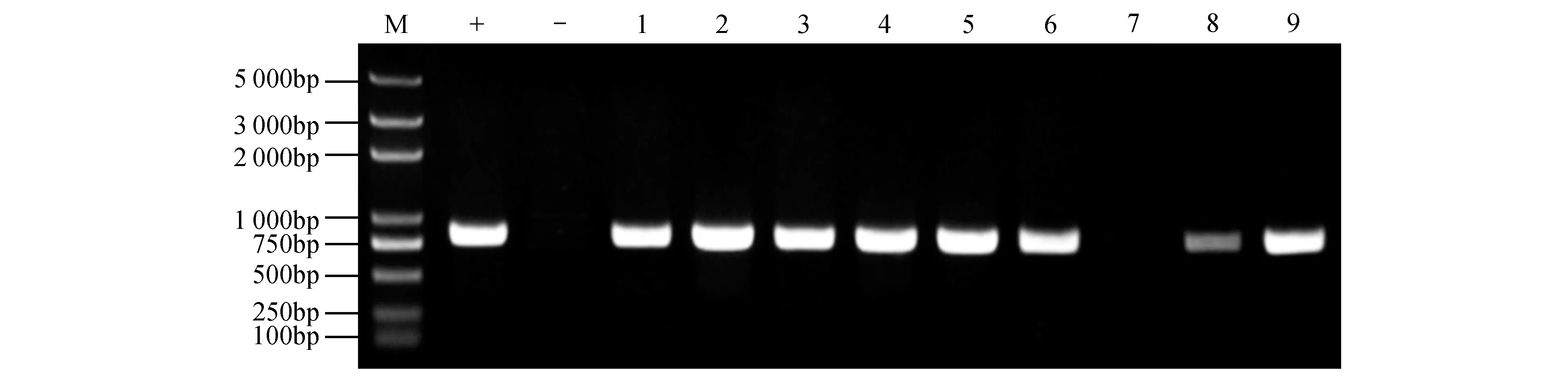
图6 转基因植株NPTII基因的PCR检测M.Trans2k Plus;+.重组质粒pBI121+PeNAC121Pro::GUS;-.野生型植株;1~9.转基因植株Fig.6 PCR analysis for NPT II gene in transgenic plantsM.Trans2k Plus;+.Recombinant plasmid pBI121+PeNAC121Pro::GUS;-.Wild type;1-9.Transgenic plants
2.4 胡杨PeNAC121基因启动子的活性分析
取45 d大的转基因毛白杨进行GUS 组织化学染色。染色结果表明(见图7B):所有组织中均能观察到不同深浅的蓝色,且在茎中的蓝色最深,根中次之,叶片最浅,表明基因启动子无明显组织特异性,属于组成型启动子,该结果与2.2中的基因的组织表达模式结果一致。
2.5 不同胁迫处理对PeNAC121 基因启动子的活性影响
为进一步阐明基因启动子对不同胁迫处理的应答模式,分别利用盐、干旱、低温和ABA 对转基因植株处理后进行GUS组织化学染色和GUS 酶活定量检测。结果显示:非转基因对照组幼苗中的各个组织中均没有蓝色(见图7A),而在转基因对照组幼苗的根和茎中均观察到蓝色、在叶片的叶脉处观察到较浅的蓝色(见图7B),而经200 mmol·LNaCl 和300 mmol·L甘露醇处理后,转基因幼苗的根和叶均呈现出深蓝色(见图7:C~D),其GUS 酶的活性分别是转基因对照组(0.61)的4.91 和4.96 倍(见图8)。同时,经0.1 mmol·LABA 和4 ℃低温处理的幼苗其根、茎和叶片也呈现出较深的蓝色(图7:E~F),其GUS 酶的活性分别是对照组的2.70 和2.28 倍(见图8)。上述结果表明胡杨启动子能够受到干旱、盐、低温及ABA 胁迫的诱导,是一个能够响应多种胁迫的诱导型启动子。

图7 不同胁迫条件下转基因毛白杨幼苗的GUS组织化学染色A.非转基因对照;B.对照;C.200 mmol·L-1 NaCl处理;D.300 mmol·L-1甘露醇处理;E.4℃低温处理;F.0.1 mmol·L-1 ABA处理Fig.7 GUS histochemical staining of transgenic poplar seedlings under different stress conditionsA.NT-Control;B.Control;C.200 mmol·L-1 NaCl treatment;D.300 mmol·L-1 mannitol treatment;E.4℃cold stress treatment;F.0.1mmol·L·L-1 ABA treatment
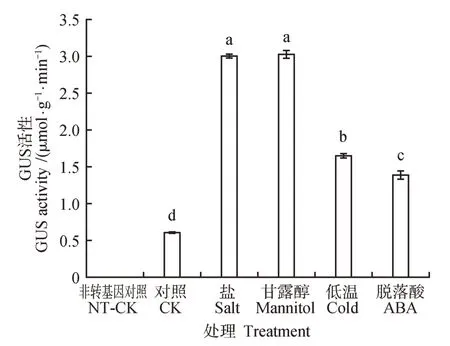
图8 不同胁迫条件下转基因毛白杨幼苗的GUS定量分析不同小写字母表示不同处理间的差异显著(P<0.05,LSD检验)Fig.8 Quantification of GUS activity in transgenic poplar seedlings under different stressesDifferent letters represent significant differences among different treat‐men(tP<0.05,LSD test)
3 讨论
启动子是基因的重要组成部分,其序列中存在的顺式作用元件通过与相应的反式作用因子结合最终决定了基因的时空表达模式。许多转录因子基因的启动子中都含有多种与逆境和激素相关的顺式作用元件,如WRKY、MYB 和NAC 基因等。因此在转录因子的研究中,挖掘启动子中的关键顺式作用元件对于更透彻的研究基因的响应模式和调控功能具有重要意义。此外,随着对植物转基因研究的深入,人们对转基因植物生物安全性的认识和要求也在不断提高,使用诱导型启动子培育抗逆作物新品种在很多情况下成为了理想选择。目前,有大量研究发现NAC 转录因子与植物的非生物胁迫应答密切相关。Baloglu 等分析得出小麦69-1 在干旱、盐和高温胁迫下强烈表达。Tak 等发现香蕉()中被干旱和高盐诱导表达的42 基因的过量表达可以显著增强转基因植株对干旱和高盐胁迫的耐受性。此外,Su等研究发现葡萄()基因能够被干旱和外源施加的ABA和JA 强烈诱导,其异源过表达的拟南芥植株可通过介导茉莉酸的生物合成来提高其耐旱性。上述研究表明,NAC 转录因子在植物的多种逆境胁迫应答和抗性中均发挥着重要作用。
胡杨由于其优良的抗旱耐盐特性使其成为植物逆境响应和抗逆基因挖掘的理想遗传资源库。本研究以胡杨为材料,利用PCR 克隆获得胡杨基因的启动子。 序列分析发现启动子序列中含有3 个激素(ABA 和GA)响应元件、8 个非生物胁迫(包括干旱、低温和防卫胁迫等)响应元件,推测基因启动子可能受上述非生物胁迫和激素等的诱导响应。为了进一步验证上述推测,利用启动子驱动报告基因在野生型毛白杨中表达,并对获得的转基因植株采用不同胁迫处理(干旱、盐、低温和ABA)后进行了GUS染色和酶活定量分析。检测结果显示:盐、干旱、低温和植物激素ABA 均能不同程度地诱导启动子的活性增加,这一结果与前面的预测一致。同时,GUS 酶活性定量结果显示:与植物激素的响应相比,启动子对盐、干旱和低温的响应更为强烈,推测这可能与相关响应元件在基因启动子中存在的数量和调控的强弱有关。综上,本研究初步阐明了基因启动子响应干旱、盐、冷和外源性ABA 等非生物胁迫的模式,并获得了含该启动子的稳定遗传的转基因毛白杨植株,为后续研究该启动子转录应答调控机制提供了理论基础和实验材料。
