高包埋率还原型谷胱甘肽纳米脂质体的制备工艺优化
2022-03-01徐硕何颖慧张子豪贺明翟玉涵于少轩
徐硕,何颖慧,张子豪,贺明,翟玉涵,于少轩
(山东理工大学 农业工程与食品科学学院, 山东 淄博 255049)
还原型谷胱甘肽(glutathione,GSH)是由L-半胱氨酸、γ-L-谷氨酸和甘氨酸通过肽键缩合而成的三肽化合物,是机体内重要的生物活性物质[1-2],因含有巯基、γ-谷氨酰基等多种官能团而表现出抗氧化、解毒、清除自由基、抗辐射、维护蛋白质和免疫系统功能正常等作用[3]。但GSH在体内循环周期短、易氧化、不能穿过细胞膜, 这限制了其在保健、医疗等领域的应用[4-5]。研究表明,微纳米包埋技术能够有效提高GSH稳定性和透过细胞膜的能力[6]。杜歌[7]以明胶和阿拉伯胶为壁材,利用复合凝聚法制备包埋GSH的微胶囊,包埋率较高,且在高温下对GSH具有一定的保护作用。Naji-tabasi等[8]利用罗勒籽胶对GSH进行了包埋,制备的GSH纳米颗粒在胃肠道环境中仍具有很好的稳定性。另外,Joy等[9]发现包埋到纳米脂质体中的GSH能够增强药物进入大脑的传递能力。
脂质体作为一种由脂质双分子层包裹水溶液形成的微型囊泡体,不仅能够包埋亲脂性化合物,还能包埋亲水性化合物[10]。当GSH被包埋到脂质体中时,双分子层能够减少氧气、金属离子等环境因素对其的影响,增加GSH的稳定性;另外,由于磷脂双分子层与细胞膜有很高的亲和力, 所以更容易将GSH输送到细胞内, 同时可以避免GSH被分解破坏, 使GSH能够缓慢释放,提高生物利用度[11]。将GSH包埋到脂质体中的方法有很多,如pH梯度法、乙醇注入法、反相蒸发法、薄膜-超声法等[12]。本文采用薄膜-超声法制备还原型谷胱甘肽纳米脂质体,以包埋率为指标,通过单因素实验和响应面法对各个影响因素(如卵磷脂的添加量、吐温-80的添加量、GSH的添加量、超声时间以及卵磷脂与胆固醇的比例)的相互作用进行研究,以期得到高包埋率GSH纳米脂质体的最优工艺参数,为其在食品和医疗行业的应用提供理论和实验依据。
1 材料与方法
1.1 材料与试剂
还原型谷胱甘肽(GSH),山东金城生物药业有限公司;大豆卵磷脂,上海麦克林生化科技有限公司;胆固醇,索莱宝生物科技有限公司;吐温-80,国药集团化学试剂有限公司;无水乙醇,国药集团化学试剂有限公司;还原型谷胱甘肽含量检测试剂盒,索莱宝生物科技有限公司。
1.2 仪器与设备
JY99-ⅡD超声破碎仪,北京佳源兴业科技有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;Multiskan FC型酶标仪,赛默飞世尔(上海)仪器有限公司;5039R型离心机,德国Eppendorf公司;FE20pH仪,梅特勒-托利多仪器有限公司。
1.3 试验方法
1.3.1 GSH标准曲线的绘制
GLip能和5-5-二硫代-双-(2-硝基苯甲酸)反应生成2-硝基-5-巯基苯甲酸和谷胱甘肽二硫化物,2-硝基-5-巯基苯甲酸呈现黄色,且在波长412 nm处有最大吸收值[13]。取1 mg GSH标准品用1 mL蒸馏水溶解,配制成质量浓度为1 mg/mL的GSH储备溶液。取适当的储备溶液稀释成质量浓度梯度为12.5、25、50、100、200 μg/mL的标准品溶液,然后按照还原型谷胱甘肽含量检测试剂盒的说明书,在离心管中顺序加入20 μL标准品溶液、140 μL还原型谷胱甘肽含量测试试剂盒中试剂二、40 μL试剂三,混合均匀,静置2 min后在412 nm处测定其吸光度。以GSH的质量浓度为横坐标,以412 nm处的吸光度为纵坐标,绘制GSH的标准曲线。
1.3.2 还原型谷胱甘肽纳米脂质体的制备
本文根据Lasicd[14]的薄膜-超声法制备包埋了GSH的纳米脂质体 (GLip)。称取一定量的卵磷脂、胆固醇和吐温-80溶于15 mL的无水乙醇中,将混合溶液倒于圆底烧瓶,并在50 ℃、-0.1 MPa条件下旋转蒸发,除去有机相,在瓶壁形成均匀透明的薄膜。然后,加入20 mL、0.05 mol/L、pH 6.0的PBS溶液在50 ℃、常压的条件下继续旋转水合30 min洗膜;薄膜洗下来后,将磷酸盐缓冲液(PBS)溶液在冰浴中以250 W的功率进行超声处理,处理时采用工作1 s暂停1 s的工作模式,在20 ℃静置2 h,得到GLip,将得到的GLip样品转移到超滤离心管(截留分子量的大小为10 kDa)的内管中,在3 000 r/min的转速下离心20 min,收集超滤离心管外管中的滤液。向内管中加入2 mL蒸馏水,将GLip浓缩溶液重新分散后,在3 000 r/min 的转速下再次离心20 min,并收集超滤离心管外管中的滤液。为了将未形成GLip的物质与GLip分离,该步骤重复3次。最后,将超滤离心管内管中的GLip浓缩溶液全部移出,将收集到的滤液全部混合,并在4 ℃下贮存,等待测定。
1.3.3 GLip包埋率的测定
准确吸取超滤离心管外管滤液100 μL,适当稀释后,根据1.3.1中描述的测定方法及GSH的标准曲线测定滤液中游离GSH的含量,并根据式(1)计算GLip中GSH的包埋率。
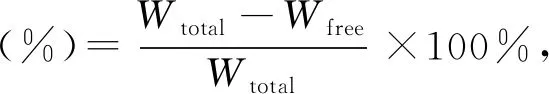
(1)
式中:Wtotal为制备时加入的GSH总量;Wfree为测得的游离GSH的量。
1.3.4 工艺参数的优化
以包埋率为指标,对GLip制备过程中卵磷脂的添加量(100、150、200、250、300、350 mg)、吐温-80的添加量(40、60、80、100、120、140 mg)、GSH的添加量(30、40、50、60、70、80 mg)、超声时间(5、10、15、20、25、30 min)以及卵磷脂与胆固醇的质量比(1∶1、2∶1、4∶1、6∶1、8∶1、10∶1)等参数进行单因素实验,并根据单因素实验的结果,选取卵磷脂的添加量、GSH的添加量、吐温-80的添加量为自变量,设计三因素三水平17个实验点的响应面分析实验。
1.3.5 GLip粒径的测定
取1 mL GLip样品用超纯水稀释10倍,然后用电位-粒度分析仪测定样品的粒径和表面电荷,测定温度为20 ℃,磷脂和分散介质的折射比值为1.330。每个样品平行测定3次以上。
1.3.6 数据处理及分析
利用Design-Expert V8.0.6软件进行响应面分析,拟合二阶多项式方程,对回归线性方程的系数进行显著性检验(F检验),分析总结选取的单因素对GLip中GSH包埋率的影响。利用Design-Expert V8.0.6软件将获得的二阶多项式方程转化为响应曲面,进一步分析实验因素及水平对GLip包埋率的影响[15]。
2 结果与讨论
2.1 GSH含量的测定
根据1.3.1绘制的GSH标准曲线如图1所示。由图1可以看出,在0~200 μg/mL的范围内,GSH的质量浓度与吸光度呈现良好的线性关系,线性方程为y=0.002 1x+0.004 7,R2=0.999 2。根据标准曲线计算出样品中GSH的质量浓度,进而求出GSH的质量。
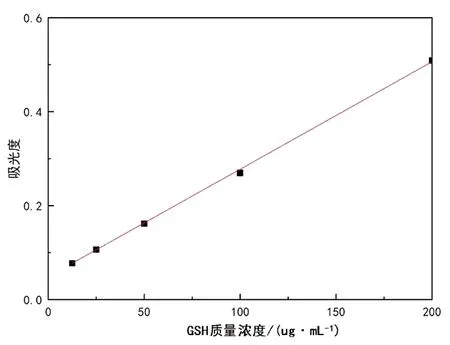
图1 GSH标准曲线图
2.2 GLip平均粒径
GLip平均粒径为(77.70±0.87) nm,PDI为(0.219±0.005),Zeta电位为(-27.20±0.031) V。此纳米级GLip颗粒的粒径分布比较均匀,较稳定。
2.3 单因素实验对GLip包埋率影响
2.3.1 卵磷脂的添加量对包埋率的影响
根据预实验,固定卵磷脂和胆固醇的质量比为4∶1,吐温-80的添加量为100 mg,GSH的添加量为70 mg,研究卵磷脂的添加量为100、150、200、250、300、350 mg时对GLip包埋率的影响。由图2可以看出,当卵磷脂的添加量小于200 g时,GLip的包埋率与卵磷脂的添加量成正比,这主要是因为卵磷脂增多后可以形成更多的磷脂双分子层,进而包裹更多的GSH,使GLip的包埋率提高;当卵磷脂的添加量为200 g时,GLip的包埋率达到最高,约为63%;当卵磷脂的添加量大于200 g时,GLip的包埋率基本不变,这可能是由于磷脂双分子层包埋GSH有一定的限度,达到包埋GSH的最大量后趋于饱和。另外,本文采用薄膜-超声法制备GLip,如果制备体系中卵磷脂的添加量过高,则会造成旋转蒸发后成膜不均匀,用PBS溶液洗膜时较困难。
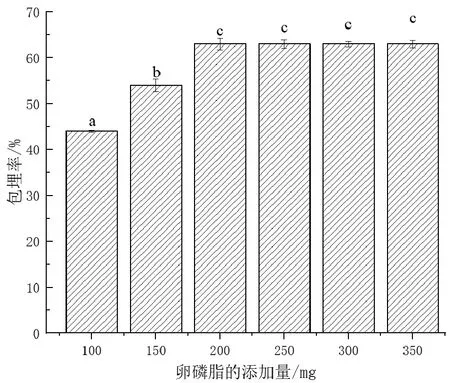
图2 卵磷脂添加量对GLip包埋率的影响
2.3.2 卵磷脂与胆固醇的比例对包埋率的影响
固定卵磷脂的添加量为200 mg,吐温-80的添加量为100 mg,GSH的添加量为70 mg,研究卵磷脂和胆固醇的质量比(1∶1、2∶1、4∶1、6∶1、8∶1、10∶1)对GLip包埋率的影响。如图3所示,随着卵磷脂和胆固醇比例的增加,GLip的包埋率先升高后降低,当卵磷脂和胆固醇的比例为4∶1 时,GLip的包埋率达到最大,约为55%。这主要是由于胆固醇是一种脂类物质,可以进入磷脂双分子层内部,增强磷脂双分子排列的紧密程度,使得成膜稳定,提高Glip包埋率。但是当添加的卵磷脂和胆固醇的比例大于4∶1时,随着加入胆固醇的增多,磷脂双分子层不稳定,导致膜的通透性增加,甚至成膜困难,从而导致GSH渗出,使得GLip的包埋率降低[16]。
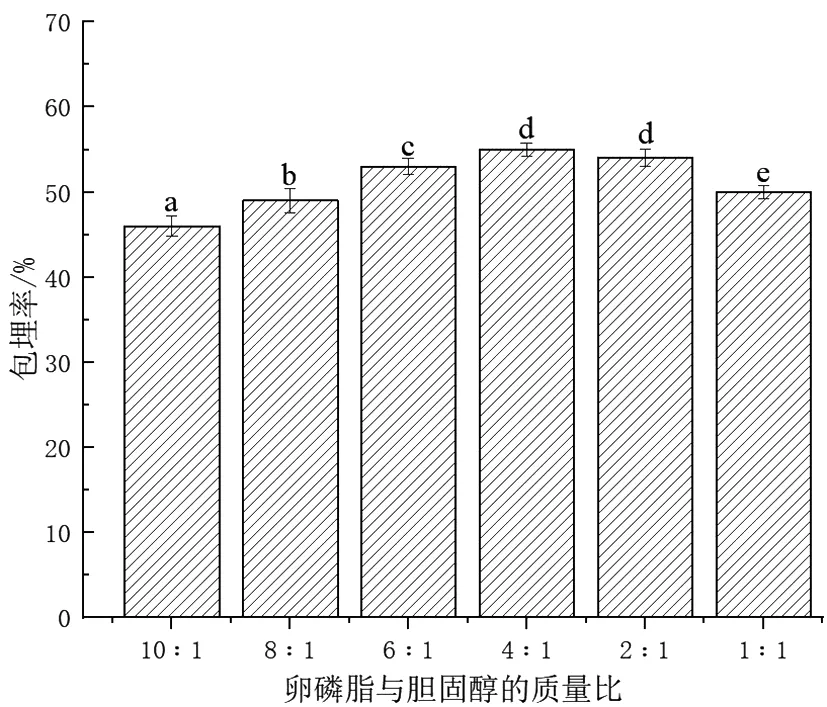
图3 卵磷脂与胆固醇质量比对GLip包埋率的影响
2.3.3 吐温-80添加量对包埋率的影响
固定卵磷脂和胆固醇的质量比为4∶1,卵磷脂的添加量为200 mg,GSH的添加量为70 mg,研究吐温-80添加量(40、60、80、100、120、140 mg)对GLip包埋率的影响。如图4所示,随着吐温-80添加量的增加,GLip的包埋率整体上呈现先升高后降低的趋势,当吐温-80的添加量为100 mg时,GLip的包埋率达到最大,约为60%。吐温-80是一种非离子表面活性剂,可以在脂质体的水相和脂相均匀分配并包入脂质双层,形成较厚的膜,使得磷脂双分子层结构更稳定。因此,当吐温-80的添加量小于100 mg时,随着吐温-80添加量增加,GLip的包埋率提高;但是当吐温-80的添加量太高时,卵磷脂逐渐与吐温-80的胶束增溶形成混和胶团,磷脂双分子层遭到破坏,反而使得GSH包埋率下降[17]。

图4 吐温-80对GLip包埋率的影响
2.3.4 GSH的添加量对包埋率的影响
固定卵磷脂和胆固醇的质量比为4∶1,卵磷脂的添加量为200 mg,吐温-80的添加量为100 mg,研究谷胱甘肽添加量(30、40、50、60、70、80 mg)对GLip包埋率的影响。如图5所示,随着GSH添加量的增加,GLip的包埋率先升高后降低,当GSH的添加量为70 mg时,GLip的包埋率达到最大,约为60%。这主要是因为谷胱甘肽是一种水溶性药物,能够进入磷脂双分子层内部水相中,提高GSH脂质体的包埋率。但脂质体囊泡的体积是有限的,包埋的谷胱甘肽的量是一定的[18]。当谷胱甘肽的添加量大于70 mg时,脂质体水相的体积趋于饱和,很难再溶解更多的谷胱甘肽,从而使得GLip包埋率降低。

图5 GSH添加量对GLip包埋率的影响
2.3.5 超声时间对包埋率的影响
固定卵磷脂和胆固醇的质量比为4∶1,卵磷脂的添加量为200 mg,吐温-80的添加量为100 mg,GSH添加量为70 mg,研究超声时间对GLip包埋率的影响。由图6可知,随着超声时间的增加,GLip的包埋率呈现先增加后减小的趋势。当超声时间为10 min时,GLip的包埋率达到最大,约为56%。在制备脂质体的过程中,通常需要利用超声波使体系中的粒子再分散,从而获得粒径小且分布均匀的脂质体,以增加体系的稳定性[19]。但是,当超声时间太长时,超声波的作用增强,脂质体结构被破坏,GSH泄漏,反而使GLip的包埋率降低。
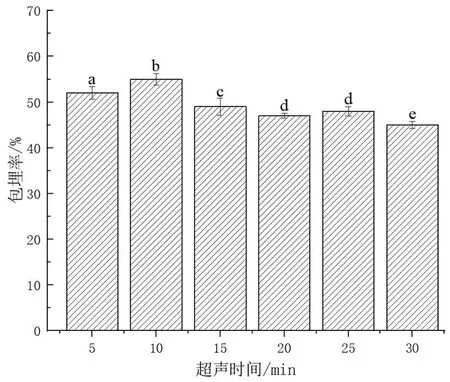
图6 超声时间对GLip包埋率的影响
2.4 GLip制备参数的优化
2.4.1 Box-Behnken 设计
根据单因素实验的结果可知,改变卵磷脂添加量、GSH添加量和吐温-80添加量的GLip最大包埋率大于改变卵磷脂与胆固醇比例和超声时间的GLip包埋率,所以选取卵磷脂的添加量、GSH的添加量和吐温-80的添加量为自变量,以GLip的包埋率为因变量,根据Box-Beknhen中心组合试验设计原理,设计三因素三水平的响应面试验,结果见表1。
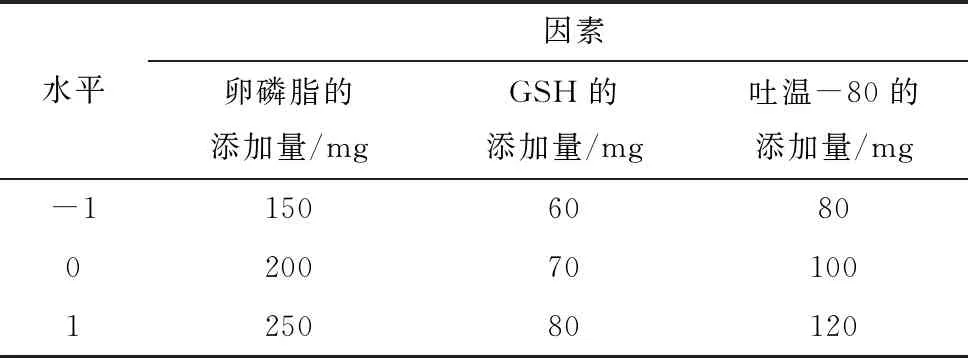
表1 Box-Behnken设计的因素和水平
2.4.2 模型方程的建立及显著性检验
以GLip的包埋率为响应值,对表2中数据进行分析,拟合得到二次多项式回归方程模型为:Y=63.92+3.20A+3.11B-0.52C+2.40AB-0.75AC+1.54BC-3.74A2-2.28B2-1.64C2。通过回归方程系数的显著性检验得到的结果见表3。
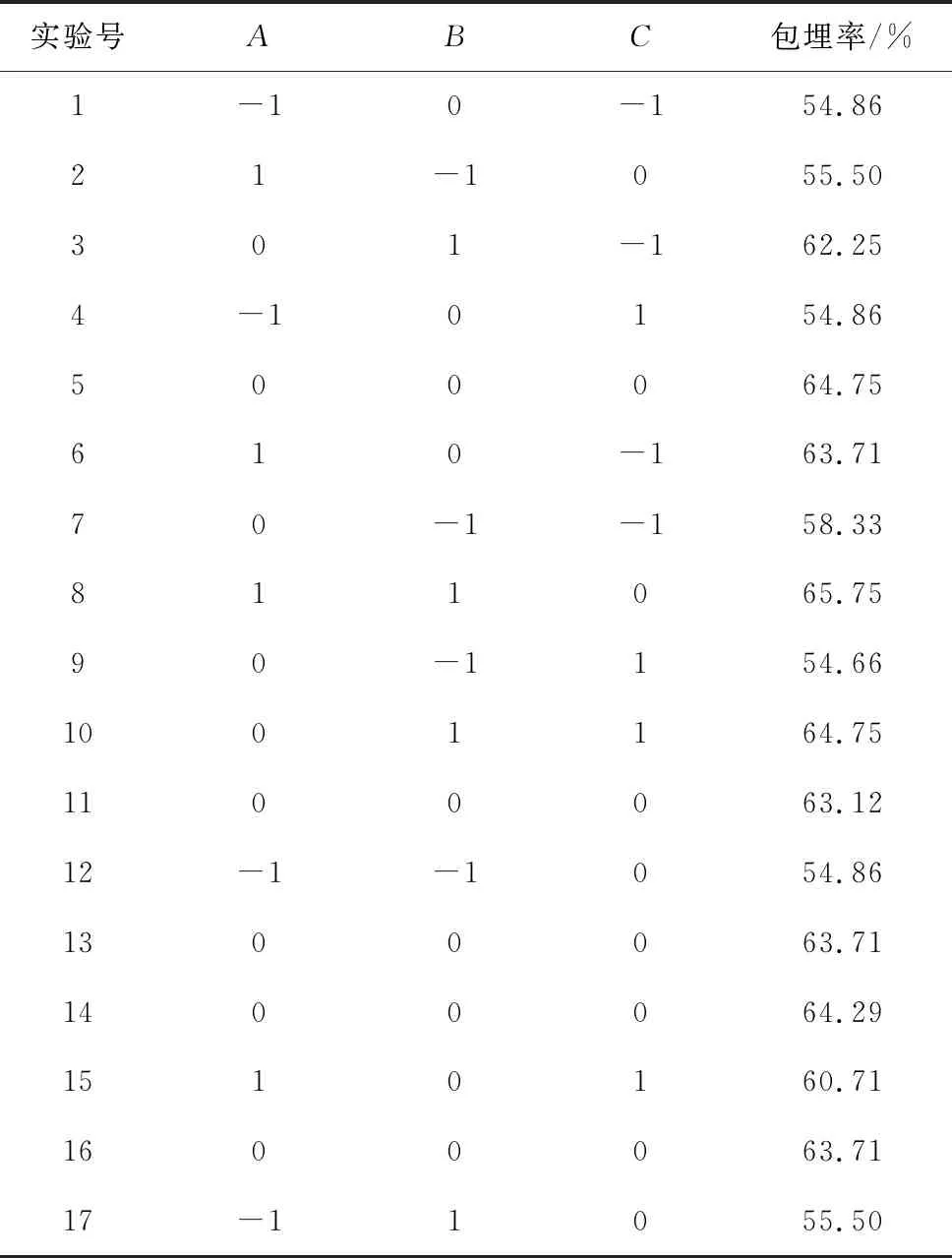
表2 响应面分析方案及实验结果

表3 GLip包埋率回归方程的系数显著性检验及方差分析
由回归方程的系数显著性检验及方差分析可知,P<0.000 1,所以响应面回归方程模型达到极显著水平;又因为R2=0.983 5,表明98% 的数据可以
用此模型方程解释,失拟项的P值为0.160 9,不显著,说明该实验所选模型适用于GLip的制备,二次回归方程模型是有意义的,因此可以求得脂质体的包埋率,优化脂质体制备工艺。各项方差分析表明A、B、AB、BC、A2、B2、C2对GLip的包埋率均有极显著的影响,各影响因素标准回归系数的大小为A>B>C。模型的变异系数CV=1.40%,表明该预测值与实验值差异较小。
2.4.3 制备工艺优化结果分析
响应面法(RSM)的图形是特定的响应面 (Y) 与对应的因素A、B、C构成的一个三维空间在二维平面上的等高图, 每个响应面对其中两个因素进行分析, 另外一个因素固定在零水平。由于该图形可以直观地反映各因素对响应值的影响,因此从试验所得的响应面分析图上可以找到它们在制备GLip过程中的相互作用[20]。GLip制备工艺中卵磷脂的添加量、GSH的添加量和吐温-80的添加量三个因素之间的相互作用对GLip包埋率的影响如图7—图9所示。
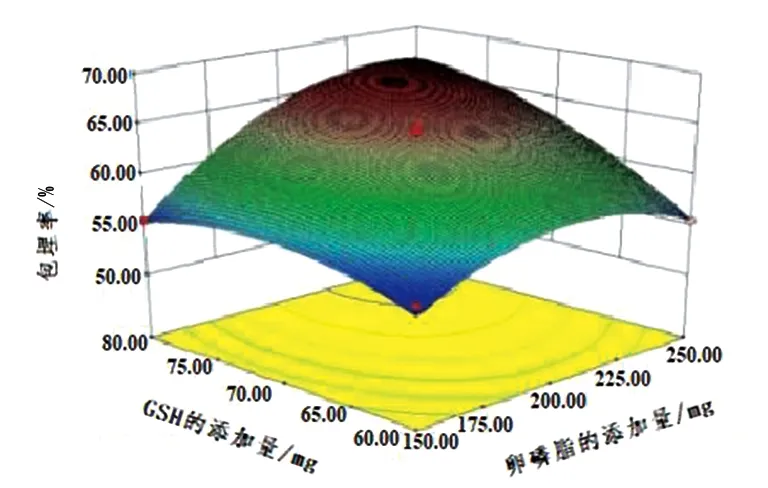
图7 卵磷脂添加量和GSH添加量交互作用对GLip包埋率的影响

图8 卵磷脂添加量和吐温-80添加量交互作用对GLip包埋率的影响
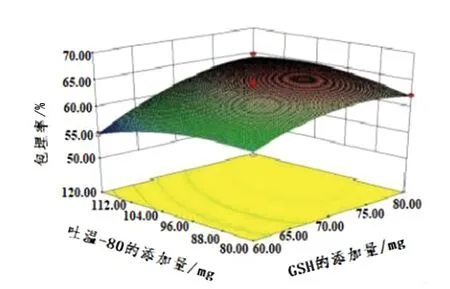
图9 GSH添加量和吐温-80添加量交互作用对GLip包埋率的影响
如图7所示,从响应面图中可以看出坡度比较陡,这说明卵磷脂添加量和GSH添加量的交互作用对GLip的包埋率影响比较明显。由图7中的等高线可知,椭圆在卵磷脂添加量区域排列更密集,说明卵磷脂添加量对包埋率的影响大于GSH添加量对包埋率的影响。当GSH的添加量不变时,随着卵磷脂添加量的不断增加,其包埋率先升高后降低;当卵磷脂的添加量在225~250 mg时,包埋率达到最大。当卵磷脂的添加量不变时,随着GSH添加量的增加其包埋率先增大后减小;当GSH的添加量在75 ~80 mg时,包埋率达到最大。脂质体的外壳是卵磷脂,卵磷脂量一定,其形成脂质体的体积一定,随着GSH的添加,脂质体的容积会超负荷。
如图8所示,从响应面图中可以看出坡度比较陡峭,说明卵磷脂添加量与吐温-80添加量的交互作用对包埋率的影响较为明显。由图8中的等高线可知,椭圆在卵磷脂添加量区域排列更密集,说明卵磷脂的添加量对包埋率的影响大于吐温-80添加量对包埋率的影响。当卵磷脂的添加量不变时,包埋率随着吐温-80添加量的增加呈现先增加后减小的趋势,吐温-80的添加量在96 ~104 mg时,包埋率取得最大值;过量的吐温-80改变了纳米粒子表面的润湿性,使水分易于渗入,加快崩解速度;另外其增溶性强,反絮凝作用提高了药物溶出,从而降低了包埋率。吐温-80的添加量不变时,随着卵磷脂添加量的不断增加,其包埋率先增大后减小,当卵磷脂的添加量在225~250 mg时,包埋率最高。
如图9所示,从响应面图中可以看出坡度比较陡,这说明GSH添加量和吐温-80添加量的交互作用对包埋率的影响比较明显。由图9中的等高线可知,椭圆在GSH添加量区域排列更密集,说明GSH添加量对包埋率的影响大于吐温-80添加量对包埋率的影响。当固定GSH的添加量不变时,包埋率随着吐温-80添加量的增加先增大后减小;当吐温-80的添加量在96 ~104 mg时,其包埋率达到最大。当吐温-80的添加量不变时,随着GSH添加量的不断增大,其包埋率先增大后减小;当GSH的添加量在75~80 mg时,包埋率最高。
2.4.4 GLip最优制备条件的验证
采用Design-Expert V8.0.6统计软件对GLip的制备工艺进行分析得到的最优参数为:卵磷脂的添加量为232.84 mg,GSH的添加量为75.91 mg,吐温-80的添加量为94.30 mg,此时预测的优化包埋率为66.27%。为验证模型的有效性,结合实际实验情况,将最佳制备工艺优化为:卵磷脂添加量为232 mg,GSH添加量为75 mg,吐温-80的添加量为94 mg,进行3次重复试验,得到GLip的包埋率为(65.85±0.54)%,与理论预测值的误差绝对值低于5%。说明响应面法优化得到的模型参数准确,最佳制备工艺条件可靠,具有使用价值。
3 结束语
本文以包埋率为指标,在单因素实验的基础上,利用响应面法分析了薄膜-超声法制备GLip时各影响因素之间的相互作用,得到了制备GLip的最优参数,提高了GLip的包埋率。最佳制备条件如下:卵磷脂添加量为232 mg,GSH添加量为75 mg,吐温-80的添加量为94 mg,得到的最大包埋率为(65.85±0.54)%。本文的研究结果为GSH纳米传递体系的开发提供了参考依据,能进一步促进GSH在食品及医药领域的应用。
