“元素化学实验”中的热致变色现象(一)
——部分Co(II)化合物的热致变色现象及其变色机理探讨
2022-02-28阮婵姿潘蕊许振玲翁玉华张春艳吕银云董志强任艳平
阮婵姿,潘蕊,许振玲,翁玉华,张春艳,吕银云,董志强,任艳平
厦门大学化学化工学院,化学国家级实验教学示范中心(厦门大学),福建 厦门 361005
某些物质在受热或遇冷时会发生颜色变化,这种现象称为热致变色(thermochromism)现象。具有热致变色特征的物质称为热致变色材料。热致变色材料的变化过程是一个物理化学过程。这种材料是一种热记忆功能材料,其应用范围已从简单的示温作用拓展到纺织品、印刷、涂料、防伪等各个方面,广泛应用于工业、纺织、军事、印刷、医疗保健、诊断、建筑、防伪标记、日用装饰、航空航天等各个领域[1–3]。有关热致变色材料的详细分类、变色机理、具体应用等国内外都有很多文献报道[1–3],在此不再详细赘述。
在中学化学教材和整个化学教学过程中,更多关注的是有关化学实验的“结果”或“结论”或“规律”,如何从实验现象或实验数据归纳总结得到“结果”或“结论”或“规律”,大学一年级学生这方面的能力还比较差;同时,大学一年级学生对物质存在的型体及其颜色的认识和描述也比较模糊,所以,我们还需要从简单的试管实验入手,通过演示实验和讨论,一步步引领学生学习观察、分析、思考、判断、推理和归纳总结的能力。
本文主要以学生在探讨“Co2+鉴定”实验过程中,意外发现在CoCl2溶液中加入适量NH4SCN溶液的体系具有可逆热致变色现象为切入点[4],在分析和认识其热致变色机理的基础上,顺势通过“先做后教、以做定教”实验教学的“翻转课堂”模式,即学生完成元素化学实验,具有亲身经历和切身体会后,引领学生回顾和反思做过的元素化学实验中,哪些化合物可能具有热致变色现象及温度、浓度、介质对热致变色现象的影响,一起探讨和揭示热致变色的本质,并以此拓展、延伸、分析和判断其他化合物是否具有热致变色现象,并进一步通过演示实验结果予以证实。化学实验教学过程就是以事实讲“道理”的过程。通过师生边演示、边探讨,引导学生直观认识一些过渡金属化合物或配合物的热致变色现象;通过对其热致变色机理的探讨,以加深学生对物质存在的型体、颜色、结构与性质和配合物分裂能概念的理解,促使学生更直观、感性地认识浓度、温度等对化学平衡的影响;通过结合理论知识对其热致变色机理的归纳、总结,以培养学生学会用理论知识解释实验现象或实验事实及用所学理论知识指导实验的能力,加强学生理论与实验的深度融合,从而实现感性认识到理性认识的提高和升华。
为了使大一学生对基础实验中所涉及的有关热致变色的物质存在型体、颜色及其影响因素以及温度、浓度、介质对化学平衡的影响等有一个直观、准确、清晰和全面的认识与理解,将所有演示实验的流程都以照片形式展示给大家。
下面,我们以学生在探讨Co2+鉴定实验过程中,意外发现在CoCl2溶液中加入适量NH4SCN溶液的体系具有可逆热致变色现象为切入点,一起来认识Co(II)化合物的热致变色现象及其影响因素,并探讨其热致变色的机理。
1 CoCl2与NH4SCN混合溶液体系的热致变色现象
在学生探讨Co2+鉴定实验过程中,意外发现在适量CoCl2溶液中加入适量NH4SCN溶液的体系具有可逆热致变色现象,具体实验过程如图1所示。

图1 CoCl2溶液与NH4SCN混合溶液体系热致变色实验流程
很显然,图1所示的可逆热致变色实验现象也证实了其转化反应(1)是一个配体交换快速平衡的反应,即加热的条件下,有利于SCN−进一步取代红色[Co(SCN)n(H2O)4−n]2−n中H2O形成[Co(SCN)4]2−而显蓝色[4]。加热前后,由于Co2+的配位体不完全相同,同时由于SCN−体积比H2O大,导致配合物的配位数也不一样,所以,晶体场不一样,晶体场分裂能不同,导致配合物的颜色不同,这是上述体系热致变色的本质。
根据化学平衡移动原理,一般来说,加热可能有利于像[Co(H2O)6]2+这类水合离子中的配位H2O被其他配体取代的反应进行,即反应式(1)的平衡向右移动,形成[Co(SCN)4]2−而使体系显现稳定的特征蓝色[4]。

图1所示的热致变色体系是在0.5 mL 0.1 mol·L−1CoCl2溶液中加入2 mL 10% NH4SCN溶液,由于CoCl2溶液本身浓度比较小,Cl−配位能力弱,竞争不过H2O和SCN−与Co2+的配位,所以,该体系的热致变色现象与Cl−无关。
学生理所当然好奇,0.1 mol·L−1CoCl2溶液本身是否具有热致变色现象?通过图2所示的演示实验现象和结果来说明。
2 0.1 mol·L−1 CoCl2溶液的热致变色现象及其影响因素
2.1 0.1 mol·L−1 CoCl2溶液的热致变色现象
0.1mol·L−1CoCl2溶液是否具有热致变色现象?消除学生质疑的最好方法不是争辩,还是通过图2所示的演示实验事实来说明。

图2 0.1 mol·L−1 CoCl2溶液热致变色实验流程
很显然,0.1 mol·L−1CoCl2溶液本身没有热致变色现象,为什么?在探讨这个问题以前,我们先来认识和观察硅胶的变色情况。在实验室中,常用硅胶作为干燥剂,如干燥器中一般要放置变色硅胶作为干燥剂以保持基准物或样品干燥。指示硅胶吸水变色的主要成分就是CoCl2,无水CoCl2主要以[CoCl4]2−型体存在而显蓝色,CoCl2吸水饱和后,即CoCl2·6H2O主要以[Co(H2O)6]2+型体存在而显粉红色。吸水达到饱和的硅胶在烘干过程中可以看到如图3所示的颜色变化情况[5]。

图3 吸水达到饱和的硅胶失水变色实验流程
从图3可以看出,吸水达到饱和的硅胶加热失水过程颜色由粉色([Co(H2O)6]2+)最终变成蓝色([CoCl4]2−),即由配位数为6的[Co(H2O)6]2+转变为配位数为4的[CoCl4]2−,显然是由于Co(II)的配位体和配位数不同,导致晶体场分裂能不同,所以[Co(H2O)6]2+与[CoCl4]2−的颜色不同。正是由于0.1 mol·L−1CoCl2溶液浓度太小,即Cl−浓度太小,竞争不过H2O与Co2+的配位,即使加热也不能使下列平衡(2)向右移动形成[CoCl4]2−而显蓝色,所以,图2中0.1 mol·L−1CoCl2溶液没有热致变色现象。
这样的实验结果也启发我们思考:如果提高CoCl2溶液本身的浓度或提高CoCl2溶液中的Cl−浓度,如在0.1 mol·L−1CoCl2溶液中加入饱和NH4Cl或浓盐酸所形成的体系可能具有热致变色现象。

2.2 影响CoCl2溶液热致变色现象的因素
2.2.1 CoCl2溶液的浓度对其热致变色现象的影响
如果提高CoCl2溶液的浓度,即用0.5 mol·L−1或1 mol·L−1CoCl2溶液代替图2中0.1 mol·L−1CoCl2溶液,实验结果会怎样呢?来看图4所示的演示实验过程。

图4 0.5 mol·L−1和1 mol·L−1 CoCl2溶液热致变色实验流程
从图4可以看出,通过提高CoCl2溶液浓度来提高体系中Cl−浓度,同时也提高了[Co(H2O)6]2+浓度,导致溶液本身颜色很深,热致变色现象不明显。从图4也可以看出,1 mol·L−1CoCl2溶液的本身颜色很深,可见吸收光谱测定结果表明其体系中已有[CoCl4]2−形成,体现了Cl−浓度对平衡(2)的影响。
2.2.2 Cl−浓度对CoCl2溶液热致变色现象的影响
在适量0.1 mol·L−1CoCl2溶液中加入适量6 mol·L−1HCl或饱和NH4Cl溶液,所形成的体系是否具有热致变色现象?还是通过图5所示的演示实验事实来说明。
从图2和图5可以看出,0.1 mol·L−1CoCl2溶液浓度太小,即使加热也不能形成[CoCl4]2−而显蓝色,所以,0.1 mol·L−1CoCl2溶液本身没有热致变色现象。而1 mol·L−1和0.5 mol·L−1CoCl2溶液本身颜色深,热致变色现象不明显。在适量0.1 mol·L−1CoCl2溶液中加入适量6 mol·L−1HCl或饱和NH4Cl溶液,由于所形成的体系中有足够的Cl−,并加热促使平衡(2)向右移动形成[CoCl4]2−显蓝色,说明Cl−浓度对CoCl2溶液热致变色的影响很大,也体现了浓度、温度对化学平衡的影响。
2.2.3 C2H5OH对CoCl2溶液热致变色现象的影响
综合分析上述图1–5,不同体系的热致变色作用与CoCl2溶液的浓度及溶液中Cl−浓度有关,说明H2O对CoCl2溶液热致变色的影响。如果将图5中所加入适量6 mol·L−1HCl或饱和NH4Cl溶液改加为适量无水C2H5OH,以降低单位体积溶液中H2O分子数目而降低H2O的配位竞争力,再加热,都有利于Cl−取代[Co(H2O)6]2+中H2O而形成[CoCl4]2−而显蓝色,如反应式(3)所示,实验事实果真如此吗?再来看图6所示的演示实验过程。


图5 Cl−浓度对0.1 mol·L−1 CoCl2溶液热致变色现象影响实验流程
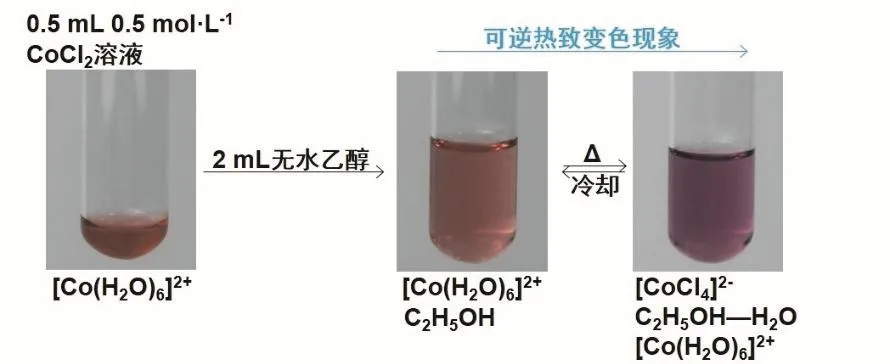
图6 乙醇对CoCl2溶液热致变色现象影响实验流程
图6所示的实验结果证实了我们的推断。实际上,CoCl2-C2H5OH溶液体系热致变色不仅与CoCl2溶液的浓度有关,还与溶液中乙醇与水的比例有关。一般教科书[6]认为在这样的体系中,单位体积溶液中H2O分子数目减少,加热有利于Cl−取代H2O配位形成[CoCl4]2−而显蓝色。也有文献[7]认为该体系的热致变色主要与溶液中存在下列平衡移动密切相关,即

通过上述实验也可以看到Co(II)的八面体配合物[Co(H2O)6]2+与四面体配合物[Co(SCN)4]2−和[CoCl4]2−的颜色不同,正由于它们的配位体以及结构不同,其晶体场分裂能不同而导致其颜色不同。让学生更进一步直观认识到配合物的晶体场分裂能不仅与金属离子有关,而且还与金属离子的配位数、配位结构有关。
3 Co(NO3)2和CoSO4溶液的热致变色现象
上述CoCl2溶液热致变色现象及其影响因素的实验结果体现了浓度一定时,温度对化学平衡的影响。实际上,只要体系满足生成[CoCl4]2−蓝色的条件,加热不是CoCl2溶液变色的必要条件,可见吸收光谱测定结果表明,在0.5 mL 0.5 mol·L−1CoCl2溶液中加入2 mL 6 mol·L−1HCl的体系(图5)中就有[CoCl4]2−生成,只是[CoCl4]2−浓度低,蓝色不明显而已。照此逻辑,我们可以推断Co(NO3)2和CoSO4溶液本身没有热致变色现象,这与实验结果一致(演示实验流程图略)。而实验结果证实相应的Cr(NO3)3和KCr(SO4)2溶液本身具有热致变色现象[8](有关内容见后续报道)。若在0.1 mol·L−1Co(NO3)2或CoSO4溶液中分别加入适量6 mol·L−1HCl或饱和NH4Cl溶液,所形成的体系有没有热致变色现象呢?再来观察图7和图8所示的演示实验过程。
图7和图8所示的实验结果进一步表明,适当提高含Co2+的溶液体系中Cl−浓度,就会产生热致变色现象。

图7 Cl−浓度对0.1 mol·L−1 Co(NO3)2溶液热致变色现象影响实验流程

图8 Cl−浓度对0.1 mol·L−1 CoSO4溶液热致变色现象影响实验流程
通过上述系列演示实验,我们直观地认识了常见Co(II)化合物的热致变色现象及其影响因素,并一起探讨了这些化合物热致变色的机理。从图1–6可以看出,CoCl2溶液的热致变色与其浓度及溶液中Cl−浓度有关,其热致变色的机理主要是由于Co2+周围的配位体及配位数变化而引起的。并且,当CoCl2溶液本身的浓度比较大或CoCl2溶液体系中Cl−过量时,即使不加热,溶液就是蓝色的,说明在这样的条件下,Cl−浓度对化学平衡的影响比温度对化学平衡的影响更大,Cl−浓度足够大时,才能显现温度对化学平衡的影响,使学生直观认识到化学平衡是相对的、有条件的。也为进一步了解Cr(III)化合物热致变色现象和热致变色机理探讨提供借鉴和启示。
Cr3+有3个成单的d电子,吸收部分可见光可以发生d–d跃迁,所以Cr(III)化合物都显有颜色。那么,常见Cr(III)化合物是否具有热致变色现象?其热致变色的机理又是什么?我们将继续以演示实验为基础,观察和记录常见Cr(III)化合物的热致变色现象,分析和探讨其热致变色机理,希望进一步给学生有益的借鉴和启发。
鉴于本文篇幅所限,有关Cr(III)化合物热致变色现象及其影响因素实验实施结果以及热致变色机理探讨的有关内容见后续报道。
4 结语
通过上述演示实验,生动直观地展示了一些Co(II)化合物的热致变色现象及其影响因素,并探讨了其热致变色的机理。简单来说,热致变色现象就是在给定实验条件下温度影响化学平衡移动的结果。看似简单的热致变色实验现象背后融合了元素及其化合物的性质及温度、浓度、介质对化学平衡的微妙影响以及配合物的分裂能及其配合物的组成、结构对分裂能的影响等理论知识,有助于加强学生理论与实验的相互融合,对学生批判性思维的培养具有示范、引领作用,把经典的“试管”实验教学功能发挥到了极致。
