短链氯化石蜡分析方法、环境行为与健康效应的研究进展
2022-02-27于海斌张静星郑晓燕
吴 静,于海斌,张静星,郑晓燕,袁 懋
中国环境监测总站,北京 100012
氯化石蜡(chlorinated paraffins,CPs)具有挥发性低、电绝缘性好、价格低廉等特点,被广泛应用于工业生产中的塑料添加剂、阻燃剂、金属加工润滑剂或皮革加脂剂等[1].CPs 碳链长度通常在10~30 个碳原子,其中短链氯化石蜡(short chain chlorinated paraffins,SCCPs)的碳原子数在10~13 之间.SCCPs 具有持久性、长距离迁移性、生物蓄积与毒性,且具有潜在的致癌特性.2017 年5 月,SCCPs 被《斯德哥尔摩公约》(简称“《公约》”)持久性有机污染物(persistent organic pollutants,POPs)审查委员会列入附件A,正式成为新增POPs,《公约》要求缔约方限制其生产和使用[2].
自20 世纪30 年代起,CPs 在全球范围内开始被大量生产和使用,至1985 年CPs 的全球产量已经达30×104t.自20 世纪90 年代开始,世界环境保护组织和世界卫生组织开始逐渐意识到SCCPs 的一些物化性质与传统POPs 十分类似,欧盟以及北美等地区自此开始限制SCCPs 的生产及使用[3-4].美国环境保护局(US EPA)于1995 年将SCCPs 加入有毒物质排放清单(Toxics Release Inventory,TRI),并限制了含SCCPs产品的生产、加工、出口等[5].我国于20 世纪50 年代起生产CPs,由于塑料制品需求量日益增多,至2009年,CPs 在我国的年产量为60×104~100×104t[6],部分CPs 产品中SCCPs 占比在80%以上[5].SCCPs 会随着产品的生产与使用进入到环境中,并在各种环境介质中长期赋存,进而对生态环境与健康造成潜在的风险[7],而我国尚未严格管控SCCPs 产品的生产与使用.目前,我国已有大量学者对SCCPs 在各种环境介质中的环境赋存及环境行为开展研究,但对SCCPs的环境健康效应等研究较为鲜见.而SCCPs 的分析方法直接决定了分析结果的准确性,是研究SCCPs环境行为与健康效应的基础.因此,该研究将对SCCPs 的分析方法、环境行为,及其对环境健康效应的最新研究进展进行综述,以期为开展相关研究以及我国管控CPs 类等新污染物提供参考,也为我国落实“十四五”生态环境监测工作中的新污染物治理与监测提供参考依据.
1 SCCPs 的分析方法
环境及生物中SCCPs 的检测步骤通常包括样品的萃取、净化、前处理、色谱分离、质谱检测以及定量分析等.由于SCCPs 的结构十分复杂,且氯原子的位置及氯化比例不固定,容易导致氯化过程中产生复杂的同系物与异构体等,因此目前国内外并无检测SCCPs 的标准分析方法[3,8-10].目前,利用色谱与质谱对SCCPs 进行定量分析取得了较大进展[11-19],常见的SCCPs 分析方法的适用范围及优缺点如表1 所示.
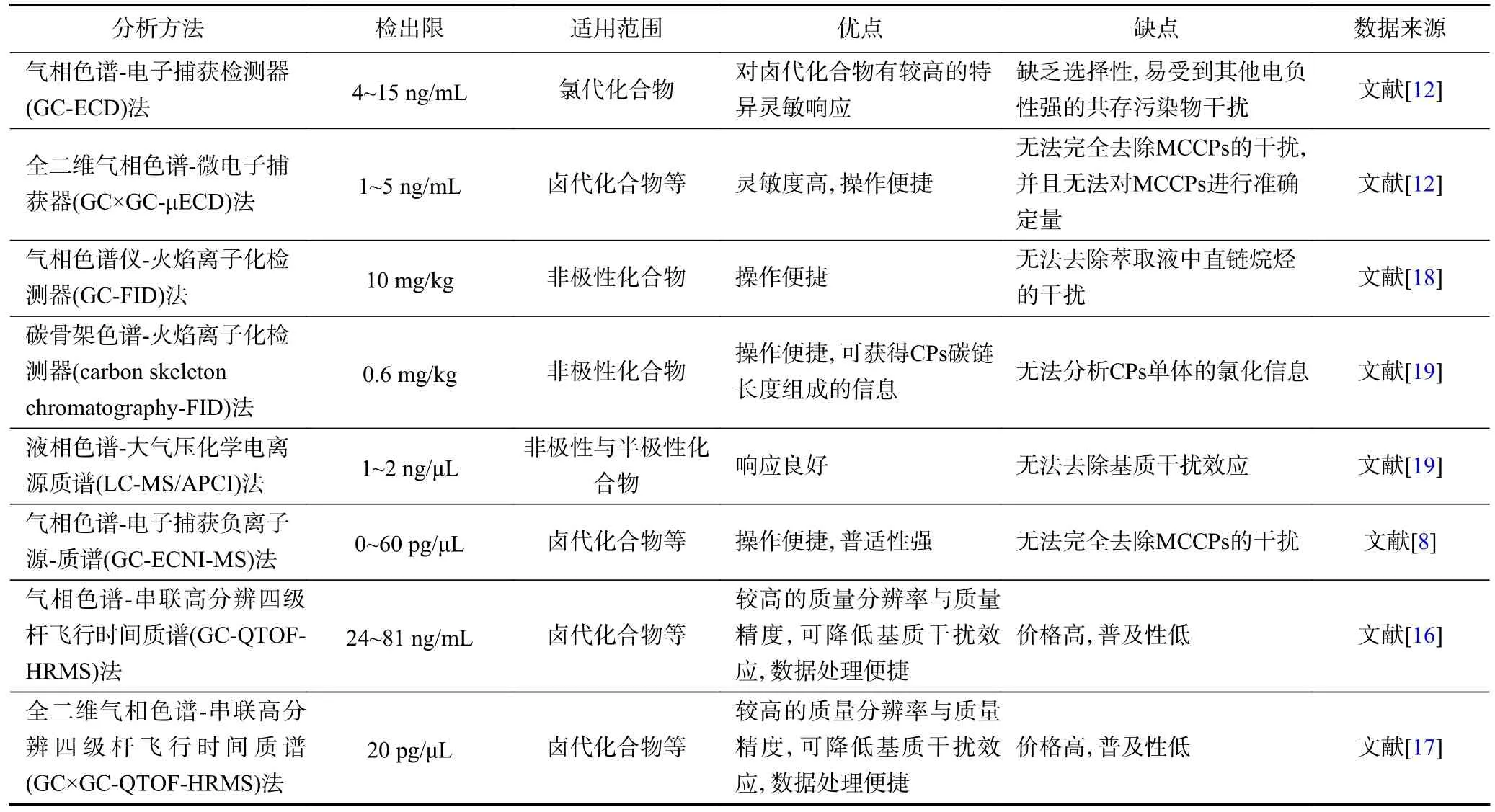
表1 SCCPs 的常见分析方法特征Table 1 Common analytical methods of SCCPs
气相色谱-电子捕获检测器(gas chromatographyelectron capture detection,GC-ECD)法测定SCCPs 的灵敏度较高.但由于GC-ECD 缺乏选择性,易受到其他含氯物干扰,因此GC-ECD 很少用于环境介质中SCCPs 的定量分析[11].而全二维气相色谱(GC×GC)结合了线性程序升温和色谱柱间固定相极性的改变,可实现待测物质的正交分离.GC×GC 峰容量大,分辨率和灵敏度高,适合分析复杂样品,可弥补ECD 的不足[12].Xia 等[12]将GC×GC 与ECD 联用优化了SCCPs的检测方法,并将该方法用于检测鱼体中的SCCPs.
气相色谱-串联质谱(gas chromatography-mass spectrometry,GC-MS)法在化工产品与不同介质的环境样品中应用较为广泛[13-14],可直接测定SCCPs 的总含量,操作简单.GC-ECNI-MS 法测定SCCPs 时可依据标准品,严格控制保留时间和丰度比以减少和避免不同SCCPs 单体之间造成的相互重叠与干扰[8].Tomy 等[8]将气相色谱-负化学离子源-质谱(gas chromatography-negative chemical ionization-mass spectrometry,GC-NCI-MS)法应用到SCCPs 及同系物组分的定性与定量.Reth 等[15]使用气相色谱-电子捕获负离子源-质谱(gas chromatography-electron capture negative ionization-mass spectrometry,GC-ECNI-MS)对CPs 的标准品进行检测,结果表明,ECNI 在电离时MCCPs 与SCCPs 单体会产生质核比相似的碎片离子,因此在测定SCCPs 时MCCPs 会干扰其测定结果[15].ECNI-MS 由于离子源所限,对氯原子数小于5的CPs 单体没有响应[15].
Gao 等[16]建立了气相色谱-串联高分辨四级杆飞行时间质谱(gas chromatography-quadrupole time of flight-high resolution mass spectrometry,GC-QTOFHRMS)法测定CPs,该方法利用TOF 在全扫模式下,结合ECNI 分析CPs 含量.通过提取CPs 碎片离子的精确质量数,GC-QTOF 可以将名义质量上有重合的SCCPs 和MCCPs 特征离子进行区分,进而利用氯含量和响应因子的线性关系对SCCPs 和MCCPs 定量.GC-QTOF-HRMS 同时可以消除基质干扰,也可降低分析测定时的基质效应[16].Xia 等[17]在GC×GC-ECD检测SCCPs 方法的基础上建立了GC×GC-ECNIHRTOF-MS 法测量CPs,最大限度地将SCCPs 与MCCPs 区分,并减少了基质干扰,该方法可应用于沉积物与鱼肉中CPs 的检测 .
目前,常用的SCCPs 分析测试方法均有一定局限性,如GC-ECD 法的选择性和特异性较局限,易对分析结果造成假阳性误判,低分辨质谱无法区分部分分子量接近的低氯代MCCPs 与高氯代SCCPs.因此,目前国内SCCPs 分析方法的发展趋势为由低分辨质谱向高分辨质谱发展,而高分辨质谱虽能将SCCPs的干扰降低,但由于价格较高而普适性不广,因此SCCPs 的分析方法仍有待进一步深入研究.
2 SCCPs 在生物体内的环境行为与健康效应
2.1 SCCPs 在生物体内的环境行为
SCCPs 具有长距离迁移与生物蓄积特性,因此SCCPs 可在全球范围内的动物体内检出,并且因其具有持久性,可以长期在生物体内蓄积[15,20].近年来,有关SCCPs 在生物体内赋存的报道主要集中在极地地区和中国.在极地地区,Boreen 等[20]对挪威境内红蛙、娃鱼和鳍鱼等食用鱼的研究发现,其体内SCCPs含量在108~3 700 ng/g (以脂质量计)之间,且鱼体内SCCPs 含量与工业区的距离呈正相关.Li 等[21]对南极法尔兹半岛上生物样品的研究表明,动物样品中SCCPs 含量在40.2~257 ng/g (以干质量计)之间,并且在南极帽贝和南极骨螺之间呈生物放大现象.在中国,Ma 等[22]对辽东海湾的浮游动物-无脊椎动物-鱼食物网进行研究,发现SCCPs 的含量为86~4 400 ng/g (以湿质量计),且在所有CPs 同系物中C10Cl5和C11Cl5单体占比较大,在食物链中呈生物放大现象.Zeng 等[23]在北京高碑店湖中发现,不同类型的鱼体内赋存较高含量的SCCPs,且SCCPs 含量随营养级呈放大趋势.
2.2 SCCPs 的毒性效应
SCCPs 具有生物蓄积与生物放大效应的环境行为特征,并且SCCPs 在环境中的长期赋存还将对生物体造成潜在的毒性危害[24-28],通过暴露研究得到的SCCPs 毒性效应如表2 所示,但目前关于SCCPs 对生物体的毒性效应研究十分有限.研究表明,SCCPs对大鼠的无可见效应浓度(NOEC)为10 mg/(kg·d)[24].Bucher 等[25]用氯化度60%的C12同系物对小鼠灌胃2年,得到最低观察效应水平(LOEC)为125 mg/(kg·d),并发现SCCPs 对F344/N 大鼠和B6C3F1 小鼠均具有致癌性[25].SCCPs 在生物体内的毒作用靶器官为肝、肾、甲状腺和甲状旁腺等[26].研究发现,SCCPs 可导致大、小鼠肝肥大,同时可导致血浆中甲状腺激素增加[24,27];且对于雄性大鼠,SCCPs 可增加其肾脏质量和肾管状嗜酸细胞数量[24].李勋等[28]将大鼠分别暴露于SCCPs 占比不同的两种CPs 商品,发现在大鼠的摄食与体重无明显变化的情况下,暴露最终可导致大鼠出现肝细胞肿胀、水样变性及胞质疏散的病理现象;并且在大鼠肾脏和肺部器官分别发现肾小管肿胀、肾小球萎缩、肾小球玻璃样变症状以及肺泡隔增厚、炎症细胞浸润等肺组织病理学改变现象.SCCPs的暴露可诱导鼠类肝脏与甲状腺发生肿瘤病变,并且随着暴露剂量的增加,鼠类肾脏腺瘤和癌症的发病率也将升高[24-25].SCCPs 对生物体具有毒性效应,对人体健康同样可带来潜在的风险,因此亟需进一步研究SCCPs 在生物体以及人体内的环境赋存与毒性效应,为我国关于SCCPs 的环境健康风险评估研究奠定基础.
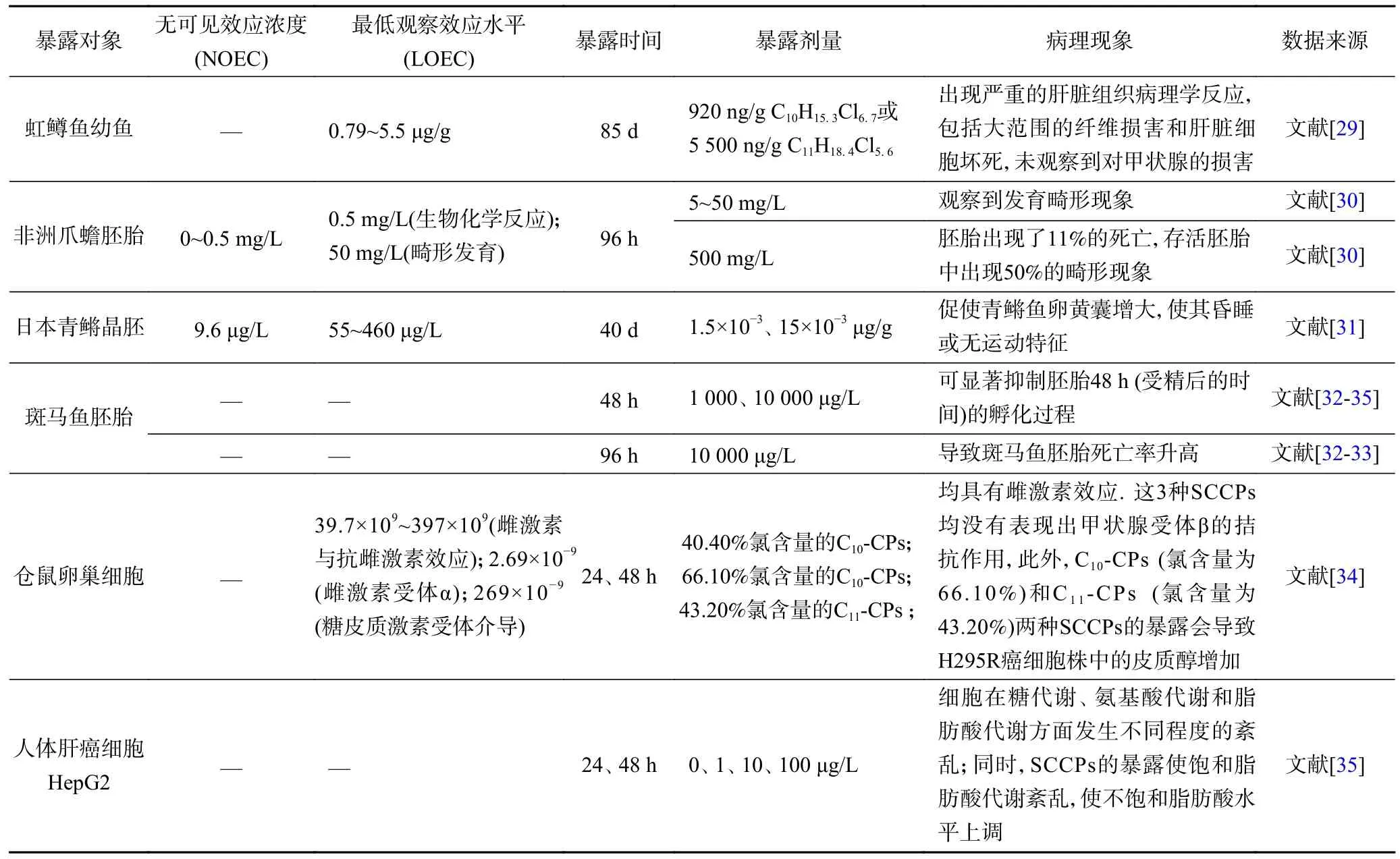
表2 SCCPs 暴露的毒性效应汇总Table 2 Summary of the exposed toxic effects of SCCPs
2.3 SCCPs 的人体暴露风险研究
SCCPs 对生物体和人体具有潜在的毒性效应,CPs 在生产与使用中会导致其排放到环境中,进而引起SCCPs 的环境暴露,危害人体健康.空气、灰尘、颗粒物、饮食以及饮用水所含的CPs 均可引起人体的CPs 暴露[36-42].空气和颗粒物中的SCCPs 可通过呼吸系统被摄入人体,人类还可通过皮肤接触进行SCCPs 的灰尘外暴露,也可通过径口摄入水与食物摄取SCCPs,因此SCCPs 可在人体内长期蓄积[43-49].
Harada 等[36]对北京市SCCPs 膳食暴露研究发现,1993−2009 年SCCPs 在北京市膳食暴露量增长超过20 倍,但东京和首尔的SCCPs 膳食暴露量变化不大.近年来,环境介质中的CPs 在人体内的暴露浓度如表3 所示.Harada 等[36-37]利用分析结果对饮用水、奶粉和双份饭中SCCPs 在人体的暴露量做了计算,发现成人膳食摄入SCCPs 水平〔几何平均数=611 ng/(kg·d) (以体质量计)〕与2009 年北京市居民膳食暴露于SCCPs 的量相当,但比2007 年日本东京和韩国首尔居民膳食SCCPs 暴露量高一个数量级.Gao等[37]通过计算发现,1~2 岁的幼儿与成人通过膳食摄入CPs 的量相差不大.

表3 我国环境介质中CPs 在人体内的暴露浓度Table 3 Summary of CP concentrations in different matrices which posed exposure risks for human in China
研究[38]表明,相比于成人,灰尘和空气内更易引起幼儿的CPs 环境外暴露,1~2 岁幼儿的暴露水平为0.49 〔ng/(kg·d)(以体质量计)〕,远高于成人〔0.06 ng/(kg·d)(以体质量计)〕.对北京市室内空气、建筑玻璃表面有机膜与室内灰尘中CPs 的研究[37,39-40]发现:在室内空气样品中均检测到SCCPs,其含量(几何平均数=0.23 μg/m3)显著高于室外SCCPs 含量;对于建筑玻璃表面有机膜,SCCPs 浓度在室内侧高于室外.综上,室内同样存在SCCPs 的环境暴露风险.普通人群在室内环境的时间通常大于室外环境,因此室内灰尘和空气对人体的暴露风险值得进一步关注.Huang等[41]研究了北京市室内外颗粒物(PM10、PM2.5和PM1.0)中的SCCPs 和MCCPs,结果表明,室内SCCPs和MCCPs 浓度均高于室外,且CPs 在空气中主要分布于粒径小于2.5 μm 的颗粒物上.粒径小于2.5 μm细颗粒物比其他颗粒物在大气中停留的时间长,长时间暴露会潜在危害人体健康.SCCPs 在环境介质中的含量随时间呈增长趋势,SCCPs 对人体潜在的健康风险,尤其在母婴传播中的暴露风险亟需进一步研究[42].Xia 等[43-44]分析了我国2007 年12 个省份以及2011 年16 个省份的1 370 例母乳样本,发现2011 年SCCPs 含量平均值 (681 ng/g,以脂质量计)高于2007 年(733 ng/g,以脂质量计),说明2011 年人群的SCCPs 暴露水平高于2007 年;同时,2007 年和2011年农村母乳样本中SCCPs 平均值均低于城市,表明城市中SCCPs 的暴露水平高于农村地区,可能与城市相对发达的工业有关.血液可以直接反映人体内污染物的暴露情况.Li 等[45]对我国南方人群血样中的CPs 进行了研究,发现血样中SCCPs 的浓度高于MCCPs 和LCCPs.胎盘是母婴物质交换的重要媒介,因此胎盘中CPs 的赋存水平可反映其对胎儿的暴露情况.Wang 等[46]分析了河南省54 名产妇胎盘中SCCPs 的赋存情况,结果表明,在胎盘样品中SCCPs浓度为98.5~3 371 ng/g (以脂质量计),MCCPs 在部分样品中的检出浓度在80.8~954 ng/g (以脂质量计)之间.SCCPs 在胎盘的含量低于在血液中,但在母乳与胎盘中SCCPs 均有赋存,SCCPs 在环境中的赋存对婴儿有潜在的健康风险,其暴露风险不容小觑.在致癌风险方面,国际癌症研究机构(IARC)表示碳链长度为12 且平均氯化程度约为60%的SCCPs 是2B类化合物,其对人类具有潜在的致癌风险[47].
3 国内外管理现状
SCCPs 因具有POPs 特性,其在环境中的赋存可对生态环境和人体健康带来潜在风险,且随着时间的推移,SCCPs 在环境介质中的含量呈上升趋势.许多国家自20 世纪90 年代起相继出台了一系列法律法规对SCCPs 的生产和使用进行限制.IARC 在1990年将SCCPs 列于致癌物质名单中2B 类化合物后;美国于1995 年将SCCPs 加入TRI,要求企业需向政府报告SCCPs 的排放和转移量;US EPA 于2003 年要求对SCCPs 的生产和使用实行全面限制.2012 年3月US EPA 发布了关于部分SCCPs 重要新用途的规则,将根据相关企业对SCCPs 的生产、进口或加工计划的报告进一步制定SCCPs 相应的新用途及其实施方案.2012 年8 月,US EPA 针对进口CPs 的生产企业提出缴费计划,并终止SCCPs 的进口,同时对MCCPs 和LCCPs 建立了进口限制.
在《欧盟水框架指令手册》中,SCCPs 被列为水环境首要危险物质,且在第25 次危险物质指令(Council Directive 67/548/EEC)中,欧盟正式将C10~C13归类为第三类致癌物质.欧盟议会和理事会号召各成员国限制SCCPs 及其配制品的使用,并规定在金属加工业和皮革加工产品中的SCCPs 含量不能超过1%[50].2005 年欧盟提议将SCCPs 作为POPs 候选物质,对其生产和使用进行全面的限制[51].加拿大在2012 年已经停止生产SCCPs,且对SCCPs 的风险管理法案已经启动[52].SCCPs 在2012 年被加入《部分有毒物质禁用法规》(2012 版)中,被禁止在加拿大境内进行生产、使用、销售和进口.
目前,我国各环境介质中的SCCPs 浓度水平已相对较高,但我国对SCCPs 的研究仍亟需补充.我国于2017 年将SCCPs 列入了《优先控制化学品名录(第一批)》,其中要求应针对其产生环境与健康风险的主要环节,依据相关政策法规,结合经济技术可行性,采取风险管控措施,最大限度降低化学品的生产、使用对人类健康和环境的重大影响[53].但目前难以对CPs 的生产使用制定合理的限制或减排措施,因此我国至今尚未停止有关SCCPs 的生产与使用.
4 结论
a) SCCPs 作为列入POPs 清单的新污染物,因其持久性、长距离迁移特性与毒性,在环境中将长期赋存并对生态环境和人体健康造成潜在危害.随着时间的推移,SCCPs 在环境中的含量呈上升趋势,因此SCCPs 对人体的暴露风险也将随时间的推移而增加,亟需对SCCPs 的环境赋存与工业分布模式进行全面研究,补充相关的科学研究数据并制定相应的法律法规对SCCPs 的生产和使用进行管控.
b) 目前,我国在研究SCCPs 环境行为、环境暴露和毒理效应等方面取得了一定的进展并积累了一些数据,但对于综合评估SCCPs 的环境风险并制定相应的法律法规还仍有不足.目前,国内SCCPs 分析方法的发展趋势是由低分辨质谱向高分辨质谱发展,但高分辨质谱由于价格较高而普适性不广,且目前国际上尚未生产出理想的SCCPs 标准样品和相应的标准参考物质,因此SCCPs 标准物质制定、定量与分析方法等有待进一步深入研究;在优化与规范SCCPs 定量与分析方法,提高分析准确性的同时,应继续深入研究环境中SCCPs 的迁移转化规律机制,为揭示其环境行为与环境暴露提供科学依据.
c) 国内对于SCCPs 在各种环境介质中的研究已相对成熟,但在环境暴露方面的研究仍有不足,尤其对人体样品中SCCPs 的赋存研究较少,因此对SCCPs 的人体外暴露需进行深入的系统性研究.
d) 由于缺少SCCPs 在多环境介质中的迁移转化、毒性效应与健康风险评估的环境数据,我国尚未停止SCCPs 的生产.我国在SCCPs 毒理学研究方面仍局限于动、植物体及其细胞组织的形态变化,在毒性作用机制方面需加深研究.今后应借助分子生物学方法,从分子水平、基因水平、细胞水平等方面深入开展SCCPs 的毒理学研究.
