腹膜假黏液瘤保留卵巢的研究进展
2022-02-26唐华栋综述马瑞卿付凤仙审校
唐华栋 综述 马瑞卿 付凤仙 审校
(北京大学航天临床医学院 航天中心医院妇产科,北京 100049)
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)是一种罕见的临床综合征,以黏液外分泌细胞在腹膜、网膜或脏器表面种植导致腹腔内大量淡黄色胶冻状黏液腹水形成为特征,发病率约为2/100万[1~3]。PMP本质为黏液性肿瘤腹盆腔广泛的种植转移,对于女性PMP患者,卵巢为最常见的转移部位之一,卵巢受累率可达50%,且往往较早出现,肿瘤细胞减灭术(cytoreductive surgery,CRS)术中通常选择切除双侧卵巢。卵巢为女性生殖及内分泌器官,双侧卵巢切除会导致自然生育力丧失、绝经期提前、继发生活质量下降等,然而,对于绝经前PMP女性患者,CRS术中是否可以保留卵巢目前仍有争议。本文就PMP治疗保留卵巢的研究进展进行文献总结。
1 PMP发生卵巢转移的机制
PMP的病理过程与消化道的大多数原发性肿瘤相似,杯状细胞的肿瘤转化导致原发性黏液性肿瘤的形成,这种转化最终导致整个腹腔中的大量黏液沉积,从而导致腹腔内压力的增加[4]。PMP极少通过血行播散或淋巴管向远处转移,转移途径主要通过所谓的“再分配现象”:①由自由移动的上皮细胞引起,细胞随着腹膜液的重力移动,其种植部位由腹膜液吸收部位的重力和浓度决定。腹膜液吸收的主要部位是网膜,网膜面积越大,种植越多,尤其是右半网膜以及膈下聚集最多。②通过重力,在重力作用下累及盆腔、左半结肠旁沟、肝十二指肠韧带、肝后间隙、幽门下区等处。一般无淋巴结转移,亦不出现远处脏器转移,在重力作用下,PMP对卵巢的转移多为表面播散种植,同时卵巢作为女性生殖和内分泌器官,血运丰富,且定期排卵皮质表面有破损,有利于上皮细胞或黏液肿瘤细胞种植转移[5,6]。
在目前的报道中,阑尾来源的PMP主要基因改变包括GNAS、KRAS、TP53、SMAD4、ATM和APC的突变。在这些突变中,GNAS和KRAS是主要的突变基因,突变频率最高。PMP患者中,KRAS突变的发生率为57%~100%,GNAS突变的发生率为63%[7~10]。GNAS基因突变可激活Gas,导致cAMP的增加及PKA激活(磷酸化),同时MUC2、MUC5Ac等黏蛋白大量产生,与产生丰富的黏液相关。KRAS突变在PMP中很常见,被认为是肿瘤发生的早期事件。KRAS一旦发生突变,就会丧失GTP水解酶活性,进而持续活化,促使细胞持续增殖而癌变。
2 PMP发生卵巢转移的病理特点
PMP的主要临床病理特点:①腹腔内有大量黏液性或胶性腹水;②腹腔内有大小不一、多少不等的结节或黏液池形成,黏液池内可见漂浮的黏液上皮,亦可无上皮。PMP根据浸润状况,即胶冻样/黏液样物质是浸润周围组织并引起间质反应,还是位于组织表面,可分为浸润性及非浸润性。根据上皮细胞异型性可分为良性、交界性、恶性,依据上皮分化程度可分为高、中及低分化。将浸润状况、上皮细胞异型性及分化程度结合起来,可把PMP分为良性、交界性及恶性。良性分化良好无浸润,交界性分化中等无浸润,恶性低分化有浸润,与转移或原发性黏液腺癌不能区分[11,12]。PMP发生卵巢转移时通常瘤体较小、双侧转移,累及卵巢表面或浅表皮质。卵巢外观上通常出现结节样改变,即使外观正常,显微镜下也可见到肿瘤细胞成群或者结节状包绕卵巢基底细胞,尤其在卵巢浅表皮质中[13,14]。囊内可充满胶冻样的物质,与原发性肿瘤相比更加黏稠,似果冻样,不易于囊壁分离[15~19]。
PMP的临床分型多采用国际腹膜肿瘤表面协作组(The Peritoneal Surface Oncology Group International,PSOGI)制定的分型,分为4型,即无细胞黏液、低级别腹膜黏液癌、高级别腹膜假黏液癌和高级别腹膜假黏液癌伴印戒细胞。低级别腹膜黏液癌多起源于良性病变,如阑尾黏液性腺瘤、阑尾黏液性囊肿、卵巢黏液性囊腺瘤及卵巢黏液囊肿;高级别腹膜假黏液癌多起源于恶性病变,如阑尾黏液性囊腺癌以及卵巢黏液性囊腺癌。低级别腹膜黏液癌是经典的PMP,腹膜表面有黏液性腹水,没有浸润,并且具有惰性过程,多起源于良性阑尾病变。高级别腹膜假黏液癌代表具有较高的恶性细胞的类别,因此,预后较差。不同的病理类型发生卵巢转移的机率不同。低级别腹膜黏液癌发生卵巢受累的机率为62%,高级别腹膜假黏液癌患者卵巢受累的发生率为87.5%[20]。
PMP发生卵巢转移的生长方式包括表面浸润和间质浸润,约50%仅为表面浸润[13]。Elias等[5]报道低级别腹膜黏液癌患者中18%出现间质浸润,高级别腹膜假黏液癌患者中间质浸润的发生率为82%;PMP病理类型恶性度越高,越容易发生间质浸润。同时,PMP的生长方式与原发肿瘤的部位也有相关性。原发阑尾的PMP发生卵巢转移时主要为表面浸润,原发结肠的PMP发生表面浸润时多伴有间质浸润[21]。
PMP病理形态虽为良性或低度恶性,但生物学行为是恶性,极易复发、粘连,有慢性消耗的特征。大多数PMP患者死于肠梗阻,非区域性或全身性的肿瘤转移[22]。Elias等[23]报道PMP患者5年总生存率为70%左右,无瘤生存时间约78个月。Chua等[24]评估CRS联合腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)治疗腹膜假性黏液瘤的长期疗效,统计18年16家机构收治阑尾来源PMP 2298例,均接受 CRS 联合 HIPEC 治疗,总体中位生存时间为196个月,中位无进展存活期为98个月;5、10年存活率分别为 63%、59%。影响PMP患者预后的因素包括病理类型、肿瘤细胞减灭术的满意程度、腹膜癌指数(Peritoneal Cancer Index,PCI)、术后化疗是否规范等,目前认为病理类型是影响患者预后的主要因素[23]。
3 PMP保留卵巢功能的治疗方式和疗效
PMP治疗以手术为主,CRS是目前PMP常用的手术方式[25],术后辅助HIPEC。手术方式多采用Sugarbaker等[26]提出的肿瘤细胞减灭术,尽量清除所有病灶,并联合围手术期HIPEC。卵巢和子宫是女性腹膜种植转移的常见发生部位和复发部位,因此,为达到手术根治目的,CRS术中通常切除双侧卵巢。目前,PMP行保留卵巢的手术方式有2种:一是目前大多数学者施行的,在术中探查双侧卵巢外观正常时,保留单侧或双侧卵巢[5];二是治疗性腹腔镜手术中行疾病分期、阑尾切除、盆腔黏液的排空和大量冲洗,盆腔黏液的排空包括钝性分离卵巢表面的黏液性病灶,术后能恢复盆腔正常结构且肉眼无病灶[27]。2种手术方式的适应证不同,第一种手术治疗的适应证:有生育愿望且卵巢表面无病变的患者。禁忌证:①卵巢外观上被肿瘤浸润;②术中剖探卵巢怀疑局部浸润;③初次手术时单侧卵巢受累而保留的对侧卵巢;④因肿瘤浸润需行卵巢切除术;⑤明确表示不再有生育愿望[3]。目前,在CRS术中保留卵巢的研究中,Elias等[20]报道33例41岁以下PMP女性患者,接受完整的CRS联合HIPEC,其中有6例卵巢保留,无一例出现卵巢或腹膜复发。Ortega-Deballon等[27]报道7例有生育愿望的PMP行CRS联合HIPEC,4例保留双侧卵巢、3例保留一侧卵巢,2例术前接受促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist, GnRH-a)治疗,术后无一例复发。Kyser等[28]报道1例28岁PMP行CRS联合HIPEC,保留双侧卵巢,术后14个月随访未见复发,术后病理为恶性腹膜上皮样间皮瘤。第2种手术治疗的适应证:有生育愿望、术中病理检查为低级别黏液性肿瘤的患者[29]。Sheehan等[29]回顾性分析2012年1月~2015年1月英国腹膜恶性肿瘤数据库,4例PMP年轻女性(28~35岁)接受保留生育功能的治疗性腹腔镜手术,术中行阑尾切除、盆腔黏液排空和冲洗,同时行HIPEC,经过12~29个月随访,无影像学或腹腔镜检查证明疾病复发,这些病例术后病理均证实为低级别黏液性肿瘤,因此,认为PMP手术有选择性保留卵巢是可行的。
化疗会增加卵巢早衰的风险[30]。Blumenfeld等[31]建议对PMP患者保留卵巢治疗时加用GnRH-a来保护卵巢功能。2006年美国临床肿瘤协会(American Society of Clinical Oncology,ASCO)指南指出,癌症患者没有得到生育能力保存的选择,认为GnRH-a是一种保存生育能力的方法。在2013年的修订版中,ASCO指南的基本立场得以保持。GnRH-a可实现卵巢抑制,阻止卵泡发育成熟并保持性腺功能[31,32]。
4 PMP保留卵巢术后的妊娠情况
对于有生育愿望的PMP患者,保留卵巢手术治疗后有成功受孕并分娩的报道。目前,国际上共7项研究(5项个案报告和2项回顾性分析)报道14例接受保留生育力的CRS(至少保留一侧卵巢),年龄(28.8±5.9)岁(18~36岁)。CRS/HIPEC与妊娠的间隔时间平均29.6月(9~80个月)[5,27,28,33~36]。12例自然受孕,2例通过体外受精实现;1例发生妊娠高血压;6例自然分娩(2例早产),3例剖宫产;1例新生儿患先天性膈疝。14例接受保留卵巢治疗后成功受孕的PMP无病生存期平均64.1月(24~106个月)。见表1。这些研究显示PMP患者保留卵巢的治疗可以实现女性生育力的保存,且HIPEC不会导致不孕、流产和先天畸形。
CRS/HIPEC治疗后受孕的最佳安全间隔需要进一步研究探讨。目前的报道中,最短的受孕间隔是术后9个月,大部分在术后12~36个月受孕[27]。PMP治疗后复发的时间多为2年内,推荐的合理受孕时间应在24个月以上[37,38]。对于病理级别较高的PMP患者,术后通常需要辅助治疗,全身化疗也会增加先天畸形、流产以及早产的风险,更应该将受孕时间控制在24个月以上[39,40]。PMP患者保留卵巢功能治疗后成功受孕的孕妇,最终阴道分娩及剖宫产分娩均有报道[5,27,28,33~36]。极少数的病例在孕期出现PMP的复发,但是结局良好[39]。由于剖宫产可能导致癌细胞扩散和腹部切口内植入,更推荐阴道分娩。如果由于产科原因需要行剖宫产,应优先选择腹壁纵切口,以利于PMP复发需要再次行CRS的情况[38]。
5 总结与展望
PMP是一种罕见的临床综合征,PMP女性患者50%发生卵巢转移,但多为表面播散种植,其中50%为表面浸润。PMP首选CRS联合HIPEC治疗,CRS术中保留卵巢均严格遵循卵巢无病变的原则。多项研究表明有选择性保留卵巢是可行的,不影响PMP患者的生存率和复发率,并有成功生育的报道。但PMP保留卵巢的治疗临床病例分散,研究处于初始阶段,目前临床研究均为回顾性研究或个例报道,入组数据少,可能影响研究结果,需要更多高质量的前瞻性研究进一步探讨。
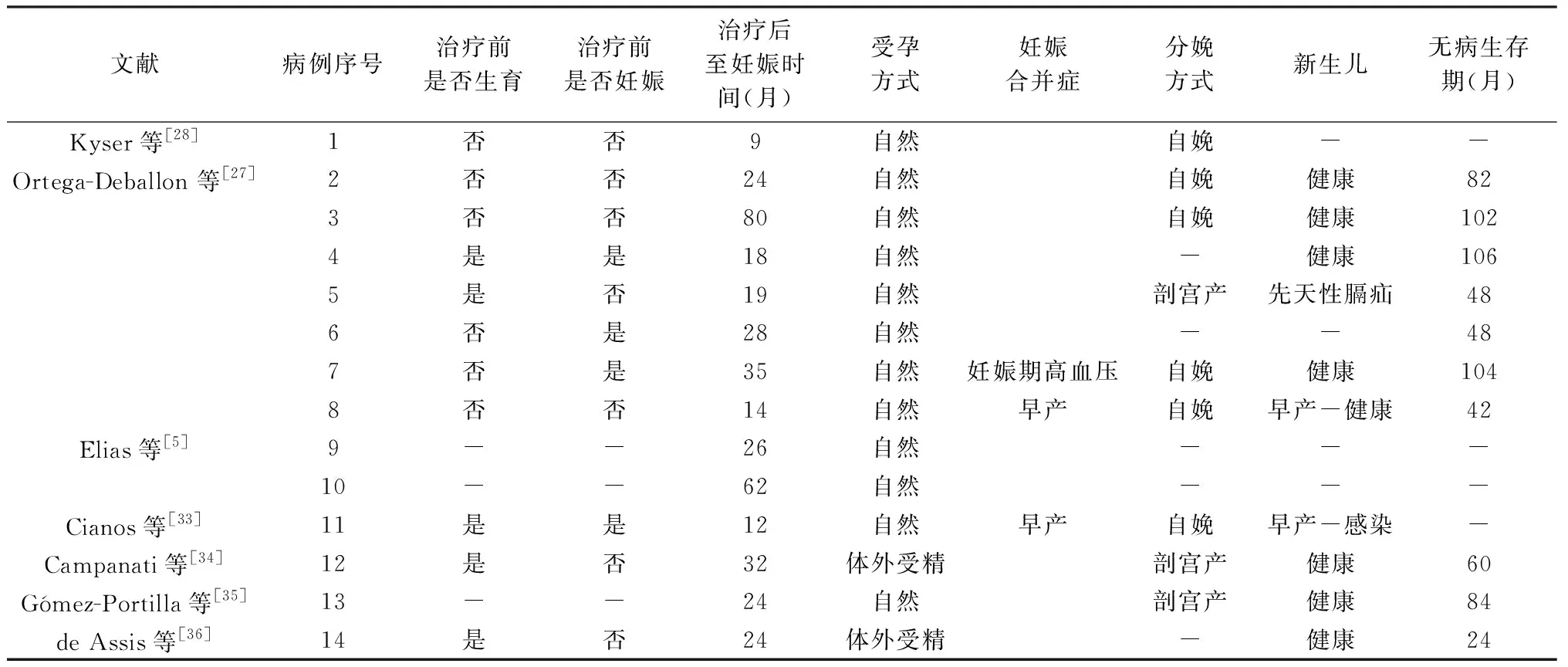
表1 PMP保留卵巢情况
