咪唑立宾治疗儿童紫癜性肾炎的疗效与安全性
2022-02-26匡仟卉柠高远赋高春林夏正坤
张 沛,周 昱,何 旭,史 卓,孙 涛,杨 晓,匡仟卉柠,姚 俊,方 香,高远赋,高春林,夏正坤
0 引 言
过敏性紫癜(Henoch-Schönlein purpura,HSP),是儿童和青少年的常见原发性血管炎[1],可导致皮肤、关节、胃肠道和肾等器官损伤。肾脏受累是主要临床特征,30%~50%的HSP患者出现肾脏损伤[2],诊断为紫癜性肾炎(Henoch-Schönlein purpura nephritis,HSPN),即使是轻微的肾脏损伤也可能导致终末期肾脏病(end-stage renal disease,ESRD)[3]。儿童HSPN临床和病理表现多样,部分患儿需要免疫抑制剂治疗。咪唑立宾(mizoribine,MZR)是一种从青霉菌属培养液中分离出来的嘌呤核苷酸合成抑制剂,可抑制T和B淋巴细胞的增殖和活性[4]。目前,MZR已应用在难治性肾病综合征(nephrotic syndrome,NS)、狼疮性肾炎(lupus nephritis,LN)、免疫球蛋白A肾病(immunoglobulin A nephropathy,IgAN)、类风湿性关节炎、干燥综合征和肾移植术后等临床治疗中[5-9]。然而,国内外关于MZR治疗儿童HSPN的报道较少,本研究旨在观察和分析MZR治疗儿童HSPN的有效性和安全性。
1 资料与方法
1.1 研究对象选择2016年1月至2017年10月东部战区总医院儿科收治的HSPN儿童60例进行前瞻性研究。诊断标准:在过敏性紫癜病程6个月内,出现血尿和(或)蛋白尿。其中血尿和蛋白尿的诊断标准分别为:血尿:肉眼血尿或1周内3次镜下血尿红细胞≥3个/高倍视野(HP);蛋白尿:满足以下任一项者:①1周内3次尿常规定性示尿蛋白阳性;②24 h尿蛋白定量>150 mg或尿蛋白/肌酐(mg/mg)>0.2;③1周内3次尿微量白蛋白高于正常值[10]。入组标准:①临床诊断和肾脏病理表现符合HSPN;②年龄<18周岁;③HSPN病理分级为I/II/III级;④随访开始之前未曾使用糖皮质激素或免疫抑制剂药物治疗。排除标准:①先天性和遗传性肾病,痛风性肾病,肾移植,急性肾损伤(acute kidney injury,AKI),估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)<60 mL/(min·1.73m2);②HSPN病理分级为IV/V/VI级;③临床分型为孤立性血尿,孤立性微量蛋白尿或合并镜下血尿;④活检后随访时间少于6个月;⑤除MZR外,使用其它免疫抑制剂;⑥血白细胞计数<3000/mm3;⑦血CD4+T<200个/U;⑧临床和病理资料不全。按照随机数字分组法随机分为2组:强的松Prednisone PDN 联合MZR治疗组(联合组):40例,单药治疗组(单药组)20例。所有患者随访6~24个月,随访期间,有5例患者失访(8.33%),随访结束,联合组38例,单药组17例。2组患者的性别、发病年龄、病程、肝肾功能及尿蛋白定量无统计学差异。本研究符合赫尔辛基宣言关于医学研究的基本原则,并获东部战区总医院伦理委员会批准(审批文号:2015JLHGKJDWLS-109)。
1.2 方法
1.2.1 治疗方案联合治疗组患儿给予MZR+PDN治疗,单药治疗组给予MZR治疗。MZR:3~5 mg/kg(标准体重)每日1次,早饭后用药,用药3个月后尿蛋白定量仍大于25 mg/(kg·24h)时可进行MZR冲击疗法(即10 mg/kg,隔日1次,早饭后服用),尿蛋白缓解6~9个月后可逐渐减量。调整MZR Cmax维持2~5 μg/mL,血药浓度过低,使用MZR冲击疗法,血药浓度过高,酌情减量。糖皮质激素用量:PDN 2.0 mg/(kg·d),分2次,用药4周,而后减至2.0 mg/kg/隔日晨起顿服,用药4周,每2~4周减2.5~5 mg,减至0.25~0.5 mg/(kg·d)维持。
1.2.2 观察指标和随访观察入组患者实验室检查结果、肾穿刺活检术病理结果和预后。肾穿刺后1个月、3个月、6个月、12个月和24个月复查血尿常规、血生化和eGFR等指标。长期随访预后分级[11]:A:正常:无高血压,体格检查正常,尿液和肾功能正常;B:轻微尿检异常:体格检查正常,伴有血尿(1周内3次镜下血尿红细胞≥3个/HP)或轻度蛋白尿(1周内3次尿微量白蛋白高于正常值);C:活动性肾脏疾病:高血压,蛋白尿(24 h尿蛋白定量>150 mg或尿蛋白/肌酐>0.2)或eGFR <90 mL/(min·1.73 m2);D:ESRD或死亡。血尿消失的定义:镜下血尿红细胞<3个/高倍视野。蛋白尿消失定义:24 h尿蛋白定量<150 mg或尿蛋白/肌酐<0.2。MZR血药浓度检测:在患儿早上服用MZR后的第2小时抽取2 mL血液,测定血清MZR浓度Cmax(最大药物浓度)[12]。

2 结 果
2.1 患儿一般资料比较2组患儿性别、年龄、临床表现、病理分型和实验室检查比较,差异均无统计学意义(P>0.05),见表1。

表1 联合组和单药组紫癜性肾炎患儿基本资料比较
2.2 患儿实验室数据比较2组患儿ALB、尿蛋白定量、尿NAG酶和尿RB蛋白的基线值水平以及各个随访时间点数值间比较,差异无统计学意义(P>0.05)。经治疗,联合组6个月、12个月和24个月ALB水平高于基线值(P<0.05);单药组12个月和24个月ALB水平高于基线值(P<0.05);联合组6个月、12个月和24个月尿蛋白定量水平低于基线值(P<0.05,P<0.01);单药组12个月和24个月尿蛋白定量水平低于基线值(P<0.05,P<0.01);联合组3个月、6个月、12个月和24个月尿NAG酶水平低于基线值(P<0.01);单药组6个月、12个月和24个月尿NAG酶水平低于基线值(P<0.05,P<0.01);联合组6个月、12个月和24个月尿RB蛋白水平低于基线值(P<0.05,P<0.01);单药组12个月和24个月尿RB蛋白水平低于基线值(P<0.01)。见表2。
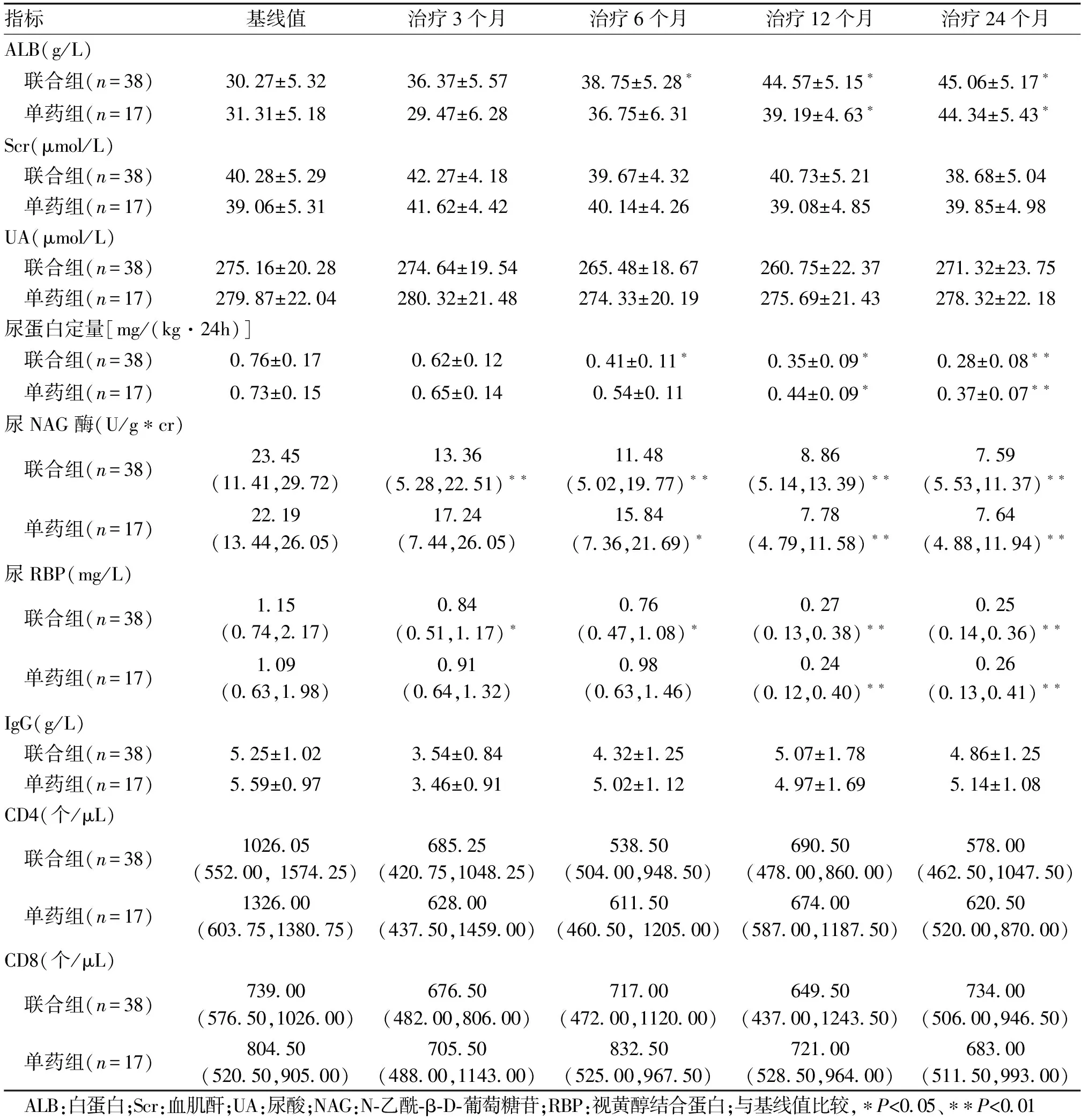
表2 不同随访时间联合组和单药组紫癜性肾炎患儿实验室数据比较
2.3 患儿治疗预后比较A级和总体预后分级:联合组(97.37%)高于单药组(82.35%),B级预后分级:联合组(2.63%)低于单药组(17.65%),差异均有统计学意义(P<0.05),见表3。联合组尿蛋白消失比例明显高于单药组(χ2=7.094,P=0.008),见图1。

图1 联合组和单药组紫癜性肾炎患儿尿蛋白消失曲线

表3 联合组和单药组紫癜性肾炎患儿长期预后分级比较[n(%)]
2.4 患儿药物不良反应和病情复发情况比较联合组血WBC升高比例高于单药组(P<0.05),联合组呼吸道感染次数高于单药组(P<0.05),联合组HSP复发次数低于单药组(P<0.05)。见表4。

表4 联合组和单药组紫癜性肾炎患儿不良反应和病情复发比较[n(%)]
3 讨 论
儿童HSPN的治疗和预后不容忽视,临床表现多样化,预后差异较大。临床表现为血尿和(或)微量蛋白尿的HSPN儿童,5%可发展为ESRD;如果表现为NS,40%可发展为ESRD;表现为肾炎性NS,会有超过50%的儿童发展为ESRD[11]。2012改善全球肾脏病预后组织(Kidney Disease:Improving-Global Outcomes,KDIGO)指南指出[13]:持续蛋白尿> 1 g/(d·1.73m2)且GFR> 50 mL/min的HSPN患者,推荐PDN治疗6个月,对于肾病范围蛋白尿的HSPN患者,推荐口服PDN+环磷酰胺(Cyclophosphamide,CTX)治疗。国内指南[10]也推荐儿童HSPN根据临床和肾脏病理表现,使用PDN和免疫抑制剂(包括:CTX、钙调蛋白抑制剂、吗替麦考酚酯和硫唑嘌呤等)治疗。但上述药物长期使用带来不同程度的不良反应,包括感染、胃肠道反应、骨髓抑制、肝损伤、肾小球和肾小管损伤等,从而导致疗程中断或影响药物的选用。因此,寻找安全有效的免疫抑制剂可能是治疗肾病范围蛋白尿的HSPN患儿及改善预后的关键点。
MZR是日本开发的一种免疫抑制剂,通过抑制肌苷单磷酸脱氢酶来抑制DNA合成,从而抑制T细胞和B细胞增殖,而且MZR 能够抑制机体内IgA 的产生,降低IgA在肾小球沉积后的异常免疫反应和炎症事件,且引起的并发症和不良反应少于常规免疫抑制剂[14]。MZR在日本最初批准用于治疗肾移植术后排异反应。近些年来,MZR在临床上已经广泛用于治疗类风湿性关节炎、肾病综合征、膜增生性肾小球肾炎和狼疮性肾炎等,临床疗效显著,不良反应相对较小[6,15-18]。
研究结果显示:MZR与激素联合应用,不仅增强了激素疗效,而且改善患儿远期预后。。在本研究中,24个月随访结束,2组患儿ALB水平高于治疗前基线值水平,而尿蛋白定量、尿NAG酶和尿RB蛋白低于治疗前基线值水平。且联合组显现出治疗的优势效果,上述实验室检查数据的恢复时间都早于单药组。单药组虽然在治疗后12个月出现尿蛋白水平的明显下降,但继续随访,尿蛋白水平未出现反复,凸显了MZR疗效的稳定性。联合组尿蛋白的治疗效果明显高于单药组。2组患者疗效的时间差异的原因在于:MZR可通过调节14-3-3蛋白,与糖皮质激素受体的结合,并以剂量依赖的方式增强这些受体的转录活性,减低糖皮质激素受体的使用剂量和增强其作用效能[12]。另外,文献研究表明:MZR还可抑制整联蛋白相关的激酶活化和糖原磷酸化合酶激酶3β,抑制细胞周期蛋白A[19]和预防钙调磷酸酶抑制剂的肾毒性[20],这也是后期我们的研究方向。
长期随访预后分级结果显示:联合组A级、B级及总体预后高于单药组,且2组患儿无一例出现ESRD。4例未达到A级预后的病例中,有1例尿蛋白时有反复,尿蛋白定量波动在0.3~0.5 g/24 h,3例患儿尿红细胞计数反复升高,数值波动在2~21/HPF,其中血尿反复1例为联合组病例,其余3例为单药组。MZR不仅可促进尿蛋白和血尿等临床症状的缓解,同时还可降低病情复发率。另外,MZR可提高激素受体的活性,减少激素的用量,缩短激素疗程,是合适类固醇减量剂[21-22]。在本研究中,MZR降低了疾病的复发率,本组患儿HSP和HSPN总体复发率分别为7.27%和5.45%,低于文献报道[23-24]。另外,MZR可促进ANCA相关性血管炎病情的缓解及降低复发率[25-26],而本研究中,联合组HSP复发率明显低于单药组,表明PDN联合MZR对IgA血管炎的病情复发亦有部分抑制作用。
研究表明,MZR总体不良反应较低,部分患者可出现过敏,恶心,呕吐,腹胀,骨髓抑制,肝功能损伤,高尿酸血症,严重感染等。其中高尿酸血症临床报道较多[27-28],本研究中未发现严重不良事件,共有3例患儿出现一过性尿酸增高,但都在短时间恢复正常。2组患儿都有病例出现一过性肝酶升高,但都未超过正常值2倍。呼吸道感染是激素和免疫抑制剂最常见的不良反应,本研究联合组发生感染的次数高于单药组,考虑与激素的作用有关。而MZR是从土壤中分离的子囊菌 M-2166株培养滤液中分离出来的一种咪唑类核苷,具有抗病毒活性[29],故临床应用MZR感染风险较低。MZR血药浓度影响其作用与不良反应:血药浓度为1.0 μg/mL时,淋巴细胞的激活被抑制约50%;浓度为0.8~3.0 μg/mL时,MZR与14-3-3蛋白结合并激活类固醇受体;浓度超过5 μg/mL时,不良反应明显增加[26],且MZR的有效性与药时曲线下面积(area under the drug-time curve,AUC0-t)存在良好的相关性[30]。本研究入组患儿平均血药浓度为(2.99±0.85)μg/mL,理论上不仅可抑制T细胞增殖和激活补体受体,并且调控其不良反应。
本研究研究结果显示:MZR治疗儿童HSPN蛋白尿伴血尿疗效理想,尤其联合激素治疗疗效显著,不良反应较少;联合组实验室指标恢复时间早于单药组,尤其是联合组尿蛋白的治疗效果明显高于单药组,长期预后佳,而单药组不良反应低于联合组,表明PDN联合MZR治疗的临床效果高于单药MZR,且长期预后好于后者。本研究的局限性:单中心研究,样本量较少,缺少观察咪唑立宾与其他免疫抑制剂比较的临床疗效和安全性,且随访过程中因多种原因部分病例失访,后期我们将进一步扩展研究规模和挖掘研究深度,延长随访时间,并观察肾脏病理的变化与临床疗效的关系,开展咪唑立宾与其他免疫抑制剂在临床应用的对照研究,为MZR治疗儿童肾脏病的临床应用推广提供依据。
