富铁炭对填埋覆土层甲烷氧化主导微生物活动的影响
2022-02-25白新月陈予珂黄丹丹徐期勇
白新月,陈予珂,黄丹丹,徐期勇
富铁炭对填埋覆土层甲烷氧化主导微生物活动的影响
白新月,陈予珂,黄丹丹,徐期勇*
(北京大学深圳研究生院环境与能源学院,广东 深圳 518055)
为了进一步明晰甲烷氧化菌群与环境间的相关关系,通过比较其甲烷氧化量和胞外聚合物(EPS)2种重要的微生物生命活动来探讨不同基质浓度与不同炭组间交互产生的环境差异对微生物群落的影响.结果表明,不同基质浓度对微生物多样性和种群差异影响最大.在甲烷与氧气(15%,/)均充足的情况下甲烷氧化累积量主要由Ⅰ型甲烷氧化菌贡献;而在某一组分相对不足(£10%,/)的气体浓度下,Ⅱ型甲烷氧化菌是消耗甲烷的主要微生物.在高甲烷低氧条件添加富铁炭或可有效缓解EPS堵塞且有利于Ⅱ型甲烷氧化菌的生长.
富铁生物炭;填埋覆土层;甲烷氧化菌;适应性反应;胞外聚合物
在世界范围内,甲烷(CH4)排放总量的50%~ 65%来自人类活动[1].根据美国EPA数据显示,2018年甲烷占温室气体总排放量的10%,垃圾填埋场仍是第3大甲烷排放源[2].填埋目前依然是我国城市生活垃圾的主要处置方式[3],当前中国和发达国家技术都无法实现填埋气100%收集[4],并且各地存在大量小规模堆放点和收集系统不完善的老旧填埋场.通常垃圾稳定降解需要50~100a的漫长周期[5],每年仍有大量的甲烷从填埋场直接排放.
原位生物覆盖是一种基于微生物强化作用原位脱除填埋场逸散多组分气体的功能覆盖系统[6],甲烷的氧化主要依赖甲烷氧化菌将CH4氧化成CO2来有效减弱填埋场甲烷排放强度.生物覆盖材料的种类、气体基质浓度及营养添加物等环境因素均会影响甲烷氧化的效率[7-9].国际上对将农林废弃物制成生物质炭施用于土壤作为碳增汇减排这种关键途径的关注越来越多[10].生物炭具有疏松多孔的稳定结构[11],对生物炭进行铁改性可以增大比表面积和孔容,加入覆土层中可以显著提高甲烷氧化效率[12-13].此外,加入生物炭可以缓解胞外聚合物累积造成的基质堵塞,提升甲烷氧化效果[14].将铁这种外源物质引入微生物生境中会促进等细菌的铁呼吸,通过胞外电子传递途径生物还原氧化铁[15-17],但对甲烷氧化主导群落中胞外聚合物(EPS)形成的影响尚不清楚.
本研究在3种模拟实际填埋场覆土层的填埋气基质浓度下,结合不同工艺制备的富铁生物炭的甲烷氧化速率表现,探究多因素交互作用下造成的环境差异对填埋场覆土层中微生物群落组成及产EPS的影响,为实际填埋场覆土层高效减排甲烷提供生物学调控参考.
1 材料与方法
1.1 实验材料
本实验用土为纯天然沙土,购自河北邯郸.菌液富集使用实验室生活垃圾填埋生物反应柱(填埋龄3a)中的覆土,采用NMS培养基培养[18],采集10g放在600mL培养瓶中,添加100mL营养液在甲烷浓度15%(/)的条件下150r/min震荡培养5d后,取上清液10mL加入90mL营养液,在与上一周期同样甲烷浓度下再次富集培养,循环3次后用于批次实验.模拟填埋气(CH4:CO2=60%:40%,)、氧气(纯度³99.999%)和氮气(纯度³99.999%)购于深圳祥元气体.
1.1.1 普通生物炭(BC_400)的制备 使用杨木屑作为原材料,通过10号筛(<2mm)筛分;在105℃的烘箱中干燥>72h以去除水分;在氮气流入量为400mL/min和加热速率为10℃/min的条件下在管式热解炉中进行热解;初始温度设置105℃,让温度逐渐升高至105℃后在此温度下保持20min.随后再加热30min,以达到400℃的最高温度,停留时间为0min,烧好后用磨砂口玻璃瓶保存.
1.1.2 富铁生物炭的制备 称取FeCl3·6H2O (分析纯)100g放入1000mL去离子水中制备成100g/L FeCl3溶液.然后将制备好的BC_400按照20%Fe/生物质比例, 即称取20g生物炭放入67mL FeCl3溶液中,超声处理2h;去离子水反复冲洗所得样品至滤液澄清以去除杂质并在105℃下烘干过夜制得BF_400.BF_600与BF_400仅热解温度程序不同,600℃热解温度设置条件为:初始温度30℃, 60min内逐渐升高至600℃,停留时间60min.烧好的生物炭在氮气氛围下冷却后取出再进行相同步骤的铁盐负载处理.FB铁盐预处理组生物炭将杨木屑烘干后先将部分过筛,将筛出的细木屑(<0.3mm)和筛上的粗木屑(>0.3mm,<2mm)以及不筛分的木屑分别按20%Fe/生物质比例浸泡,超声处理2h后105℃下烘干过夜,将预处理后的木屑放入管式热解炉中按照600℃热解温度程序进行烧制,分别得到3组生物炭FB_600(不筛分制备), FB_600S(细木屑制备),FB_600L(粗木屑制备).
1.2 生物炭铁含量测定
为了确认生物炭载铁是否成功,使用能量色散X射线荧光分析仪(EDX-LE型)对制备好的6种生物炭进行元素分析,生物炭主要含有Ca、Fe、K、Zn、Mn 5种金属元素,未改性生物炭BC_400的铁占比为8.46%,铁后负载处理组生物炭BF_400与BF_600铁占比为53.87%和41.66%,铁预处理组生物炭FB_600、FB_600S和FB_600L铁占比高达83.65%、78.96%和86.27%,说明铁元素成功负载到生物炭上.
1.3 监测甲烷氧化效率实验
将制备好的普通生物炭和富铁生物炭均以15%(/)占比与沙土充分混合后装入600mL培养瓶中,每组炭土设置3个重复组.使用氮气吹扫5min使得瓶内充满氮气,然后盖上瓶塞缠绕封口膜压上铝制压盖密封.每瓶用注射器滴入5mL甲烷氧化菌富集液.为实现目标CH4和O2浓度值,采用气袋和培养瓶连通的方式并进行气体的置换和混匀操作,具体操作为:首先通过计算得出CH4和O2用量并分别取气注入500mL气袋中,然后将气袋通过二通阀与充满氮气的培养瓶连通,通过针阀另一端连接的大注射器反复吹吸使气体混匀,最后再抽出与初始注入气袋同等体积的气体使瓶内气压平衡(表1),完成气体置换和混匀后,取5mL气体用GC(Agilent 7890B)测量初始气体组分,然后将培养瓶放入35℃恒温培养箱中进行培养,隔24h从各瓶中取气分析.待培养瓶氧气浓度低于2%时重新换气并记为一周期,最后计算每个培养瓶的总甲烷氧化累积量,甲烷氧化累积量计算方法为每周期第1d每克土炭混合覆土消耗的甲烷质量之和[19].

表1 基质气体浓度组分含量(%)
注:表中均为体积百分比.
1.4 微生物结构分析
将批次实验结束后处于群落相对稳定阶段的土取出,进行16SrRNA基因测序分析.具体分析过程为:DNA抽取和PCR扩增(PCR仪,ABI GeneAmp® 9700型),细菌扩增引物为338F(5’-ACTCCTACGG- GAGGCAGCAG-3’)和806R(5’-GGACTACHVGG- GTWTCTAAT-3’);引物扩增后由Illumina Miseq公司的Miseq PE300平台进行测序.数据处理包括:对测序序列使用UPARSE软件(通常在97%相似水平下的OUT)进行生物信息统计分析;使用UCHIME软件剔除嵌合体得到OTU的代表序列;将所有优化序列map至OTU代表序列并使用RDP分类器对每条序列进行物种分类注释,默认比对Silva数据库(SSU123),置信度阈值为0.7.
1.5 EPS组分测定
称取10g样品于50mL离心管中,加入0.9%氯化钠溶液20mL震荡过夜.将样品管超声10min后5000r/min离心10min,放入80℃水浴30min,取出后再离心20min,取上清液用0.45µm水系膜过滤后待测.提取后采用苯酚硫酸法对多糖含量进行测定,葡萄糖标准曲线为:=66.597+1.0848,2=0.996;采用牛血清蛋白试剂盒法测定蛋白质含量,BSA标准曲线为:=0.0053+0.008,2=0.997.多糖和蛋白质分别在490和562nm处测吸光度,与标准曲线对比,获得样品多糖和蛋白的浓度定量值.
2 结果与分析
2.1 微生物多样性分析
2.1.1 不同基质浓度对微生物的影响 物种丰富度(物种数量)和均匀度(物种相对丰度)是生物多样性和生态稳定性最重要的衡量标准[20].如表2所示,样本覆盖度全部在0.98以上,此测序结果中存在未被检出的细菌概率极低,测序结果基本可以反映样本真实情况.MO_1下细菌的丰富度明显低于其他气体条件,然而MO_1的总甲烷氧化量明显比其他气体条件下高(图1).以FB_600S为例,其观测到的细菌种类为604,是所有炭组中最低的,但该组的甲烷氧化累积量却最高(11.65mg/g).这说明甲烷氧化相关菌群已成为优势菌群,一定程度上限制了其他菌类的生长,导致了总体上细菌种类丰富度显著降低.甲烷氧化菌是在有氧条件下把甲烷作为单一碳源营养源的甲基营养微生物.在未经铁改性的炭组中,随着甲烷浓度的降低,细菌多样性指数成比例地增大,这说明富营养(CH4)环境向贫营养环境的转变显著增加了炭土中物种的多样性[21],即基质底物浓度的限制会提高微生物多样性.与其他基质浓度相比,MO_1的均匀度偏低,不利于群落生态稳定.当群落组成极不平衡,即一个或几个物种处于极端支配地位时,它们对环境压力的抵抗力就会降低[22-23].
2.1.2 炭组间差异对微生物的影响 3种气体基质浓度下各炭组的韦恩图(图2)可以比较是否负载铁盐、不同烧制温度、铁盐负载顺序以及粒径大小等多重炭制备因素在模拟不同覆土深度的气体环境因素的交互下对微生物细菌菌群在属水平上的相似差异性的影响.

表2 不同气体组分下各生物炭组的细菌a多样性参数

图1 甲烷氧化累积量
每周期第1d之和
在MO_0.5气体组分下,所有炭组存在256个相同的细菌属,其中BF_400和BF_600存在315个相同的细菌属,与其他炭组相比相同的菌种数量最低,而在MO_1和MO_2的条件下均是FB_600和FB_600S中的细菌相似性最低,说明在低碳源高氧浓度下炭的烧制温度相较于其他炭制备因素造成的环境差异对微生物种类影响较大,而在碳源充足的两种条件下粒径大小似乎对微生物种类差异的形成影响更大.生物炭的烧制温度越高,含氧官能团越少[24],而含氧官能团可以吸附截留更多的氮素[25],为微生物创造更富有营养的环境,从而有利于多种微生物的生长繁殖,因此BF_400比BF_600拥有更多的细菌种类,也解释了其相对更高的丰富度(表2).经BET分析显示测出的比表面积大小排列顺序为:FB_600L>FB_600>FB_600S,这与粒径越小比表面积越大的认知相悖,可能与铁盐负载后改变了生物炭原本的热解结构有关,生物炭的高比表面积有利于水分的保持,还可为土壤微生物提供更多生存繁殖空间[26],在MO_1和MO_2环境下,菌群的种类与比表面积的大小呈正相关,这从侧面印证了碳源充足情况下各组的微生物种类的差异性是由不同粒径的木屑制备出的炭的比表面积差异所致.这些生物炭固有性质所创造的表界面微环境差异均对微生物的生长有影响.

图2 细菌种类属水平韦恩图
2.2 甲烷氧化能力与菌群丰度对比分析
甲烷氧化菌主要分为Ⅰ型甲烷氧化菌和Ⅱ型甲烷氧化菌.目前填埋场覆土层中常见的优势甲烷氧化菌属主要有Ⅰ型和Ⅱ型[27].如图3所示,MO_0.5中Ⅱ型甲烷氧化菌在600℃烧制温度下丰度较高,其中BF_600和FB_600L高达80%以上,进一步印证了在低碳源高氧气浓度下炭的烧制温度所造成的环境差异对微生物影响较大.在MO_1中只存在Ⅰ型甲烷氧化菌,无Ⅱ型甲烷氧化菌.而在MO_2中,Ⅰ型甲烷氧化菌丰度比较高,在富铁炭组中均存在Ⅱ型甲烷氧化菌,在对照组BC_400中未检出,这说明铁对的生长有促进作用,铁可能参与了sMMO(一类不含亚铁血红素的含铁酶)的合成[28].

图3 Ⅰ型和Ⅱ型甲烷氧化菌丰度比(属水平)
为进一步探究不同CH4和O2基质浓度下进行甲烷氧化的主导甲烷氧化菌,将3种气体条件下不同炭组的甲烷氧化累积量与Ⅰ型和Ⅱ型甲烷氧化菌丰度值进行统计学上的相关性分析,结果如图4所示.
样本显著性分析表明,当<0.01时,样本有线性相关性且非常显著,当<0.05时,样本有线性相关性较为显著,在3种基质浓度下均存在显著的线性相关,说明得到的结果不是偶然因素导致的,具有统计学意义.皮尔森相关系数可以体现相关程度的强弱,值介于-1到1之间,图4中椭圆长轴斜率为正的部分>0,表明2个变量正相关,颜色越深越窄代表2个变量间相关程度越紧密,而椭圆长轴斜率为负则代表负相关且颜色越深越窄相关程度越高.在MO_0.5和MO_2下,Ⅱ型甲烷氧化菌与累积甲烷氧化量呈正相关且具有很强的相关性(³0.8),而在MO_1中则是Ⅰ型甲烷氧化菌显示出很强的相关性.结果说明,在MO_0.5与MO_2条件下,Ⅰ型和Ⅱ型甲烷氧化菌同时存在但Ⅱ型甲烷氧化菌是消耗甲烷的主要微生物,而在MO_1下Ⅰ型甲烷氧化菌主导甲烷氧化,且不存在Ⅱ型甲烷氧化菌.

图4 皮尔森相关性分析热图
*0.01<£0.05,**0.001<£0.01,***<0.001
出现以上差异的原因可能是因为2种类型的甲烷氧化菌对于填埋气环境的不同适应性.一般来说,Ⅰ型甲烷氧化菌在甲烷碳源和氧气均充足的环境中更容易占据主导地位,而Ⅱ型氧化菌在低甲烷碳环境下存活的更好[29],这是由甲烷氧化菌中起氧化作用的关键酶甲烷单加氧化酶(MMO)的活性决定.Baani等[30]发现在Ⅱ型甲烷氧化菌株sp. strain SC2中存在可以表现不同甲烷氧化动力学的颗粒状甲烷单加氧化酶(pMMO)的2种同工酶,1基因编码的pMMO1酶在甲烷混合体积浓度大于6´10-4才具有较高的活性,而2基因编码的pMMO2酶在低甲烷浓度下也能进行甲烷氧化.大多数Ⅱ型甲烷氧化菌表达2基因,但在Ⅰ型甲烷氧化菌中却缺少这种基因,且Ⅰ型甲烷氧化菌在缺氧环境中更脆弱[31].因此在甲烷浓度较高且氧气充足(MO_1)时,Ⅰ型甲烷氧化菌迅速占据主导地位进行高效甲烷氧化,而Ⅱ型菌在甲烷或氧气浓度较低(MO_0.5/MO_2)时成为贡献甲烷氧化累积量的主要微生物,即使在MO_2中Ⅱ型甲烷氧化菌的丰度远远低于Ⅰ型甲烷氧化菌.
2.3 富铁环境下的胞外聚合物分析
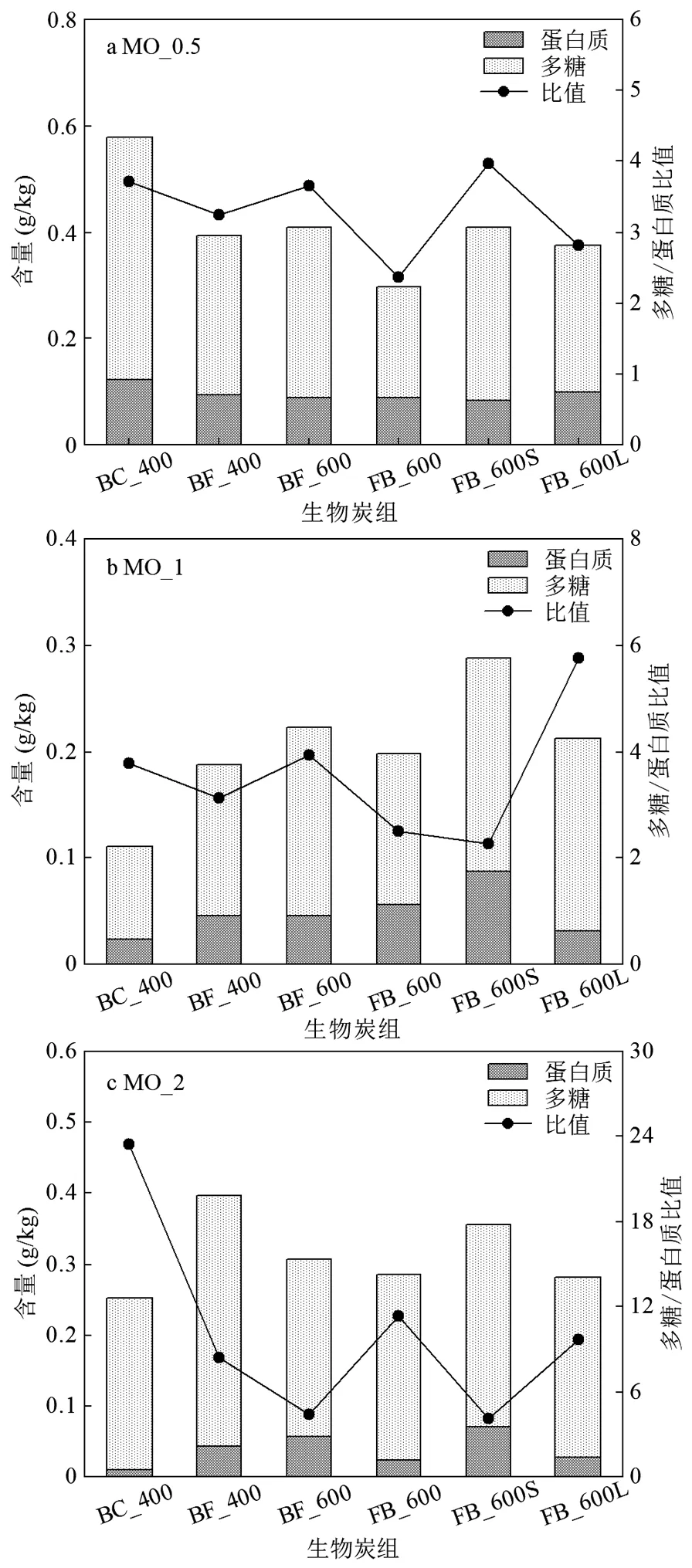
图5 不同炭组EPS组分
胞外聚合物(EPS)除了包含少量的核酸、脂类、腐殖质和糖醛酸以外,主要是由多糖和蛋白质构成.EPS参与微生物细胞胞外电子传递,作为电子储存中心,电子以电子跳跃的方式跨越EPS层加强细胞内部与外部不溶性电子的传递过程[32].不同金属离子对EPS的含量及组成成分的影响不同,Cu2+、Pb2+、Al3+等金属离子低浓度添加会促进EPS的形成,高浓度则会产生抑制效果[33].从图5可以看出,在MO_0.5中,蛋白质和多糖分泌量较MO_1和MO_2高,且加入富铁生物炭组比未改性生物炭组相比,蛋白质和多糖含量有明显的降低,但在MO_1和MO_2条件下,未改性生物炭组EPS含量较低,加入富铁生物炭组比未改性生物炭组的蛋白质和多糖都有明显的升高.当处于碳源不充足的贫营养环境下,微生物会分泌大量的多糖和蛋白质维持自身活性和稳定性[34],加强对外界养分离子及电子的摄取.当加入富铁生物炭后,铁为环境中提供了更多可被吸收的电子,因此微生物不需要花费更多的能量分泌多糖和蛋白质去捕获电子,这可能是MO_0.5中多糖和蛋白质含量相较于BC对照组减少的原因.而在碳源相对充足的MO_1和MO_2条件下,负载到生物炭上的微量铁会促进EPS的产生,且多糖与蛋白质变化趋势基本一致.
在MO_2中,多糖/蛋白质比值在加入富铁生物炭组中出现了明显的降低,主要表现为蛋白质组分的大量增加和多糖少量减少.生物膜胞外蛋白的含量一定程度上可以说明生物膜活性强弱,在氧气不充足的基质条件下,微生物生物膜一方面受到富铁生物炭作为电子供体的刺激生物膜活性增强并产生大量胞外蛋白,但又缺乏氧气作为电子受体完成电子传递呼吸循环,于是胞外蛋白中的胞外酶将胞外多聚物中的多糖脂类等大分子分解成为小分子供微生物吸收利用[35],导致多糖/蛋白质比值骤减.
3 结论
3.1 环境中基质底物浓度限制会提高微生物多样性.微生物丰富度越低,均匀度越低,说明某类菌群(相关性分析表明本实验为甲烷氧化菌)处于极端支配地位,该情况虽然使得生物炭改性覆土拥有更高效的甲烷氧化能力,但不利于微生物群落生态稳定.相似差异性分析表明,低碳源高氧浓度下炭烧制温度因素造成的环境差异对微生物种类影响较大,而在碳源充足的两种基质浓度下粒径大小影响更大.
3.2 富铁生物炭对的生长起明显的促进作用,相关性分析证实了在碳源和氧气均充足的情况下主要由Ⅰ型甲烷氧化菌消耗甲烷;而在甲烷或氧气某一气体组分相对不足的气体浓度下,Ⅱ型甲烷氧化菌是消耗甲烷的主要微生物.
3.3 加入富铁生物炭为环境中提供更多的可利用电子供体,且在缺乏氧气电子受体时会促进胞外酶水解多糖等大分子物质导致多糖和蛋白质的比值减少.因此在甲烷浓度高氧气浓度低的覆土条件下添加富铁生物炭或可有效缓解EPS累积而导致的覆土层透气性下降问题.
[1] Cubasch U, Wuebbles D, Chen D, et al. Introduction in: climate change 2013: The physical science basis. Contribution of working group I to the fifth assessment Report of the Intergovernmental Panel on Climate Change [M]. NY, USA: Cambridge University Press, 2013.
[2] EPA Inventory of U.S. Greenhouse gas emissions and sinks: 1990- 2018 [R]. Office of Atmospheric Programs, U.S.: Environmental Protection Agency (EPA Publication No.430-R-20-002). https://www. epa.gov/ghgemissions/inventory-us-greenhouse-gas-emissions-and- sinks-1990-2018.
[3] 姚光远,何品晶,刘玉强,等.生活垃圾填埋场主要环境问题及污染控制标准修订必要性初探 [J]. 环境卫生工程, 2020,28(4):1-10.
Yao G Y, He P J, Liu Y Q, et al. Primary discussion on the main environmental problems and necessity of revising pollution control Standard of MSW landfill [J]. Environmental Sanitation Engineering, 2020,28(4):1-10.
[4] 蔡博峰,刘建国,倪 哲,等.中国垃圾填埋场甲烷减排关键技术的成本和潜力分析 [J]. 环境工程, 2015,33(11):110-114.
Cai B F, Liu J G, Ni Z, et al. Evaluation of cost and potential of methane mitigation technologies of landfills in China [J]. Environmental Engineering, 2015,33(11):110-114.
[5] 曹 丽,陈 娜,胡朝辉,等.垃圾填埋场:世界最大的生态修复案例——以武汉市金口垃圾填埋场为例 [J]. 城市管理与科技, 2016, 18(3):24-27.
Cao L, Chen N, Hu Z H, et al. Landfill: the largest case of ecological restoration in the world——Taking Wuhan Jinkou Landfill as an example [J]. Urban Environmental Management and Technology, 2016, 18(3):24-27.
[6] 李佳徽.生活垃圾异味气体原位微生物降解及功能覆盖层削减研究 [D]. 上海:上海交通大学, 2019.
Li J H. In situ reduction of MSW odors by landfill functional covering layer based on screening of homologous microorganisms [J]. Shanghai: Shanghai Jiaotong University, 2019.
[7] Garg A, Achari G. A comprehensive numerical model simulating gas, heat and moisture transport in sanitary landfills and methane oxidation in final covers [J]. Environmental Modeling & Assessment, 2010,15 (5):397-410.
[8] 秦永丽,孙晓杰,王春莲,等.生物炭填埋场土壤覆盖层的甲烷减排性能和生物特征 [J]. 中国环境科学, 2021,41(1):254-262.
Qin Y L, Sun X J, Wang C L, et al. Methane emission reduction and biological characteristics induced by the landfill cover soil amended with biochar [J]. China Environmental Science, 2021,41(1):254-262.
[9] 周 凤,许晨阳,金永亮,等.生物炭对土壤微生物C源代谢活性的影响 [J]. 中国环境科学, 2017,37(11):4202-4211.
Zhou F, Xu C Y, Jin Y L, et al. Effect of biochar on metabolic activity of soil microbial carbon [J]. China Environmental Science, 2017,37 (11):4202-4211.
[10] 蔡博峰,朱松丽,于胜民,等.《IPCC 2006年国家温室气体清单指南2019修订版》解读 [J]. 环境工程, 2019,37(8):1-11.
Cai B F, Zhu S L, Yu S M, et al. The Interpretation of 2019 refinement to the 2006IPCC guidelines for national greenhouse gas inventory [J]. Environmental Engineering, 2019,37(8):1-11.
[11] 安 青,陈德珍,钦 佩,等.生物炭活化技术及生物炭催化剂的研究进展 [J]. 中国环境科学, 2021,41(10):4720-4735.
An Q, Chen D Z, Qin P, et al. Research progress of biochar activation technology and biochar catalyst [J]. China Environmental Science, 2021,41(10):4720-4735.
[12] Lyu H, Tang J, Cui M, et al. Biochar/iron(BC/Fe)composites for soil and groundwater remediation:Synthesis, applications, and mechanisms [J]. Chemosphere, 2020,246:125609.
[13] Huang D D, Bai X Y, Wang Q, et al. Validation and optimization of key biochar properties through iron modification for improving the methane oxidation capacity of landfill cover soil [J]. Science of the Total Environment, 2021,793:148551.
[14] Zhou X, Chen Z, Li Z, et al. Impacts of aeration and biochar addition on extracellular polymeric substances and microbial communities in constructed wetlands for low C/N wastewater treatment: Implications for clogging [J]. Chemical Engineering Journal, 2020,396:125349.
[15] Shi L, Squier T C, Zachara J M, et al. Respiration of metal (hydr)oxides by Shewanella and Geobacter: a key role for multihaem C-type cytochromes [J]. Molecular Microbiology, 2007,65(1):12-20.
[16] Wang J, Xie Z, Wang Y, et al. Synergy between indigenous bacteria and extracellular electron shuttles enhances transformation and mobilization of Fe(III)/As(V) [J]. Science of the Total Environment, 2021,783:147002.
[17] Yang Y, Xu M, Guo J, et al. Bacterial extracellular electron transfer in bioelectrochemical systems [J]. Process Biochemistry, 2012,47(12): 1707-1714.
[18] Sun M, Yang Z, Fu S, et al. Improved methane removal in exhaust gas from biogas upgrading process using immobilized methane-oxidizing bacteria [J]. Bioresource Technology, 2018,256:201-207.
[19] Huang D, Yang L, Ko J H, et al. Comparison of the methane-oxidizing capacity of landfill cover soil amended with biochar produced using different pyrolysis temperatures [J]. Science of the Total Environment, 2019,693:133594.
[20] Lu L, Xing D, Ren N. Pyrosequencing reveals highly diverse microbial communities in microbial electrolysis cells involved in enhanced H2production from waste activated sludge [J]. Water Research, 2012,46(7):2425-2434.
[21] Lee T K, Van Doan T, Yoo K, et al. Discovery of commonly existing anode biofilm microbes in two different wastewater treatment MFCs using FLX Titanium pyrosequencing [J]. Applied Microbiology and Biotechnology, 2010,87(6):2335-2343.
[22] Lieven W, Massimo M, Lieven C, et al. Initial community evenness favours functionality under selective stress [J]. Nature, 2009,458:623-626.
[23] Ehsani E, Hernandez-Sanabria E, Kerckhof F-M, et al. Initial evenness determines diversity and cell density dynamics in synthetic microbial ecosystems [J]. Scientific Reports, 2018,8:340.
[24] Tang J, Lv H, Gong Y, et al. Preparation and characterization of a novel graphene/biochar composite for aqueous phenanthrene and mercury removal [J]. Bioresource Technology, 2015,196:355-363.
[25] Yuan D, Yuan H, He X, et al. Identification and verification of key functional groups of biochar influencing soil N2O emission [J]. Biology and Fertility of Soils, 2021,57(4):447-456.
[26] 丁文川,曾晓岚,王永芳, 等.生物炭载体的表面特征和挂膜性能研究 [J]. 中国环境科学, 2011,31(9):1451-1455.
Ding W C, Zeng X L, Wang Y F, et al. Characteristics and performances of biofilm carrier prepared from agro-based biochar [J]. China Environmental Science, 2011,31(9):1451-1455.
[27] 梅 娟,赵由才.填埋场甲烷生物氧化过程及甲烷氧化菌的研究进展 [J]. 生态学杂志, 2014,33(9):2567-2573.
Mei J, Zhao Y C. Research progress on methane bio-oxidation process and methanotrophs in landfill [J]. Chinese Journal of Ecology, 2014, 33(9):1451-1455.
[28] 苏 瑶,孔娇艳,张 萱,等.甲烷氧化过程中铜的作用研究进展 [J]. 应用生态学报, 2014,25(4):1221-1230.
Su Y, Kong J Y, Zhang X, et al. Copper in methane oxidation: A review [J]. Chinese Journal of Applied Ecology, 2014,25(4):1221-1230.
[29] He R, Su Y, Leewis M C, et al. Low O2level enhances CH4-derived carbon flow into microbial communities in landfill cover soils [J]. Environmental Pollution, 2020,258:113676.
[30] Baani M, Liesack W. Two Isozymes of particulate methane monooxygenase with different methane oxidation kinetics are found in methylocystis sp. Strain SC2 [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008,105(29): 10203-10208.
[31] Wei X M, Su Y, Zhang H T, et al. Responses of methanotrophic activity, community and EPS production to CH4and O2concentrations in waste biocover soils [J]. Waste Management, 2015,42:118-127.
[32] Xiao Y, Zhang E, Zhang J. Extracellular polymeric substances are transient media for microbial extracellular electron transfer [J]. Science Advances, 2017,3(7):e1700623.
[33] 薛含含,田峪萍,曾智鑫,等.胞外聚合物(EPS)的检测及受金属离子胁迫作用的研究进展 [J]. 曲阜师范大学学报(自然科学版), 2020, 46(3):109-113.
Xue H H, Tian Y P, Zeng Z X, et al. Research progress in detection and metal ion stress of extracellular polymer substances (EPS) [J]. Journal of Qufu Normal University, 2020,46(3):109-113.
[34] Wilshusen J H, Hettiaratchi J P, De Visscher A, et al. Methane oxidation and formation of EPS in compost: Effect of oxygen concentration [J]. Environment Pollution, 2004,129(2):305-314.
[35] 胡学伟,李 姝,荣 烨,等.Cu2+对生物膜及其胞外聚合物的影响 [J]. 化工学报, 2014,65(3):1062-1067.
Hu X W, Li S, Rong Y, et al. Effect of Cu2+on biofilm and extracellular polymeric substance [J]. CIESC Journal, 2014,65(3): 1062-1067.
The effect of iron-rich biochar on microorganisms dominated by methanotrophs in landfill cover.
BAI Xin-yue, CHEN Yu-ke, HUANG Dan-dan, XU Qi-yong*
(School of Environment and Energy, Shenzhen Graduate School, Peking University, Shenzhen 518055, China)., 2022,42(2):787~793
To further clarify the relationship between methanotrophs and its environment in landfill cover soils, the impact of environmental differences caused by different substrate concentrations and biochar groups on microorganisms were investigated by comparing the two important microbial activities, including methane oxidation and EPS generation. Substrate concentrations had the greatest impact on microbial diversity and population differences. With sufficient carbon source and oxygen, the amount of methane oxidation was mainly contributed by type I methanotrophs; otherwise, type Ⅱ methanotrophs dominated. Under high methane and low oxygen conditions, adding iron-rich biochar may effectively alleviate EPS blockage and facilitate the growth of.
iron-rich biochar;landfill cover soil;methanotroph;adaptive response;EPS
X705
A
1000-6923(2022)02-0787-07
白新月(1997-),女,内蒙古霍林郭勒人,北京大学深圳研究生院硕士研究生,主要从事固体废弃物资源化处理研究.
2021-06-29
国家重点研发项目(2018YFC1902903);深圳市科技计划((JCYJ20190806145607372)
* 责任作者, 副教授, qiyongxu@pkusz.edu.cn
