浸润性乳腺癌多模态影像及肿瘤标志物的研究
2022-02-25任玉菊李桂芬
任玉菊,巴 双,李桂芬
(1.连云港市第二人民医院超声科,江苏 连云港 222000;2.连云港市第一人民医院超声科,江苏 连云港 222000; 3.连云港市第二人民医院医学影像科,江苏 连云港 222000)
乳腺癌是临床常见的恶性肿瘤,其浸润性与疾病临床诊断、治疗效果及预后质量关系密切,准确评估乳腺癌的浸润性有助于临床治疗方案的制定[1-2]。超声造影(contrast-enhanced ultrasonography,CEUS)和动态增强磁共振成像(dynamic contrast-enhanced MRI,DCE-MRI)是临床诊断乳腺癌的重要方法,但单一技术因成像模式局限,在诊断浸润性乳腺癌方面仍存在一定的误诊率和漏诊率[3-4]。多模态影像技术可融合不同模态图像信息,实现影像信息的互补与完善,可为疾病的诊断及治疗提供更全面的辅助信息[5]。肿瘤标志物是诊断恶性肿瘤的有效指标,其水平变化与疾病的进展、恶性程度密切相关[6]。当前,有关多模态影像技术在浸润性乳腺癌诊断中的应用及其与相关肿瘤标志物表达的关系研究报道较少。本研究在浸润性乳腺癌的诊断中应用多模态影像技术,并分析不同影像学参数与血清癌胚抗原(carcinoembryonic antigen,CEA)、组织多肽特异性抗原(tissue polypeptide specific antigen,TPS)和糖类抗原153(carbohydrate antigen 153,CA153)表达的相关性,旨在为临床浸润性乳腺癌的诊断提供参考依据。
1研究对象与方法
1.1研究对象
回顾性纳入2016年1月至2021年1月在连云港市第二人民医院经手术病理证实的120例乳腺癌患者,年龄为38~60岁,平均(48.76±7.63)岁。本研究已通过伦理审查。纳入标准:①患者年龄≥18岁,临床检查符合乳腺癌的诊断标准[7],且均经手术病理检查确诊;②影像学检查与手术间隔时间≤2周;③均为肿块型单病灶;④无相关禁忌症,均接受CEUS、DCE-MRI检查,影像学资料完整。排除标准:①既往存在放化疗、内分泌治疗史;②接受乳腺手术;③合并其他恶性肿瘤患者;④存在严重认知功能障碍,难以配合研究。手术病理检出浸润性乳腺癌共89例(浸润组),包括:浸润性导管癌70例,浸润性小叶癌19例;非浸润性乳腺癌共31例(非浸润组),均为导管内癌。
1.2研究方法
1.2.1 一般临床资料的收集
收集患者的年龄、病程、身体质量指数(BMI)、肿瘤最大直径、肿瘤原发灶、病理淋巴结转移(TNM)分期,乳腺影像报告和数据系统(BI-RADS)分类及淋巴结转移情况等一般临床资料。
1.2.2 CEUS的检查
采用彩色多普勒超声诊断仪(LogE9,美国GE)对患者进行超声造影检查,探头频率为4~11MHz。患者取仰卧位,首先行常规超声与彩色多普勒超声检查,明确病灶位置、形态、大小、回声及血流情况后,切换至造影模式;固定探头后经肘静脉团注2.4mL造影剂(SonoVue产品批号:19A093A,意大利Bracco公司),跟注5mL生理盐水冲管。记录180s造影图像,储存于硬盘。
1.2.3 DCE-MRI的检查
采用3.0T MRI系统MAGNETOM Spectra(西门子公司)对患者行常规MRI和DCE-MRI扫描,患者取俯卧位,使用8通道乳腺专用线圈,双乳自然下垂于线圈中。MRI扫描序列为:常规横轴位T1WI序列,矢状位T2WI脂肪抑制序列。扫描参数为①常规横轴位T1WI序列:TR 6.8ms,TE 2.3ms,层厚2.0mm,层间距0.1mm,视野360mm×360mm;②矢状位T2WI脂肪抑制序列:TR 3 920.0ms,TE 68.0ms,层厚5.0mm,层间距0.0mm,视野350mm×350mm,矩阵256×256。采用乳腺容积成像(VIBRANT)序列行乳腺横轴位T1WI动态增强扫描,扫描参数为:TR 3.6ms,TE 2.1ms,层厚2.0mm,层间距0.0mm,视野35mm×35mm,矩阵224×256,反转角15°;共38个期相,每期9s,扫描时间为368s;于第2个动态增强时相开始前使用双筒高压注射器于肘静脉注射对比剂扎特酸葡胺(Gd-DTPA,0.1mmol/kg,注射速度2.5mL/s),完成后注射20mL生理盐水。
1.2.4 血清肿瘤标志物的检查
取患者空腹静脉血5mL,以3 000r/min离心10min,分离血清后低温保藏待测。采用全自动电化学发光免疫分析仪(cobas e 601型,瑞士罗氏公司),以电化学发光法检测血清CEA、TPS和CA153水平,检测采用仪器配套试剂盒,严格按照流程进行相关操作。
1.2.5 图像的分析
由2名高年资的影像学医师对所有图像进行双盲分析,双方结论一致为最终结果,意见不统一时,由第3名医师进行分析,获得最终结果。
CEUS图像分析:使用TCA造影分析软件手动圈定感兴趣区(ROI),获得峰值强度(PI)值。
DCE-MRI图像分析:采用西门子Syngo MR Workplace工作站对DCE-MRI图像进行处理分析,参考肿块形状,在病灶达增强最高峰时手动圈定出ROI,范围3~4mm,病灶内部及边缘选4~6点,取平均值,应用QLAB软件自动绘出时间-信号强度曲线(time-signal intensity curve,TIC);根据TIC曲线形态将其分为Ⅰ型、Ⅱ型和Ⅲ型,其中Ⅰ型为持续型,病灶信号强度持续增加,动态增强扫描后期信号强度升高程度≥10%;Ⅱ型为平台型,动态增强扫描早期信号强度增加,中、后期信号强度升高程度<10%,或信号强度降低;Ⅲ型为流出型,动态增强扫描早期信号强度增加,中、后期信号强度降低程度≥10%[8]。通过TIC曲线计算强化率、峰值时间和信号增强比率。
1.3观察指标
①分析浸润性乳腺癌的CEUS、DCE-MRI影像特征。②比较浸润组与非浸润组CEUS、DCE-MRI定量参数、TIC分型及病灶内部灌注情况。③评估CEUS、DCE-MRI及其联合检查对浸润性乳腺癌的诊断价值,计算诊断准确率、灵敏度、特异度、阴性预测值和阳性预测值,其中,准确率=[(真阳性+真阴性)/总例数]×100%,灵敏度=[真阳性/(真阳性+假阴性)]×100%,特异度=[真阴性/(真阴性+假阳性)]×100%。CEUS诊断浸润性乳腺癌:病灶内存在造影剂灌注、毛刺征、边界不清,病灶呈高增强或不均匀增强;DCE-MRI诊断浸润性乳腺癌:病灶呈肿块样强化,形状不规则,存在毛刺征,内部呈不均匀强化;联合诊断以两种检查方式均为阳性结果。④比较浸润组与非浸润组的血清肿瘤标志物水平。⑤分析CEUS、DCE-MRI定量参数与血清肿瘤标志物水平的相关性。
1.4统计学方法

2结果
2.1两组患者一般临床资料的比较
两组患者的BI-RADS分类、淋巴结转移的分布差异均有统计学意义(P<0.05);两组患者的年龄、病程、BMI、肿瘤最大直径及TNM分期分布差异均无统计学意义(P>0.05),见表1。
2.2浸润性乳腺癌的CEUS和DCE-MRI影像特征分析
CEUS检查显示,病灶内部及边界均存在造影剂灌注,且病灶呈高增强,不均匀增强,以快进快退及快进慢退为主,增强后病灶范围扩大,边界不清。DCE-MRI检查显示,多数病灶呈肿块样强化,形状不规则,边缘毛刺,与周围组织分界不清,内部呈不均匀强化或环形强化;早期强化程度较明显,中后期呈持续性强化。典型病例1:患者女,54岁,手术病理诊断为左乳浸润性导管癌,图1A为CEUS下肿块图像;图1B为CEUS勾画ROI对应的TIC曲线,红色曲线为病灶区域造影剂浓度,黄色曲线为癌旁正常腺体组织区域造影剂浓度。典型病例2:患者女,48岁,手术病理诊断为左乳浸润性导管癌,图2A为DCE-MRI图像,肿块形状不规则,边界不清,呈环形强化;图2B为TIC曲线。

表1 两组患者一般临床资料的比较结果Table 1 Comparison of general clinical data of the patients between the invasive breast cancer group and the non-invasive breast cancer
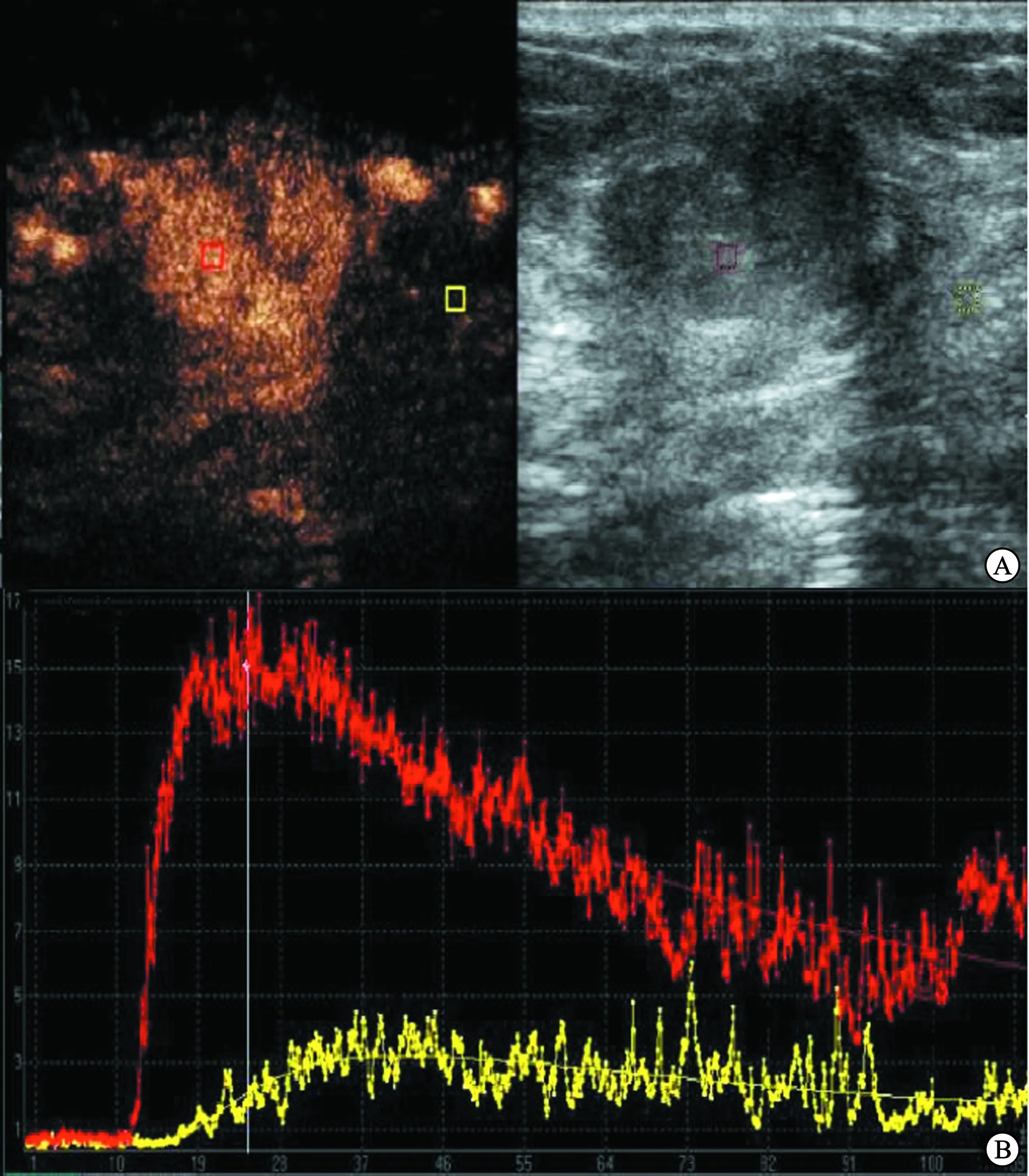
注:图A为CEUS下肿块图像;图B为CEUS勾画ROI对应的TIC曲线,红色曲线为病灶区域造影剂浓度,黄色曲线为癌旁正常腺体组织区域造影剂浓度。

注:图A为DCE-MRI图像,肿块形状不规则,边界不清,呈环形强化;图B为TIC曲线。 图2 典型病例2的DCE-MRI图像Fig.2 DCE-MRI images of typical case 2.Fig.A DCE-MRI image shows irregular mass with unclear boundaries and ring-enhancement;Fig.B TIC curve
2.3两组患者CEUS和DCE-MRI定量参数及病灶内灌注情况的比较
CEUS检查结果显示,浸润组患者多表现为高灌注,占70.79%(63/89),非浸润组多表现为低/等灌注,占61.29%(19/31),两组差异有统计学意义(χ2=10.094,P=0.001);浸润组内部灌注缺损占32.58%(29/89),非浸润组内部灌注缺损占25.81%(8/31),两组差异无统计学意义(χ2=0.495,P=0.482)。
CEUS定量参数比较显示,浸润组患者PI明显高于非浸润组(P<0.05);DCE-MRI定量参数比较,浸润组患者的强化率和信号增强比率均明显高于非浸润组,峰值时间明显低于非浸润组(P<0.05),两组的TIC类型分布差异有统计学意义(P<0.05),见表2。

表2 两组患者CEUS和DCE-MRI定量参数的比较Table 2 Comparison of quantitative parameters of CEUS and DCE-MRI of the patients between the invasive breast cancer group and the non-invasive breast cancer
2.4 CEUS和DCE-MRI及其联合检查对浸润性乳腺癌的诊断价值分析
CEUS检查诊断浸润性乳腺癌的准确率为76.67%,灵敏度为81.11%,特异度为63.33%;DCE-MRI检查诊断浸润性乳腺癌的准确率为84.17%,灵敏度为87.50%,特异度为70.83%;两者联合检查诊断浸润性乳腺癌的准确率为94.17%,灵敏度为96.63%,特异度为87.10%。CEUS联合DCE-MRI检查诊断与病理诊断结果的一致性高于CEUS、DCE-MRI单独检查的诊断结果(Kappa值分别为0.846、0.417、0.541),联合检查诊断的准确率与CEUS、DCE-MRI单独检查诊断的准确率比较,差异有统计学意义(χ2=10.674,P<0.001),见表3。

表3 不同检查方法诊断与病理诊断的比较[n(%)]Table 3 Consistency of different detection methods with pathological diagnosis[n(%)]
2.5两组患者的血清肿瘤标志物水平的比较
浸润组患者的血清CEA、TPS和CA153水平均明显高于非浸润组,差异均有统计学意义(P<0.05),见表4。

表4 两组患者血清肿瘤标志物水平的比较Table 4 Comparison of serum levels of tumor markers of the patients between the invasive breast cancer group and the non-invasive breast cancer
2.6 CEUS和DCE-MRI定量参数与血清肿瘤标志物水平的相关性分析
患者的PI、强化率、信号增强比率与血清CEA、TPS、CA153水平均呈正相关(P<0.05),峰值时间与血清CEA、TPS、CA153水平均呈负相关(P<0.05),见表5。

表5 CEUS和DCE-MRI定量参数与血清肿瘤标志物水平的相关性分析结果Table 5 Correlations of quantitative parameters of CEUS and DCE-MRI with serum levels of tumor markers
3讨论
根据乳腺癌的组织形态学特征,临床可分为浸润性乳腺癌与非浸润性乳腺癌,流行病学研究显示,非浸润性乳腺癌的5年生存率约为90%,远远高于浸润性乳腺癌的60%[9]。因此,早期对乳腺癌进行鉴别诊断,并采取积极的治疗方案,对改善患者预后具有重要意义。随着多种影像技术的快速发展,对乳腺疾病的诊断已从单一成像模式转向多模态影像技术,该技术可融合不同模态的图像信息,弥补了病灶影像信息的不足,实现了疾病的精确诊断与治疗,其诊断价值已在乳腺良恶性病变的鉴别诊断中证实[10]。
3.1 CEUS和DCE-MRI多模态影像诊断浸润性乳腺癌有较高应用价值
本研究显示,浸润组患者多表现为高灌注,非浸润组多表现为低/等灌注;CEUS定量参数比较,浸润组患者的PI、强化率和信号增强比率均明显高于非浸润组,峰值时间明显低于非浸润组,且两组的TIC类型比较存在明显差异,提示CEUS、DCE-MRI定量参数与浸润性乳腺癌的发病有密切关系,可作为浸润性乳腺癌诊断的重要依据。CEUS以造影剂进入肿瘤微循环后形成的信号增强图像为基础,可清晰显示肿瘤内部微血管的分布、走向及灌注情况,明显提高了超声对肿瘤新生血管的检测能力。DCE-MRI也可获得肿瘤血流灌注曲线和定量诊断参数,在评价浸润性乳腺癌方面较超声、钼靶检查更灵敏,可为常规MRI的诊断提供更多依据。徐海飞等[11]的研究发现,乳腺癌患者的PI明显高于乳腺良性病变患者,达峰时间短于乳腺良性病变患者。陈进等[12]在不同病理分型乳腺癌的诊断中应用MRI,发现导管内癌的强化率和信号增强比率明显低于浸润性导管癌,峰值时间明显高于浸润性导管癌。浸润性乳腺癌是指癌细胞穿破小叶腺泡或乳腺导管的基底膜,并广泛侵犯周围组织,与非浸润性乳腺癌相比,浸润性乳腺癌患者的淋巴结转移率和恶性钙化率更高,肿瘤内新生血管更丰富[13]。这也解释了本研究中浸润组与非浸润组CEUS定量参数存在明显差异的原因。
3.2 CEUS联合DCE-MRI多模态影像诊断可提高浸润性乳腺癌的诊断准确率
本研究进一步分析CEUS、DCE-MRI对浸润性乳腺癌的诊断价值发现,CEUS联合DCE-MRI诊断结果与病理诊断的一致性及诊断准确率均高于CEUS、DCE-MRI单独诊断结果,提示多模态影像诊断可明显提高单一模式诊断浸润性乳腺癌的准确率。多模态影像技术结合了CEUS和DCE-MRI的图像特点,弥补了以上两种检查手段的不足,不仅可清晰显示病灶边界、病灶与周围组织的空间位置关系,还可对肿瘤内部血流灌注进行动态观察,从而提高了判断浸润性乳腺癌的可靠性。
3.3 CEUS和DCE-MRI定量参数与血清肿瘤标志物水平的关系
血清肿瘤标志物是反应恶性肿瘤侵袭、浸润和转移的重要标志物,其中,CEA、TPS和CA153是临床常用的乳腺癌特异性标志物[14]。本研究显示,浸润组患者的血清CEA、TPS和CA153水平均明显高于非浸润组。有研究指出,非浸润性乳腺癌是浸润性乳腺癌的非特异性前驱体,恶性程度更低,且一般不发生淋巴结转移,若存在非浸润性乳腺癌治疗不及时,最终可能发展为浸润性乳腺癌[15]。CEA、TPS和CA153可经癌细胞的细胞膜侵入血液循环,使其在乳腺癌患者的血清中表达增高,而在正常的乳腺导管中不表达,随着肿瘤的生长、淋巴结的转移,其浓度均会明显升高,故本研究中浸润组患者的血清CEA、TPS和CA153水平较非浸润组更高。为验证多模态影像诊断浸润性乳腺癌的可靠性,本研究分析了CEUS、DCE-MRI定量参数与血清肿瘤标志物水平的关系,结果显示,患者的PI、强化率、信号增强比率与血清CEA、TPS、CA153水平均呈正相关,峰值时间与血清CEA、TPS、CA153水平均呈负相关,提示乳腺癌CEUS、DCE-MRI定量参数与血清CEA、TPS、CA153等肿瘤标志物的表达密切相关。因此,临床可联合多模态影像诊断与血清肿瘤标志物检测,以提高浸润性乳腺癌的临床检出率。
综上所述,多模态影像在诊断浸润性乳腺癌方面具有良好的诊断价值,可提高浸润性乳腺癌的诊断准确率,且CEUS、DCE-MRI定量参数与血清肿瘤标志物均存在明显相关性,可作为浸润性乳腺癌临床诊断、病情评估的重要指标。本研究存在以下不足:纳入的研究对象数量较少,病理分型较单一,在研究对象的选择上存在偏倚,可导致结果的偏差。在今后研究中,会进一步扩大样本量,对研究结果进行验证及深入研究。
