微创性肺表面活性物质治疗新生儿呼吸窘迫综合征的疗效及肺部影像学表现
2022-02-25夏丽娟
夏丽娟
郑州市第二人民医院新生儿科 (河南 郑州 450000)
新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)在胎龄<34周新生儿较为多见,原因为机体肺泡Ⅱ型上皮细胞分泌的肺表面活性物质(pulmonary surfactant,PS)缺乏,可导致呼吸末肺泡萎陷,易于降生后较短时间内出现呈进行性加重的呼吸窘迫[1]。具体呼吸困难特征见于气促、吐沫、“三凹征”及鼻扇等。此类病症甚为危重,且易并发诸如颅内出血(intracranial hemorrhage,ICH)等合并症,预后转归普遍不良,是造成新生儿早期死亡的首要原因[2]。对此,目前多应用外源性PS替代治疗策略。而关于PS替代治疗给药方案中,行气管插管-PS使用-拔管-经鼻持续气道正压通气(nasal continuous positive airway pressure,NCPAP)的INSURE技术应用最为广泛,可明显提升NRDS患儿救治成功率。但因治疗过程中需实施气管插管和正压通气,可损伤患儿未成熟肺组织及气道,且治疗失败后需行机械通气(mechanical ventilation,MV),支气管肺发育不良(bronchopulmonary dysplasia,BPD)风险提高,不利于患儿神经发育[3]。因此,亟待寻求一种更为温和的给药方案。近些年来,微创注入肺表面活性物质(less invasive surfactant administration,LISA)技术被广大医学界所重点关注。据欧洲、澳大利亚相关临床研究证实,LISA技术在NRDS患儿的救治中发挥着优异效果[4]。而LISA技术于我国尚未广泛开展,故疗效及安全性相关研究较少。基于此,本研究探讨LISA治疗NRDS患儿所获疗效,且通过肺部超声(lung ultrasound,LUS)行病情持续动态监测,旨在参照影像学表现更为准确评估患者经治疗后病情发展。
1 资料与方法
1.1 一般资料行便利抽样法抽取本院于2018年3月至2021年2月收治的NRDS患儿70例进行研究,运用简单随机化原则分设对照组和观察组,各35例。
纳入标准:符合《早产儿呼吸窘迫综合征早期防治专家共识》中有关标准[5];胎龄27周~36周,于出生12h内未行气管插管;适用PS替代治疗患儿。排除标准:于入院收治前存在PS治疗史;先天发育畸形;严重肺部炎症;临床资料不全。此次研究已获经本院医学伦理委员会商准执行,患儿家属同意和情。
1.2 治疗方法两组均于适宜环境温度下,给予液体管理、营养支持及合理抗菌药物使用等常规治疗维持病情稳定。符合PS用药指征,即:(1)NCPAP≥6cm H2O;(2)吸入气中的氧浓度分数(FiO2)≥30%。满足以上两项并使NRDS患儿经皮血氧饱和度(TcSO2)维持在90%以上,且患儿可行自主呼吸可使用PS治疗。PS产品选用注射用牛肺表面活性剂(商品名:珂立苏;国药准字:H20052128;规格70mg/支;厂商:华润双鹤药业股份有限公司),控制剂量范围40~100mg/kg,根据患儿病情状况灵活调整,通常70mg/kg便可取得较好疗效,针对病变进展明显,且伴有合并症等病情较重患儿,应用偏大剂量药的效果更佳。PS于使用前需作复温处理,将每支PS溶解于1.0~1.5mL的灭菌注射用水中,摇匀震荡至彻底溶解后以待使用。气管插管挑选高年资且具备娴熟操作技术的临床医师完成。对照组实行INSURE治疗方案,即气管插管-PS使用-拔管-NCPAP。具体实施过程如下:取患儿仰卧位,使患儿声门于喉镜下暴露,行气管导管插入,根据患儿胎龄及体重选取适宜型号,确定插管位置正确后实施固定,经导管一次性注入70~100mg/kg PS,加压通气3min,以保证PS可于患儿肺内均匀散布。若服药后患儿呼吸困难症状有所缓和,经监测SaO2>90%,可于10min后行气管插管拔出,再行NCPAP。观察组则采用LISA治疗方案,即在NCPAP下经喉镜直视行LISA置入后注入PS,LISA拔除后继续行NCPAP。具体实施过程如下:取患儿仰卧位,持续进行NCPAP,并于喉镜下暴露患儿声门,采用无锡市九龙医疗器械有限公司所购得的CRPS-101型LISA管,插入预期深度并实施固定,预期深度取决于患儿体重,若体重≤1kg,插管深度宜声门下1.5cm,若体重为1.0~1.5kg,插管深度宜声门下2cm;若体重为1.5~2.5kg,插管深度宜声门下2.5cm。移除喉镜,连接注射器,顺LISA管行PS缓慢推注,时间3~5min,于推注期间应回抽LISA管,避免PS反流出现,药物注射完毕后,行LISA管拔除,继续给予NCPAP治疗。若30s内气管插管未完成,应暂停或等待患儿恢复平稳体征后再次实施插管。若患儿于治疗期间出现心动迟缓或呼吸暂停,给予面罩正压通气。若两组INSURE、LISA治疗方案失败后,给予MV,符合以下≥1项指征均视作治疗失败:(1)呼吸性酸中毒:于动脉血监测中,pH值<7.2,二氧化碳分压(PaCO2)>65mmHg;(2)低氧血症:经吸氧支持治疗后,于动脉血监测血氧分压(PaO2)仍<50mmHg,抑或NCPAP时FiO2>60%;(3)呼吸暂停反复(重度):24h内发作频率>6次,或发作频率>2次需给予正压通气。
1.3 影像学检查患者均于入院时、PS治疗后6h、12h、24h采用LUS影像学检查进行动态持续监测。仪器采用超声Apogee 1000全数字彩色多普勒超声诊断系统(厂商:广东省汕头市超声仪器研究所股份有限公司),线阵探头,频率9MHz。患者经入院后即刻行LUS检查,以腋前线、腋后线、胸骨旁线及双乳头连线对患儿肺脏区域进行分区,均分为前上/下、侧上/下及后上/下,两侧各6分区,共12个。取患儿俯卧位,自第二肋间自上而下、由左及右依次垂直、纵向扫查,储备、记录各区域声像图,并根据病情随时动态复查。LUS检查及分析均由同一名超声诊断资质>3年且经验丰富的医师完成。
1.4 观察指标观察两组临床治疗情况、血气分析指标、不良反应事件及LUS影像学表现。其中,1)临床治疗情况:包括72h内MV使用率、二次PS使用率、给药成功率、NAPAP时间及住院时间;2)血气分析指标:涵盖PaO2、PaCO 2及FiO2,监测时点为入院时(T1)、PS治疗1h(T2)、PS治疗6h(T3)、PS治疗12h(T4)及PS治疗24h(T5);3)不良反应事件:囊括不良反应及并发症:(1)不良反应:PS反流、心动过缓[心率(HR)<100次/min]、气管插管损伤及TcSO2下降(低于85%);(2)并发症:BPD、视网膜病(retinopathy,ROP)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、脑室内白质软化症(periventricular leuko,PVL)、IVH及气胸(pneumothorax,PNX);4)LUS影像学表现:根据LUS影像学指征,具体见于“磨玻璃征”(以超声近场回声稍强,自浅及深回声逐步衰减,呈磨玻璃样表现,支气管“充气征”尚不清楚的轻度肺实变)、“雪花征”(于肺实变区域密集分布点状、细线样及斑片状支气管“充气征”,呈类雪花样表现)。按Brat等[6]研究中相关评分标准,依据每个分区B线数目、密度及征象进行评分,分值0~3分,总分36分,以区域内仅存A线计0分;以区域内B线数目≥3条,且存有间隙,未见融合计1分;以B线数目密集,可见融合现象,可能存在胸膜下肺实变计2分;以区域内存在广泛肺实变计3分。
1.5 统计学方法采用SPSS 22.0软件进行数据处理,符合正态分布的计量资料以(±s)形式统计,组间行LSD-t检验,组内行SNK-q检验,计数资料以“%”形式统计,行χ2检验、校正χ2检验或Fisher检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组NRDS患儿基线资料比较两组NRDS从患儿性别、胎龄、体重、分娩方式、首剂PS时间及产前激素使用等基线资料比较,差异无统计学意义(P>0.05),见表1。
2.2 两组临床治疗情况比较病例临床治疗情况中,二次PS使用率、给药成功率、NAPAP时间及住院时间比较,差异无统计学意义(P>0.05);而观察组72h内MV率为8.57%,相较于对照组(28.57%)更低(P<0.05),见表2。
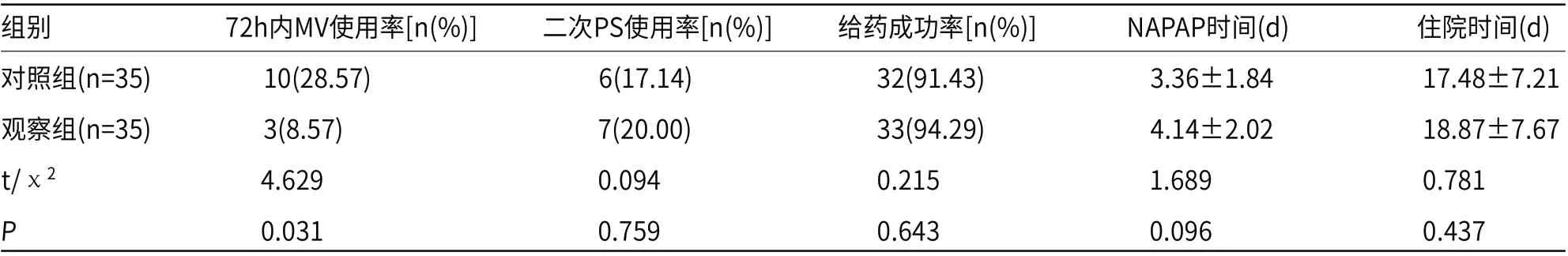
表2 两组临床治疗情况比较
2.3 两组血气分析指标比较于T2、T3、T4及T5时点,两组PaO2水平较T1时点均呈上升趋势,PaCO2、FiO2水平则下降(P<0.05);于T4、T5时点,观察组FiO2水平低于对照组(P<0.05),见表3。

表3 两组血气分析指标比较
2.4 两组不良反应事件比较两组PS反流、心动过缓、气管插管损伤及TcSO2下降发生率比较差异无统计学意义(P>0.05);两组BPD、ROP、NEC、PVL、IVH及PNX发生率比较差异亦无统计学意义(P>0.05),见表4。
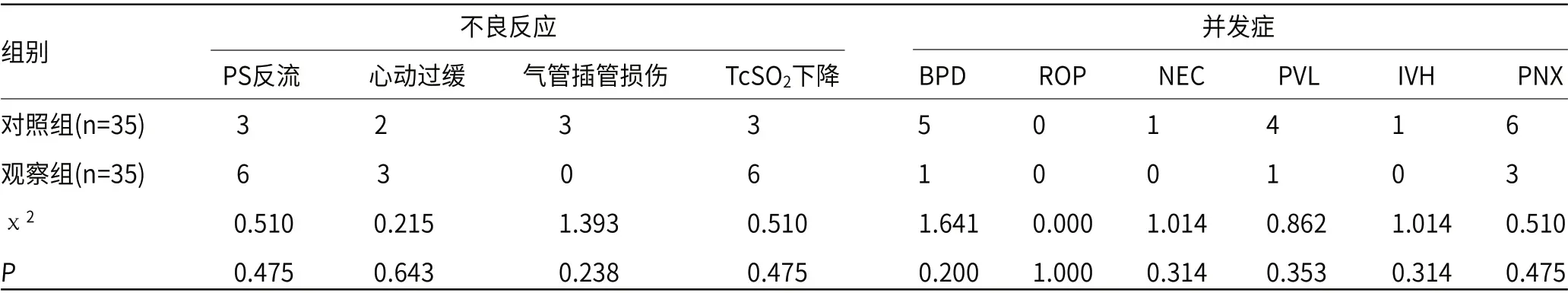
表4 两组不良反应事件比较(n)
2.5 两组LUS影像学表现比较两组NRDS患儿于入院前行LUS影像学检查,观察组有7例呈“磨玻璃征”样肺实变,累计范围不限,属轻度病症,24例呈“雪花征”样肺实变,尚未累及全部肺野,未伴发相关并发症,属中度病症,4例呈“雪花征”样肺实变,已累及所有分区,或诱发有气胸等并发症,属重度病症;对照组轻、中及重度病症依次为8例、24例及3例;经PS治疗6h、12h及24h后,给予LUS复查,两组NRDS患儿影像学征象逐步缓解,肺脏影像学评分均低于治疗前(P<0.05),见表5。
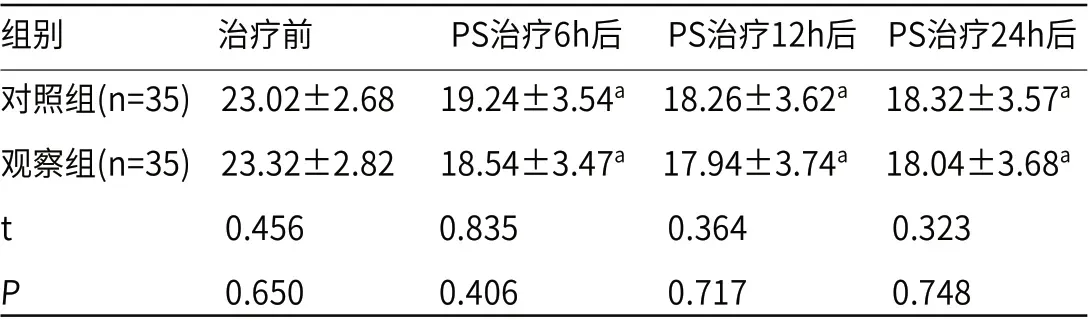
表5 两组LUS影像学表现比较(分)
3 讨 论
NRDS作为一类危重呼吸系统病症,是导致患儿早期死亡主要原因。通常NRDS患儿于降生后6h可出现气促、吐沫、“三凹征”等呼吸困难表现,呈进行性加重,至1~2d内病情最为严重[7]。究其原因在于机体内源性PS供给不足,由此肺泡张力损害,肺功能调节异常,肺泡陷萎,氧和功能及顺行性降低,并诱发PNX、IVX等并发症,预后转归偏差[8]。
关于NRDS治疗里程碑的标志是采用外源性PS替代治疗,可改善病死率,并有效降低并发症[9]。但最佳给药方案尚未明晰,仍在持续不断摸索及钻研中。据肖小芳等[10]研究显示,应用INSURE给药方案治疗NRDS,通过气管内滴注给药,并采用球囊手动或呼吸机机械通气,可有效减少NRDS患儿自主呼吸中断,且可减少PNX及呼吸机所致肺炎等并发症的发生。但该给药方式仍需气管插管,属有创操作,易损伤气道,并诱发疼痛应激,且行正压通气时,患儿未发育完全的肺组织遭受损伤,可提升BPD风险。此外,该技术存在一定的失败率,针对NRDS病情严重患儿,因肺泡气体交换功能大受限制,治疗失败率更高[11]。由此,为避免气管插管危害,寻求一种更为温和的给药方案具有重要意义。LISA作为目前研究热点技术,由德国Verder学者率先报道,现已在欧洲、澳大利亚新生儿重症监护(NICU)临床领域广泛开展。LISA通过细管注入PS,可规避插管损伤及机械通气需要。且于自主呼吸下给药,患儿机体肺脏氧合功能及顺应性得以提高,可降低PS常规插管给药带来的不利影响[12]。而LISA于国内尚未普及开展,仅有较少研究证实LISA可使NRDS患儿获益,但LISA安全性及可靠性依旧缺乏足够的研究数据支持。
基于此,拟以LISA治疗NRDS患儿为切入点开展研究,且考虑到动脉血气指标异常程度无法客观反映疾病程度,原因是病情过于严重的NRDS患儿经治疗血气分析指标难以纠正,故采用影像学技术表现辅助评估LISA治疗效果,所得研究结论更为准确、有效。据强光峰等[13]研究指出,NRDS患儿诊断及病情评估采用LUS检查,基准确性、可靠性均优于胸部X线,且基于LUS影像数据予进行半定量肺脏超声评分,可有效评测患儿机体肺通气功能,亦可有效预测PS治疗效果。本研究结果显示,观察组72h内MV使用率低于对照组,两组经治疗后PaCO2、FiO2水平相较于治疗前均有降低,PaO2水平则有提升。提示LISA和INSURE治疗均可改善患儿血气指标,但两组间血气指标比较,除T4、T5时点,观察组FiO2水平低于对照组。可见NRDS患儿采用LISA治疗,可降低MV使用率,且血气指标改善较好,由此可初步反映NRDS患儿应用LISA疗效略优于INSURE。而两组通过LUS技术检查,可见诸如“磨玻璃征”样肺实变、“雪花征”样肺实变等指征,且可观测累及分区范围及并发症表现,且从肺脏影像学评分来看,相较于PS治疗前,PS治疗后6h、12h及24h评分均有降低。提示应用LISA治疗,NRDS患儿病情得到改善。且刘敬等[14]研究认为:NRDS患儿“雪花征”样肺实变是病情进展至一定阶段出现的影像学表现,可根据病情程度对患儿行个体化针对治疗,而LUS超声诊断对于NRDS患儿应用LISA治疗具有较高指导意义。据此,可大体认为LISA技术应用于NRDS患儿具有确切疗效。分析原因在于:(1)LISA可使PS于机体肺脏散布均匀,且无需脱离NCPAP,并通过患儿自主呼吸,氧合功能及顺应性得到增强;(2)保证声门正常活动,可促进PS于肺脏分布及弥散;(3)采用NCPAP,有助于保持适宜压力使患儿的肺适度膨胀,且与患儿自主呼吸相结合,利于维持呼吸末正压[15-16]。现从LISA治疗NRDS患儿安全性方面分析,据林玲等[17]研究指出,NRDS患儿应用LISA治疗,易出现PS反流、呼吸暂停及心动过缓等不良反应。且由国外研究显示,LISA给药过程中,约有11.0%的患儿出现药物反流,且使用LISA管越大,PS反流风险越高[18]。而本研究中观察组PS反流发生率为17.14%,略高于上述研究PS发生率,这可能与医师专业水平、给药速度及镇静剂使用等因素有关。而由相关研究指出,应用LISA给药方案有助于降低诸如BNP等并发症发生率[19]。由并发症结果显示,观察组BPD、ROP、NEC、PVL、IVH及PNX发生率均低于对照组,但差异未见统计学意义,与上述研究有所差异,可能与本研究样本数目较少有关。但总体来看,应用LISA给药方案具有较高安全性。
综上所述,LISA及INSURE治疗NRDS均可起到较好疗效,但LISA整体获益更高,血气指标有一定改善,可降低72h内MV使用率,且不增加不良反应事件风险,是一项具有高安全性及有效性的给药方案。
