不同施氮条件下再生水灌溉对土壤理化性质及脲酶活性的影响
2022-02-25马欢欢崔丙健刘春成
莫 宇 ,高 峰 ,王 宇,马欢欢 ,张 茜 ,胡 超 ,崔丙健 ,刘春成
(1.中国农业科学院 农田灌溉研究所,河南 新乡 453002;2.中国农业科学院 研究生院,北京 100081;3.中国农业科学院 农业水资源高效安全利用重点开放实验室,河南 新乡 453002;4.河南省新乡市水文水资源勘测局,河南 新乡 453000)
0 引 言
【研究意义】再生水是指污水经适当工艺处理后,达到一定水质标准,满足某种使用功能要求,可以进行有益使用的水[1],目前水资源现状与环境保护的需求促进了再生水用于农业的发展[2]。施肥是提高产量的重要方式之一,但我国化肥的施用强度远超过了国家推荐标准,过量施用程度严重[3]。再生水中含有的氮、磷等营养元素,施入土壤可以提高土壤肥力,进而减少施肥量[4-5],因此进行再生水灌溉与施肥的合理配合使用研究对缓解农业水资源短缺、农业面源污染等具有重要意义。【研究进展】再生水灌溉对土壤理化性质及酶活性的影响已有一定研究。韩洋等[6-7]研究认为再生水灌溉能在一定程度上增加土壤养分,提高土壤脲酶活性;潘能等[8]研究认为再生水灌溉有助于提高公园绿地和农田土壤酶活性;裴亮等[9-10]研究认为再生水灌溉可显著提高土壤有机质量,且硝态氮在土壤中有一定富集现象。与上述研究结果不同,韩烈保等[11]研究认为再生水灌溉后土壤总氮、硝态氮、有机质无显著变化;郭魏等[12]研究认为再生水灌溉对土壤全氮、全磷及脲酶活性无显著影响。【切入点】目前针对再生水灌溉条件下土壤氮素分布与脲酶活性已有一定研究,但结果不相一致;且针对不同施氮条件下再生水灌溉土壤理化性质和脲酶活性的研究较少。【拟解决的关键问题】因此,通过盆栽实验,探讨不同施氮条件下再生水灌溉对土壤氮素分布及脲酶活性的影响,为再生水灌溉安全利用及化肥合理施用提供科学依据。
1 材料与方法
1.1 研究区概况
试验于2019年11月—2020年1月在中国农业科学院新乡农业水土环境野外科学观测试验站日光温室进行,地处东经113°15′55″、北纬35°15′39.16″,海拔73.2 m。多年平均降水量588.8 mm,降水主要集中于7—9月,多年平均蒸发量2 000 mm,年平均气温14.1 ℃,无霜期210 d。试验用土取自试验站周边0~20 cm耕层土壤,自然风干后去除杂质过2 mm筛,混合均匀后装盆,土壤基本理化性质见表1。供试作物为上海青(东方丽美青梗菜),采用PVC盆撒播的方式播种(d×h=30 cm×25 cm),每盆装土10 kg,定苗后每盆留10株,管理方式参考当地普通田间管理。

表1 供试土壤基本理化性质Table 1 Basic physicochemical properties of tested soil
本试验用再生水于2019年11月取自试验站附近河南省新乡市骆驼湾污水处理厂,污水来源主要为城市生活污水,处理工艺为A/O反硝化生物滤池和臭氧氧化组合工艺,处理后污水排放标准为《城镇污水处理厂排放标准》一级A,处理后再生水常规水质指标符合农田灌溉水质标准(GB5084—2005)和城市污水再生水利用农田灌溉用水水质标准(GB20922—2007)规定;清水取自当地地下水,试验用再生水及清水水质见表2。

表2 试验用再生水及清水水质Table 2 Quality index of reclaimed water and underground water
1.2 试验设计
试验设置水质和施氮量2个因素,其中水质为:清水(W)和再生水(RW),对应的施氮量为:N0、N120、N150和N180共4个水平,施用氮肥量分别为:0、120、150 mg/kg和180 mg/kg。组合后共8个处理,分别记为:WN0、WN120、WN150、WN180、RWN0、RWN120、RWN150和RWN180,每个处理设3个重复。使用肥料为尿素(TN≥46%)、钙镁磷肥(P2O5≥18%)和氯化钾(K2O≥60%),每盆施P2O5为100 mg/kg,K2O为200 mg/kg,均作为底肥一次性添加。上海青出苗后共灌水4次,分别于2019年11月21日、12月2、12日和24日各灌水1 L。
1.3 样品采集与测定方法
在上海青出苗60 d后,每盆选取9个取样点进行取土,深度为0~5、5~10 cm和10~15 cm,将同一深度9个土样均匀混合为一个样品。土壤pH值使用台式pH计(310P-02A,美国Orion Star A211)测定(土水比为1∶5);土壤电导率(EC)使用便携式电导率仪(DDB-303A型,上海仪电科学仪器股份有限公司)测定;土壤水溶性Na+、K+使用火焰光度计测定;土壤有机质量使用重铬酸钾容量法-外加热法测定;土壤全氮量使用开氏法消解,AA3型连续流动分析仪(Auto Analyzer 3型,德国BRAN LUEBBE)测定;土壤铵态氮量、硝态氮量使用氯化钙浸提,AA3型连续流动分析仪测定;土壤脲酶活性使用靛酚蓝比色法[13]测定,以每24 h每g土样中产生1 mg NH3-N表示。
1.4 数据分析
应用Microsoft Excel 2016进行初步数据处理;使用SPSS 25.0中单因素ANOVA进行显著性分析,利用Duncan’s新复极差法进行多重比较,显著性水平选为0.05;使用SPSS 25.0进行相关性分析。
2 结果与分析
2.1 再生水灌溉对土壤理化性质的影响
不同土层土壤理化性质如表3所示。在0~5 cm土层,与清水灌溉相比,再生水灌溉降低土壤pH值;在5~10 cm土层,同一施氮条件下,再生水灌溉处理和清水灌溉处理土壤pH值无显著差异。再生水灌溉条件下,与N0处理相比,增加施氮量降低土壤pH值,但N120、N150处理和N180处理间无显著差异。与清水灌溉相比,在0~5 cm土层,同一施氮条件下,再生水灌溉处理土壤EC值低于清水灌溉处理;在5~10 cm土层,N120处理再生水灌溉土壤EC值高于清水灌溉处理,但差异不显著,N150处理和N180处理再生水灌溉降低土壤EC值;在10~15 cm土层,N120处理和N150处理再生水灌溉显著降低土壤EC值,N180处理再生水灌溉土壤EC值高于清水灌溉处理,但差异不显著。再生水灌溉条件下,不同施氮条件下各处理土壤EC值无显著差异。土壤EC值随土层深度的增加呈先减小后增加变化,施氮条件下各处理在10~15 cm土层土壤EC值最高。在0~15 cm土层,同一施氮条件下再生水灌溉土壤水溶性Na+量显著低于清水灌溉;再生水灌溉条件不同施氮条件对土壤水溶性Na+量无显著影响。土壤水溶性Na+量随土壤深度增加而减小。同一施氮条件下,再生水灌溉水溶性K+量高于清水灌溉;再生水灌溉条件下,不同施氮条件对土壤水溶性K+量无显著影响。土壤水溶性K+量在0~5 cm土层和5~10 cm土层无显著差异,10~15 cm土层土壤水溶性K+量显著高于0~5 cm和5~10 cm土层的。总体来看,灌溉水质主要影响土壤pH值和盐分,对土壤有机质无显著影响。
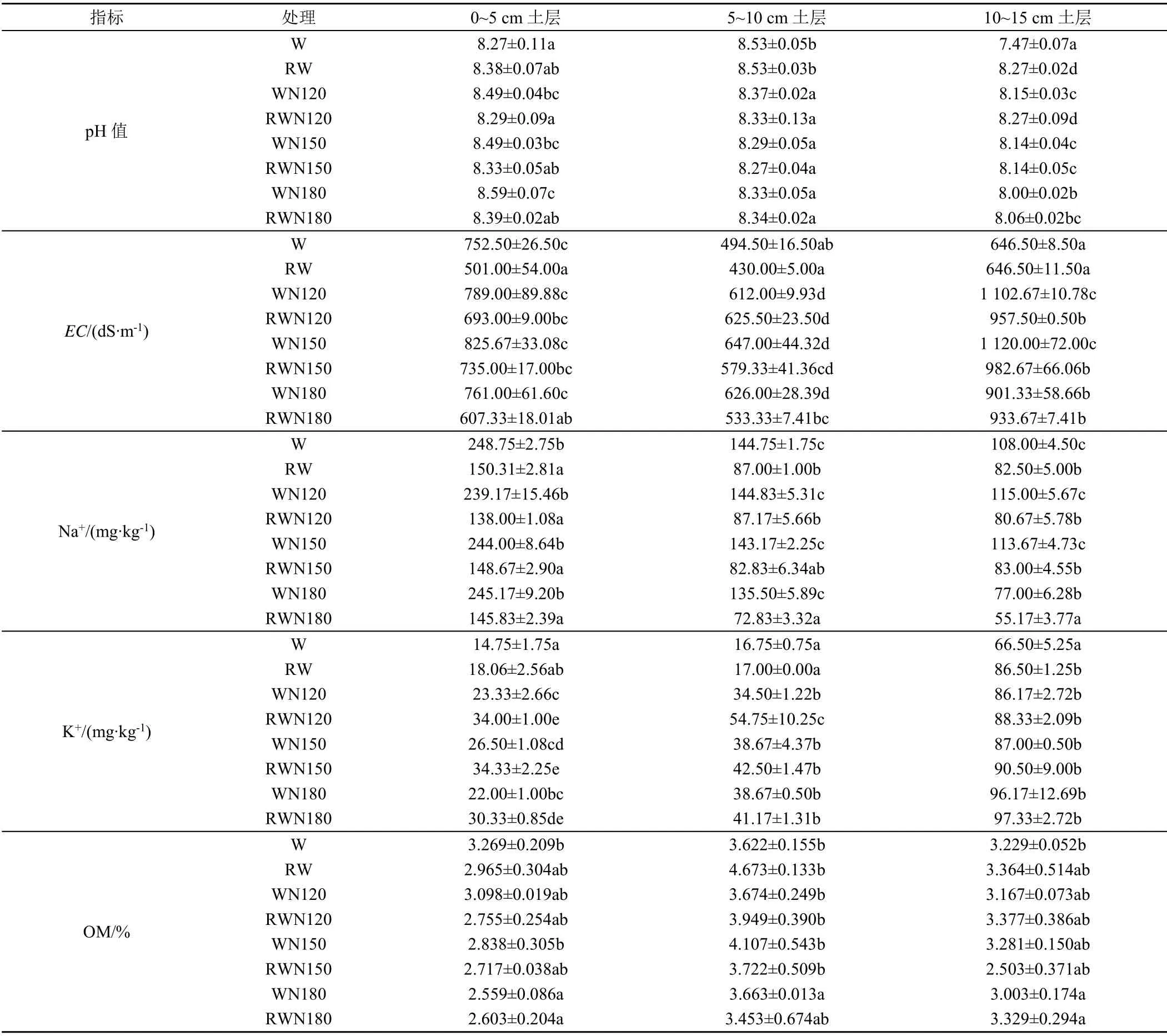
表3 不同处理土壤基本理化性质Table 3 Basic physicochemical properties of soil in different treatments
2.2 再生水灌溉对土壤氮素分布的影响
不同土层土壤氮素分布如表4所示。在0~5 cm土层,N0、N120处理和N180处理再生水灌溉土壤铵态氮量略高于清水灌溉,N150处理再生水灌溉土壤铵态氮量略低于清水灌溉。在5~15 cm土层,不同施氮条件下,再生水灌溉土壤铵态氮量均略高于清水灌溉。再生水灌溉条件下,在0~5 cm和10~15 cm土层,土壤铵态氮量表现为:N180处理>N150处理>N120处理>N0处理,随施氮量增加而增加;在5~10 cm土层,土壤铵态氮量表现为:N150处理>N180处理>N120处理>N0处理,随施氮量增加先增加后降低,在N150处理量最高。
由表4可知,土壤硝态氮量在0~10 cm无显著差异,在10~15 cm土层显著增加,这主要是由于硝态氮难以被土壤吸附,会随灌溉水向土壤深层移动[15]。施氮肥显著增加土壤硝态氮量,在同一施氮条件下,再生水灌溉土壤硝态氮量高于清水灌溉。再生水灌溉条件下,在0~5 cm土层土壤硝态氮量表现为:N120处理>N150处理>N180处理,随施氮量增加而减少,但差异不显著(p>0.05);在5~15 cm土层,土壤硝态氮量表现为:N180处理>N150处理>N120处理,随施氮量增加而增加,其中N120处理和N150处理间差异不显著(p>0.05),N180处理差异显著(p<0.05)。再生水灌溉后会增加土壤硝态氮量,且有向下层淋溶趋势,深层土壤硝化作用较弱,长期灌溉后可能会造成地下水污染[16]。
由表4可知,土壤全氮量随土层深度变化无显著差异。与清水灌溉相比,再生水灌溉降低土壤全氮量,但同一施氮条件下,再生水灌溉对土壤全氮量无显著影响。0~5 cm土层和10~15 cm土层各处理土壤全氮无显著差异。在5~10 cm土层,施氮肥显著增加土壤全氮量;再生水灌溉条件下,N120处理土壤全氮量最高。说明再生水灌溉条件下更有利于作物对氮素的吸收,同时短期再生水灌溉对土壤全氮量无显著影响。
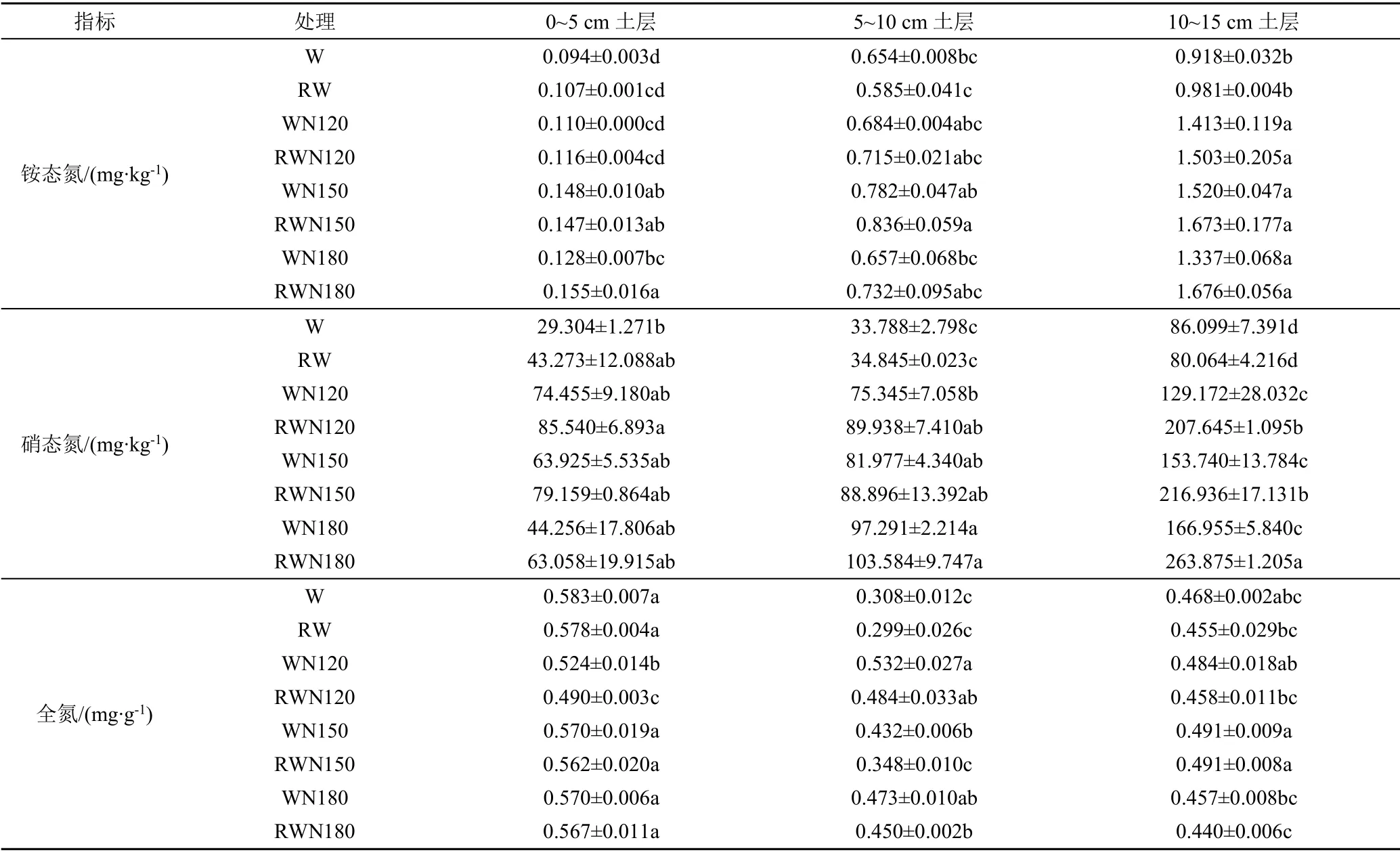
表4 不同土层土壤氮素分布Table 4 Distribution of soil ammonium nitrogen content in different soil layers
2.3 再生水灌溉对土壤脲酶活性的影响
不同土层各处理土壤脲酶活性分布如表5所示。各土层脲酶活性无显著差异(p>0.05)。在0~10 cm土层,同一施氮条件下,再生水灌溉土壤脲酶活性显著高于清水灌溉;再生水灌溉条件下,施氮肥显著增加土壤脲酶活性(p<0.05)。在10~15 cm土层,除对照组外,N120、N150、N180处理再生水灌溉土壤脲酶活性均低于清水灌溉,且土壤脲酶活性随施氮量增加而减少,N150处理和N180处理间差异不显著;再生水灌溉条件下,施氮肥对土壤脲酶活性无显著影响(p>0.05)。再生水灌溉条件下,各土层均表现为N120处理土壤脲酶活性最高。
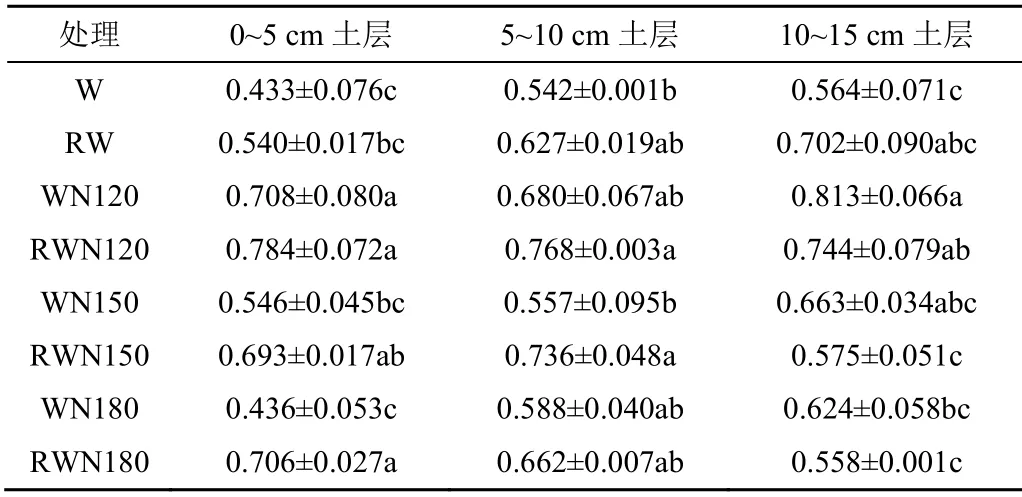
表5 不同土层土壤脲酶活性Table 5 Soil urease activity in different soil layers mg/g
2.4 土壤理化性质与脲酶活性相关性分析
表6为不同土层土壤脲酶活性与土壤理化性质间相关性分析结果。在0~5 cm土层,土壤脲酶活性与土壤水溶性Na+、K+和全氮显著相关,其中与水溶性K+显著正相关,与水溶性Na+和全氮呈显著负相关;在5~10 cm土层,土壤脲酶活性与土壤水溶性Na+显著负相关;在10~15 cm土层,土壤脲酶活性与土壤理化性质无显著相关关系。
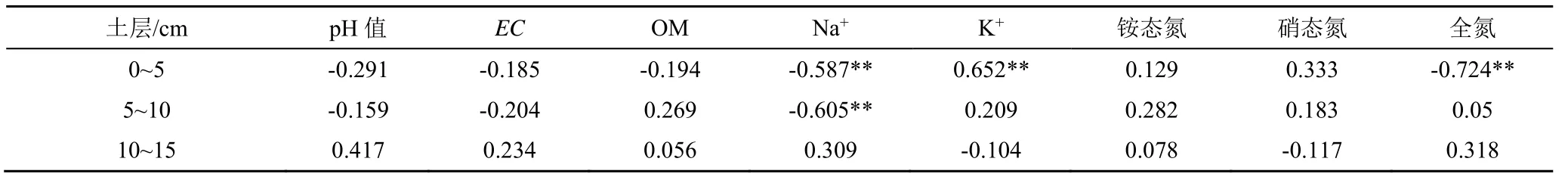
表6 土壤脲酶活性与土壤理化性质间相关性分析Table 6 Correlation analysis between soil urease activity and physicochemical properties
3 讨 论
与清水灌溉相比,再生水灌溉对土壤有机质、全氮无显著影响,这与韩烈保等[11]、郭魏等[12]、Guo等[17]、张娟等[18]研究结果基本一致,表明短期再生水灌溉对土壤养分无显著影响,但也有研究结果表明再生水灌溉显著提高土壤有机质、全氮[6,19],这可能是由于试验所用水质存在差异,且灌溉条件与作物类型都可能对试验结果造成影响。
再生水灌溉处理土壤pH值略小于清水灌溉,这可能是由于再生水中含有一定的有机质,有机质分解后产生的有机酸、CO2等会降低土壤pH值,但各处理pH值均在8.00~8.60之间,这是由于土壤自身的缓冲作用调节。灌溉水质是造成不同处理土壤可溶性盐量的主要原因,由于试验用清水与再生水中水溶性盐离子质量浓度存在差异,导致土壤水溶性盐离子浓度发生显著变化。地下水本身水溶性Na+量大于再生水中,所以灌溉后导致再生水灌溉处理土壤水溶性Na+量小于清水灌溉。
土壤铵态氮和硝态氮作为作物可以直接利用的矿质态氮,其高低直接反应土壤短期氮素供应状况[20]。本研究表明,再生水灌溉对土壤铵态氮无显著影响,显著增加土壤硝态氮。土壤铵态氮、硝态氮均随土层深度增加而增加,一方面是由于表层土壤铵态氮易挥发,且上海青属于浅根系作物,作物根系在0~10 cm土层较发达,对土壤矿质氮吸收能力较强[21-22];另一方面由于水是硝态氮在土壤中移动的载体,会随水分下渗向下运动[15]。试验所用土壤为砂质壤土,空隙大、透气性好,水分和铵态氮易下移,而土壤离子和硝态氮均带负电荷,不易被土壤胶体吸附,因此随水分下移,淋溶至深层土壤,长期灌溉后可能会对地下水安全产生威胁。
土壤脲酶作为C-N键的水解酶,能酶促土中尿素水解成氨,可以用于表征土壤氮素状况[23]。本研究表明,在0~10 cm土层再生水灌溉显著增加土壤脲酶活性,这可能是由于再生水灌溉增加了土壤微生物量[24],土壤酶主要来源于土壤微生物和植物根系的分泌释放[13];在10~15 cm土层,土壤脲酶活性随施氮量增加而增加,但差异不显著,这可能是由于高水平氮素抑制脲酶活性[12]。
4 结 论
与清水灌溉相比,再生水灌溉对土壤有机质和全氮的影响无显著差异,降低土壤pH值。由于试验所用清水含盐量高于再生水,因此同一施氮条件下,再生水灌溉显著减少土壤EC和水溶性Na+量,显著增加土壤硝态氮量和水溶性K+量。因此,短期再生水灌溉对土壤肥力无显著影响,但可能会造成土壤硝态氮的淋溶,进而威胁地下水安全。
根据土壤脲酶活性与土壤理化性质间相关性分析,在0~5 cm土层,再生水灌溉和施氮量对土壤脲酶活性均有显著影响,其中土壤全氮、水溶性Na+和K+是影响土壤脲酶活性的主要环境因子。
