阿尔茨海默病脑脊液标志物与淀粉样蛋白PET诊断相关性研究
2022-02-25武晓丹许欣茹张国旭王治国
武晓丹, 战 莹, 许欣茹, 张国旭, 王治国
北部战区总医院 核医学科,辽宁 沈阳 110016
阿尔茨海默病(Alzheimer′s disease,AD)是一种以进行性认知功能障碍和记忆力损害为特征的神经变性疾病,发病机制尚不明确[1]。有研究认为,其病理改变以β淀粉样蛋白(amyloid-β protein,Aβ)沉积形成的脑内老年斑和tau蛋白聚集形成的神经纤维缠结为典型特征[2]。AD相关神经病理学改变最早可于典型症状出现前的20年发生,疾病发展过程可被看成是连续的,分为无显著临床症状的临床前AD、轻度认知障碍(mild cognitive impairment,MCI)及AD阶段[3]。MCI患者每年转化为AD的比例高达10%~15%[4],早期预测MCI到AD的转变有助于临床医师评估AD风险及尽早干预。目前,常用的诊断AD的脑脊液标志物包括反映脑淀粉样蛋白沉积的标志物Aβ42和Aβ40,以及反映皮层纤维缠结的神经变性标志物t-tau和p-tau。有研究报道,t-tau/Aβ42、p-tau/Aβ42比单独的Aβ42、t-tau、p-tau具有更高的灵敏度和特异度[5]。11C-PIB是现阶段使用最广泛的Aβ特异性显像剂之一,能够从病理层面特异性反映不同阶段Aβ的沉积。本研究通过分析11C-PIB PET/CT脑显像与脑脊液标志物之间的关联性,探讨各脑脊液标志物诊断AD的临床价值。现报道如下。
1 对象与方法
1.1 研究对象 选取北部战区总医院2013—2021年收治的27例AD患者和29例MCI患者为研究对象。56例患者中,男性28例,女性28例;年龄64~77岁。AD纳入标准:简易精神状态量表(mini-mental state examination,MMSE)评分≤23分,临床痴呆评定量表(clinical dementia rating,CDR)分值≥0.5。MCI纳入标准:患者或知情者发现认知损害;存在认知功能损害的客观证据;保持独立的日常生活能力;尚未达到痴呆诊断标准。排除标准:存在其他脑血管疾病;其他类型痴呆、严重精神疾病或长期服用大量抗精神病药物;认知功能严重障碍不能配合检查。所有患者均接受11C-PIB PET/CT显像,并根据Aβ沉积进行分组。患者及其家属均签署知情同意书。
1.211C-PIB PET/CT显像及图像分析 采用GE MINItrace回旋加速器合成11C-PIB显像剂,放化纯度>99%,符合放射性药品的要求。PET/CT扫描仪型号为GE Discovery VCT PET/CT,所有AD患者均接受11C-PIB PET/CT检查,11C-PIB注射剂量为3.7 MBq/kg,注射后40 min开始采集,采用3D模式连续采集;对PET图像进行衰减校正,数据迭代重建后与CT图像经Xeleris工作站同机融合得到横断位、冠状位、矢状位图像,并对图像感兴趣区进行分析。由3名高年资医师采用盲法对图像进行分析评估,以小脑作为参考区域,计算11C-PIB在前扣带回、外侧颞叶、顶叶皮层、额叶皮层、枕叶区域平均最大标准化摄取值,全脑Aβ沉积为各感兴趣区标准化摄取值比平均值。采用1.41作为临界值,将扫描结果分为PIB阳性和PIB阴性[6]。
1.3 脑脊液标志物检测 腰椎穿刺获取脑脊液。采用酶联免疫吸附法对脑脊液标志物Aβ42 、t-tau、p-tau进行检测。采用PCR-RFLP法测定APOE ε4 表达情况[7]。
2 结果
2.1 患者分组及组间临床基本资料比较11C-PIB PET/CT将56例患者分为PET阳性组(n=37,PET+组)和PET阴性组(n=19,PET-组)。见图1。PET+组CDR、t-tau、p-tau、t-tau/Aβ42、p-tau/Aβ42均高于PET-组,Aβ42低于PET-组,差异有统计学意义(P<0.05)。PET+组携带APOE ε4的比例高于PET-组,差异有统计学意义(P<0.05)。见表1。
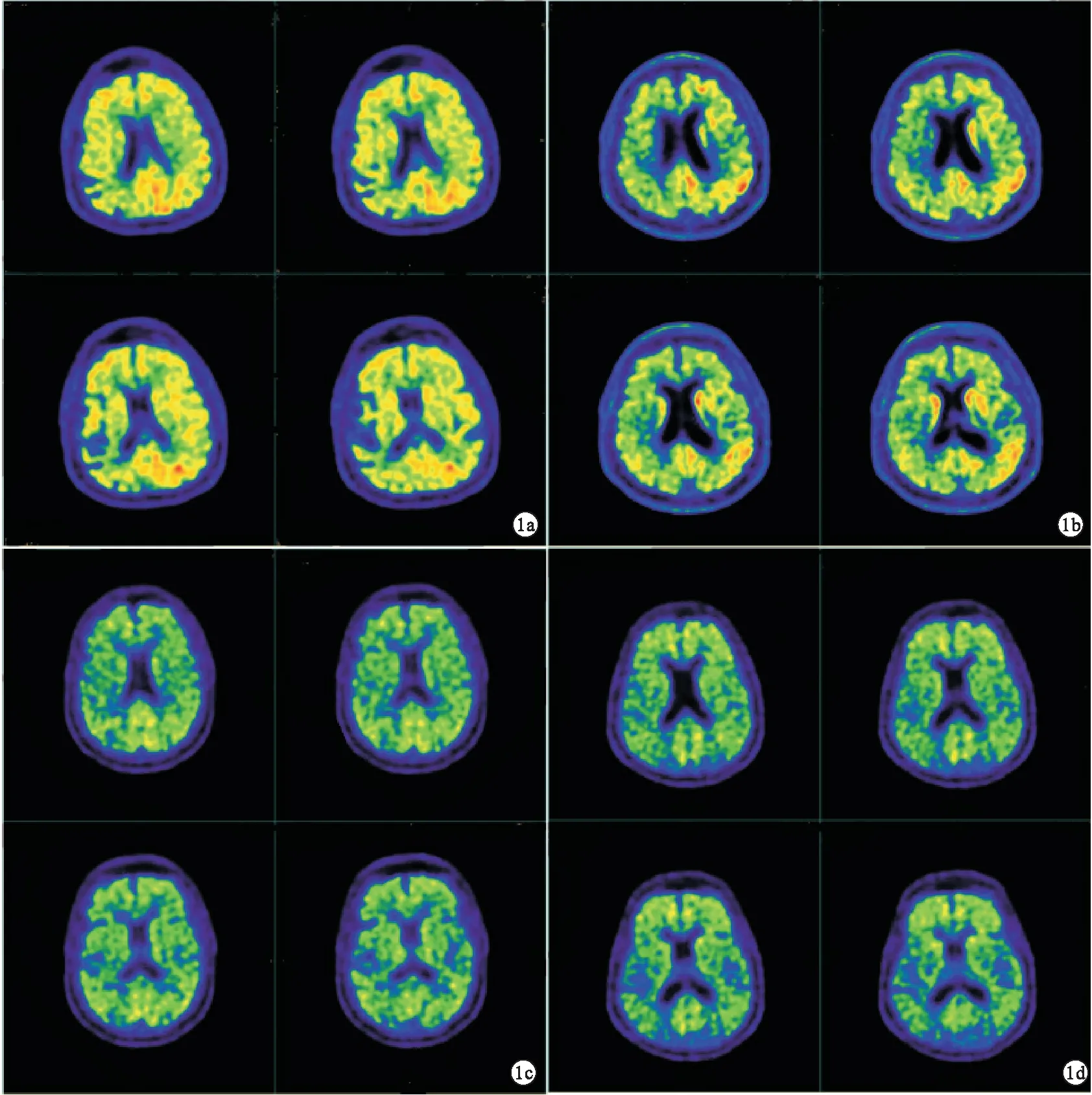
图1 11C-PIB PET/CT典型图像(a.AD患者,男性,68岁,MMSE评分17分,CDR=1.0,PET阳性;b.MCI患者,男性,63岁,MMSE评分24分,CDR=0.5,PET阳性;c.AD患者,女性,65岁,MMSE评分23分,CDR=0.5,PET阴性;d.MCI患者,男性,70岁,MMSE评分25分,CDR=0.5,PET阴性)
表1 两组患者临床基本资料比较
2.2 脑脊液标志物ROC曲线 脑脊液t-tau/Aβ42对11C-PIB PET显像诊断准确性最高,以下依次为p-tau/Aβ42、Aβ42、t-tau、p-tau。见表2、图2。

表2 脑脊液标志物ROC曲线指标
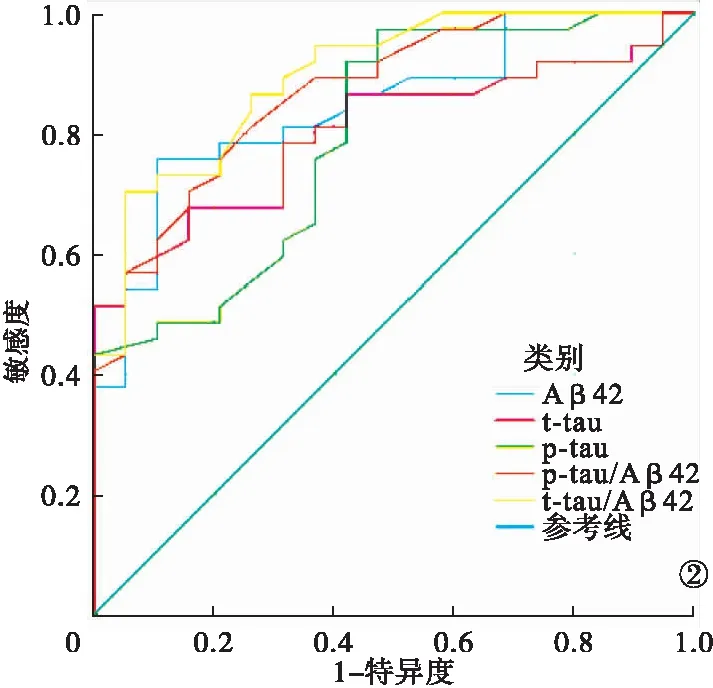
图2 脑脊液标志物ROC曲线
2.3 脑脊液标志物之间相关性及其与11C-PIB PET显像诊断一致性分析 脑脊液t-tau/Aβ42与t-tau、p-tau、Aβ42均具有相关性(r=0.750、0.475、0.006,P<0.05),其中,与t-tau相关性最强,与Aβ42相关性较弱。p-tau/Aβ42与t-tau、p-tau均具有相关性(r=0.685、0.655,P<0.05)。t-tau/Aβ42、p-tau/Aβ42与11C-PIB PET诊断的一致性较强(κ=0.824、0.754,P<0.05),Aβ42、t-tau、p-tau与11C-PIB PET诊断的一致性较弱(κ=0.552、0.499、0.471,P<0.05)。见图3。
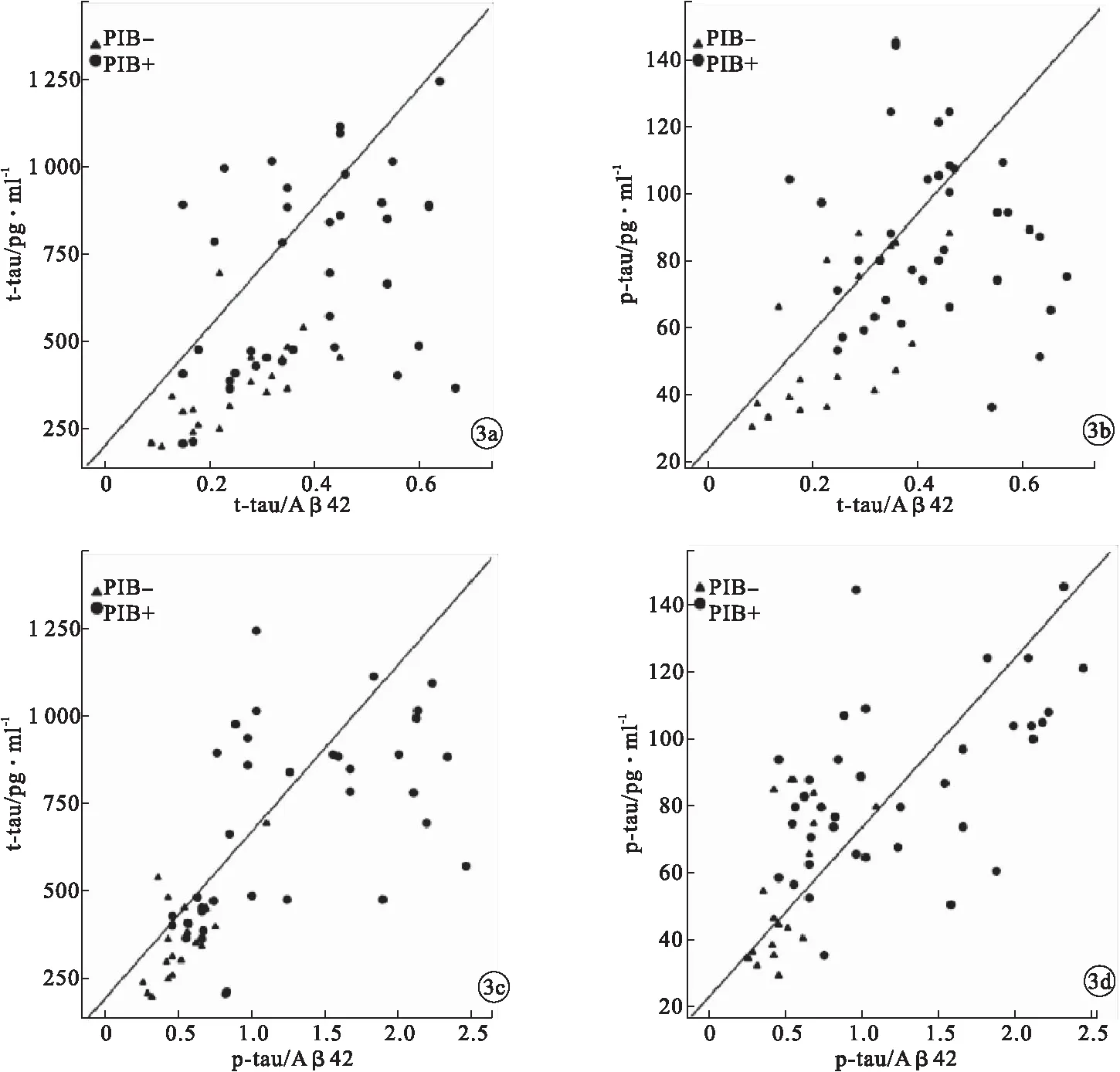
图3 脑脊液标志物之间相关性分析
3 讨论
AD是一种多因素导致的神经退行性疾病,临床表现为不同程度的记忆、认知功能障碍,发病率随着我国老龄化的加重而逐年递增,而诊疗率却很低。MCI是介于认知功能正常与AD之间的一种状态,起病隐匿,其临床表现与AD相似,且进展为AD的概率较高[8],因此,AD早期诊断及干预尤为重要。PIB PET显像通过同位素示踪标记放射性核素可高灵敏特异地反映脑内Aβ生理病理改变,已被广泛应用于临床AD的早期辅助诊断[9]。有研究表明,Aβ42、t-tau、p-tau的浓度变化可为AD的临床诊断提供支持性依据[10]。还有研究显示,脑脊液标志物及淀粉样蛋白沉积显像均与AD患者死后尸检结果具有相关性,且二者诊断符合率高达80%~90%[11]。因此,本研究采用淀粉样蛋白显像结果为切入点,建立脑脊液标志物最佳分割点,分析脑脊液标志物诊断的灵敏度、特异度,以及其与PIB PET显像诊断的相关性。
既往研究发现,淀粉样蛋白沉积阳性患者较阴性患者具有更低的脑脊液Aβ42水平和更高的t-tau、p-tau水平,能够间接反映异常Aβ斑块沉积和tau蛋白病理学改变[8]。本研究结果显示:PET+组CDR、t-tau、p-tau、t-tau/Aβ42、p-tau/Aβ42均高于PET-组,Aβ42低于PET-组,差异有统计学意义(P<0.05);PET+组携带APOE ε4的比例高于PET-组,差异有统计学意义(P<0.05)。多项研究表明,t-tau/Aβ42、p-tau/Aβ42、Aβ42/Aβ40相对于单一标志物在AD的诊断中显示出更佳的诊断性能,可用来预测淀粉样蛋白显像阳性率[12-13]。Sohee等[14]以Aβ-PET确定脑脊液标志物的最佳切割点,发现t-tau/Aβ42可以较好地预测认知功能衰退。本研究通过绘制ROC曲线得知,脑脊液t-tau/Aβ42对11C-PIB PET显像诊断准确性最高,以下依次为p-tau/Aβ42、Aβ42、t-tau、p-tau;同时,t-tau/Aβ42、p-tau/Aβ42与11C-PIB PET诊断的一致性较强(κ=0.824、0.754,P<0.05),Aβ42、t-tau、p-tau与11C-PIB PET诊断的一致性较弱(κ=0.552、0.499、0.471,P<0.05)。这说明,使用t-tau/Aβ42、p-tau/Aβ42较单独使用Aβ42、t-tau、p-tau具有更高的灵敏度和特异度,且能够提高与淀粉样蛋白显像诊断的一致性。本研究中,脑脊液t-tau/Aβ42与t-tau、p-tau、Aβ42均具有相关性(r=0.750、0.475、0.006,P<0.05),其中,与t-tau相关性最强,与Aβ42相关性较弱;p-tau/Aβ42与t-tau、p-tau均具有相关性(r=0.685、0.655,P<0.05)。这可能是因为脑脊液Aβ42具有较高的变异性,而脑脊液tau相关标志物水平与AD病理机制更为一致[15]。
综上所述,脑脊液标志物t-tau/Aβ42、p-tau/Aβ42与淀粉样蛋白显像诊断具有较高的一致性,其作为AD诊断的辅助生物标志物,具有一定的临床价值。本研究局限性主要在于样本量较小,可能存在统计分析偏差,未来需要扩大研究样本量。
